
Лекция 12.
Термодинамические функции состояния. Функции распределения. Классическая и квантовая статистики. Статистические распределения. (2 часа)
12.1. Микроскопические параметры. Вероятность и флюктуации. Распределение молекул /частиц/ по абсолютным значениям скорости. Распределение Максвелла.
12.2. Средняя кинетическая энергия частицы. Скорости теплового движения частиц.
12.3. Распределение Больцмана.
12.4. Теплоемкость многоатомных газов. Ограниченность классической теории теплоемкостей.
12.5. Статистический смысл термодинамических потенциалов и температуры. Роль свободной энергии.
12.6. Распределение Гиббса для системы с переменным числом частиц.
12.7. Принцип Нернста и его следствия.
Демонстрации:
1. Распределение молекул по скоростям.
2. Атмосферное давление.
Распределение молекул по скоростям.
Распределение Максвелла
Основные понятия теории вероятностей
Впервые решил задачу распределения молекул по скоростям Максвелл в 1859 году.
Пусть мы имеем ансамбль из N молекул
Параметр Х - принимает значения Х1;X2;X3.........Xi........
которые выпали соответственно N1,N2,N3 ........Ni ......раз..
Ni -- число молекул у которых параметр Х принимает значение Хi , тогда отношение
Pi = Ni / N
вероятность того что параметр Х имеет значение Xi
Пример : ИГРАЛЬНАЯ КОСТЬ
Кость имеет 6 граней, она должна быть однородной. Будем бросать кость 6 000 раз. События Хi -выпадание той или иной цифры от 1 до 6
Пусть 1 выпадает 999 раз P1=999/6000=1/6
2- выпадает 1001 раз P2=1001/6000= 1/6
3- выпадает 998 раз P3=998/6000 = 1/6
4- выпадает 1003 раз P4=1003/6000= 1/6
5- выпадает 996 раз P5=996/'6000 = 1/6
6- выпадает 1000 раз P6=1000/6000 =1/6
----------------------------------
Сумма общего числа испытаний равняется 6 000, а вероятность каждого из событий равна 1/6
Если же за N возьмем не 6 000 а 60 000, то вероятность Pi каждого из событий еще ближе к 1/6.
СВЯЗЬ СРЕДНЕГО ЗНАЧЕНИЯ С ВЕРОЯТНОСТЬЮ
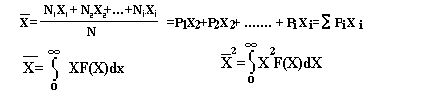
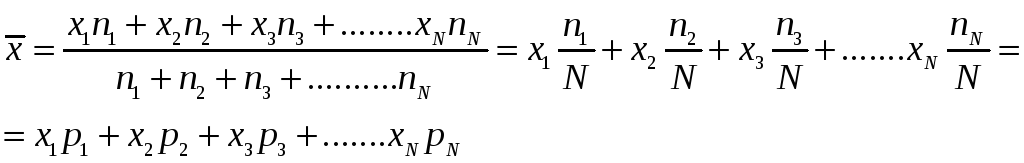
Если же случайные события или параметр Х изменяется не дискретно а непрерывно, то
dP(x)=F( X )dx
представляет собой вероятность нахождения параметра Х в интервале от Х до Х+dX
F(X)-- плотность вероятности или функция распределения вероятности .
Тогда число молекул, у которых значение параметра Х принадлежат интервалу от X до dX определяется соотношением:
dN=NdP(x)=NF(х)dх
РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА
Скорость молекулы тоже случайная величина , тогда число молекул ( dNv ) модуль
скорости которых лежит в интервале от V до dV определяется соотношением:
dNv=NdP : dPv=F(V)dV : dN=NF(V)dV
где F(V) -- функция распределения вероятности значения скорости
Основное уравнение молекулярно-кинетической теории приводит к выводу о том, что средний квадрат скорости молекул зависит от температуры газа и определяется формулой
![]() ,
,
которую можно также представить в виде
![]() .
.
Величину
![]() -
называют среднеквадратичной
скоростью.
Будем обозначать ее
-
называют среднеквадратичной
скоростью.
Будем обозначать ее
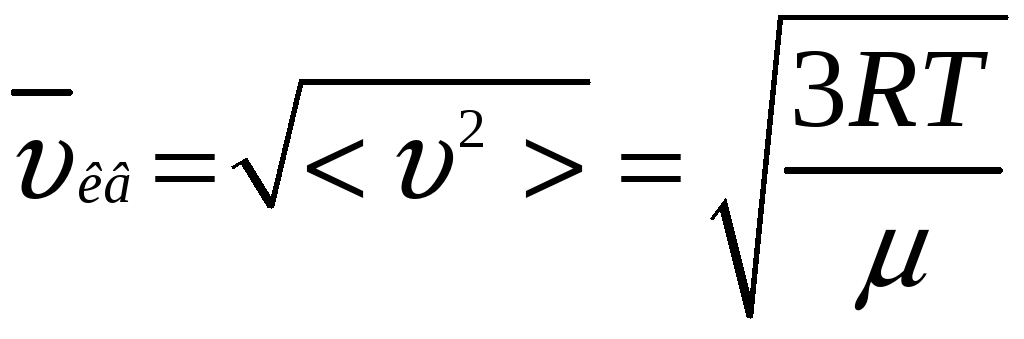 .
.
Расчеты показывают, что величина среднеквадратичной скорости молекул азота (воздуха) при нормальных условиях равна
![]()
Очевидно, что при
хаотическом движении молекулы газа
имеют не одинаковые скорости. Их величина
с течением времени непрерывно изменяется.
Скорости молекул могут принимать любые
значения в интервале от 0 и до бесконечности.
Однако средние характеристики этого
движения имеют вполне определенные
численные значения, зависящие только
от температуры газа. Впервые
закон распределения скоростей молекул
был получен Дж. Максвеллом в 1859 году. В
соответствии с этим законом доля молекул,
скорости которых принадлежат заданному
интервалу скоростей от
![]() до
до
![]() ,
определяется соотношением
,
определяется соотношением

З десь
десь
![]() - число всех молекул в сосуде,
- число всех молекул в сосуде,
![]() - число молекул, скорости которых
принадлежат заданному интервалу скорости
(от
- число молекул, скорости которых
принадлежат заданному интервалу скорости
(от
![]() до
до
![]() ),
),
![]() -
масса молекулы,
-
масса молекулы,
![]() -
абсолютная температура,
-
абсолютная температура,
![]() -
постоянная Больцмана.
-
постоянная Больцмана.
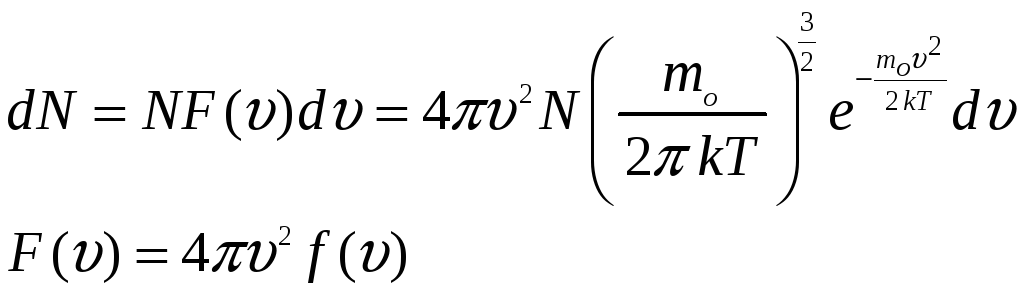
 -
плотность вероятности
-
плотность вероятности
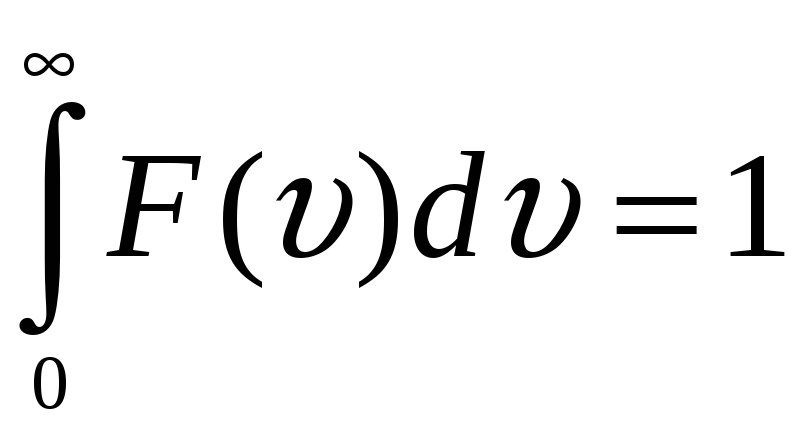
Приведенное
соотношение называют законом распределением
Максвелла по скоростям молекул. Как
оказалось распределение Максвелла
справедливо не только для газов. По
закону Максвелла распределены скорости
молекул жидкостей и твердых тел.
Распределение Максвелла удобно
проанализировать с помощью диаграммы,
на которой представлена зависимость
функции распределения
![]() от скорости
от скорости
![]() .
Функция распределения Максвелла имеет
вид:
.
Функция распределения Максвелла имеет
вид:
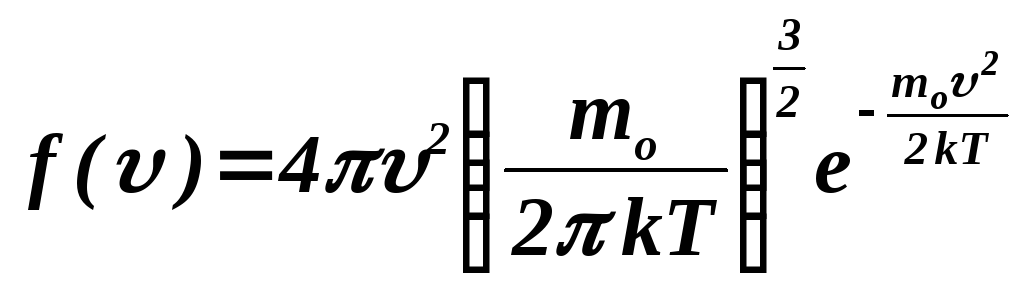
На приведенной
диаграмме площадь узкой полоски численно
равна доле молекул, скорости которых
принадлежат заданному интервалу
скоростей, а площадь под кривой численно
равна единице,
т.к. характеризует молекулы, скорости
которых принимают любые значения от 0
до
![]() .
.
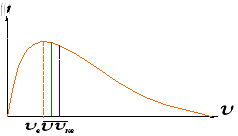 Функция
распределения Максвелла имеет максимум.
Скорость, соответствующую максимуму
функции распределения называют наиболее
вероятной скоростью.
Величину наиболее вероятной скорости
можно определить из условия экстремума
функции распределения. Дифференцируя
функцию распределения и приравнивая
полученный результат нулю, получим:
Функция
распределения Максвелла имеет максимум.
Скорость, соответствующую максимуму
функции распределения называют наиболее
вероятной скоростью.
Величину наиболее вероятной скорости
можно определить из условия экстремума
функции распределения. Дифференцируя
функцию распределения и приравнивая
полученный результат нулю, получим:
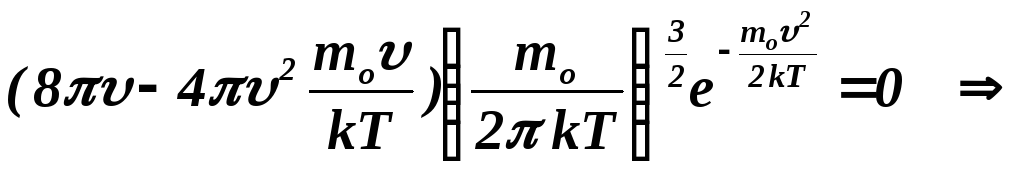
![]() .
.
Как видим, наиболее вероятная скорость меньше среднеквадратичной скорости. С помощью распределения Максвелла можно рассчитать также среднюю скорость молекул газа. Ее величина определяется формулой
![]() .
.
Более удобными для расчетов среднеквадратичной, наиболее вероятной и средней скоростей молекул формулы приведены ниже:
![]()
![]()
![]()
![]()
Отношение скорости
молекулы к наиболее вероятной скорости
ансамбля молекул называют приведенной
или относительной скоростью молекулы
![]()
Распределение Максвелла для приведенной скорости:

Сколько молекул
в моле имеют скорости отличающиеся от
наиболее вероятной не более чем на 0.1![]()

 Распределение
Максвелла получило экспериментальное
Распределение
Максвелла получило экспериментальное
подтверждение в 1920 г. в опытах Штерна.

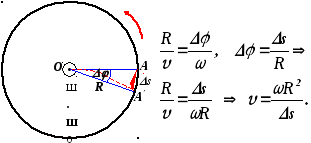
Опыты Штерна сводились к следующему. Два коаксиальных цилиндра приводились в быстрое вращение. На внутренней поверхности большого цилиндра осаждались пары серебра, которые в виде узкого пучка выходили из узкой щели малого цилиндра. Внутри большого цилиндра поддерживался глубокий вакуум. Вдоль оси малого цилиндра располагалась тонкая нить, покрытая тонким слоем серебра и нагреваемая электрическим током. В соответствии с представлениями молекулярно-кинетической теории скорости атомов серебра распределены по закону Максвелла. Величину скорости атомов серебра можно определить по формуле:
![]() ,
,
в которой
![]()
![]() - радиус большого цилиндра,
- радиус большого цилиндра,
![]() - угловая скорость вращения цилиндров,
- угловая скорость вращения цилиндров,
![]()
![]() - величина, характеризующая положение
осажденного атома серебра.
- величина, характеризующая положение
осажденного атома серебра.
Прямые измерения указанных величин и анализ плотности осажденных атомов серебра приводят к выводу о том, что Максвелловский закон распределения по скоростям полностью подтверждается данным экспериментом.
