
лекции_1 / Молекулярка / МКТ
.pdfЛекция 11. Молекулярная физика и термодинамика. Молекулярнокинетическая теория строения вещества. (2 часа)
11.1.Динамические и статистические закономерности в физике. Статистический и термодинамический методы исследования.
11.2.Макроскопическое состояние. Термодинамические функции состояния. Уравнение состояния. Внутренняя энергия. Интенсивные и экстенсивные параметры.
11.3.Модель идеального газа. Основное уравнение состояния идеального газа. Основные газовые законы.
11.4.Молекулярно-кинетический смысл абсолютной температуры.
Демонстрации:
1. Механическая модель броуновского движения. 2. Диффузия в газах, жидкостях и твердых телах.
Видеофильмы:
1. Смешивание спирта с водой - (2 мин.). 2. Броуновское движение - (3 мин.).
МОЛЕКУЛЯРНОЕ СТРОЕНИЕ ВЕЩЕСТВА
Молекулы в атомах, ядро, нейтроны, протоны, электроны неисчерпаемы, как и атом. 80 лет развития физики науки в целом подтвердили предсказание великого философа Цицерона.
Атомной единицей массы называют 1/12 массы атома углерода (С), т. е. удобная величина, численно равная 1,6605655(86)*10-27.
- количество вещества, 6,02*1023 штук структурных элементов (неделимых) атомов или молекул.
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА Идеальный газ
Основное уравнение кинетической теории газов
является важнейшим в молекулярно-кинетической теории; из него можно вывести все газовые законы, получить соотношения между энергией молекул и температурой и т.д.
p |
1 |
n |
|
mv2 |
|
|
0 |
(11.13) |
|||
|
3 |
кв , |
|||
|
|
|
|
||
где n0 = N'/V – концентрация молекул - число молекул в единице объема.
Уравнение (11.13) называют основным уравнением молекулярнокинетической теории газов для давления. Его называют уравнением Клаузиуса. Сделав некоторые преобразования из (11.13) можно получить
|
|
|
|
p |
|
2 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
n E, |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
3 |
0 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
mv 2 |
3 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
E |
|
|
кв |
|
|
kT , |
|
||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
2 |
|
(11.14) |
|
|
|
|
|
|
p n0 kT. |
|
|
|
|||||||||
где n0 = N'/V - число молекул в единице объема; |
|
||||||||||||||||
|
|
|
mv 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
кв |
=- средняя кинетическая |
энергия поступательного |
движения |
||||||||||||||
2 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
молекул газа;
k - постоянная Больцмана.

ГАЗОВЫЕ ЗАКОНЫ
1. Идеальный газ
PV
T
const - уравнение Клапейрона.
P=P0=1,013*105 Па;
Т=Т0=273,15 К;
V=V0=22,4*10-3 м3;
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
PV |
|
P0V0 |
|
|
|
|
Па м3 |
|
|
|
|
|
|
|
Н м |
|
Дж |
|||
|
|
R 8,31 |
|
|
м2 |
|
м3 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
T |
|
T0 |
|
|
|
К |
К |
|
|
|
|
|
К |
|
К |
|||||
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
PV |
|
|
|
m |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
R |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
PV |
m |
RT |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
- уравнение Менделеева-Клапейрона |
|||||
|
|
|
|||||
p nkT p |
N |
kT p |
NA |
kT |
|||
|
|
||||||
|
|
|
|
V |
|
V |
|
pV (NAk)T pV RT
ИЗОПРОЦЕССЫ
1. P=const – изобарный процесс;
V |
: |
|
ЗАКОН ГЕЙ-ЛЮССАКА: |
||
|
 изобар
изобар
V0
t 0C
Рис. 11.3
V mR const
T P
2. T=const – изотермический процесс;
p
ЗАКОН БОЙЛЯ-МАРИОТТА P
PV m RT const
Рис. 11.2
V
3.V=const – изохорный процесс;
p
ЗАКОН
ШАРЛЯ:
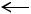 изохор
изохор
p0
t 0C
Рис. 11.4

P mR const
T V
4. Адиабатический процесс;
Адиабатический процесс – процесс, протекающий без теплообмена с внешней средой.
|
|
|
|
|
|
|
ВЫВОД УРАВНЕНИЯ АДИАБАТЫ |
|
|
|
|
|
|||||||||
Q const dQ 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
dQ dU dA 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
dU=CV dT |
dA=PdV |
CV dT PdV 0 |
|
|
|
|
|
|
|
|
|
|
|
||||||||
PV RT |
d (PV ) RdT dPV PdV RdT |
|
|
|
|
|
|
|
|
|
|
||||||||||
dT |
dPV PdV |
|
|
C dT PdV 0 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
R |
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
C |
dPV PdV |
PdV 0 |
C dPV C PdV RPdV 0 C dPV (C |
R)PdV 0 |
|||||||||||||||||
|
|||||||||||||||||||||
V |
R |
|
|
|
|
V |
V |
|
|
|
|
V |
|
|
|
V |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C dPV (C R)PdV 0 |
(C |
R) C |
|
C dPV C |
PdV 0 |
dPV |
CP |
PdV 0 |
|||||||||||||
P |
|
||||||||||||||||||||
V |
|
V |
|
V |
|
V |
P |
|
|
|
|
|
|
|
CV |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CP |
коэффициент |
Пуассона dPV PdV 0 |
|
dV |
|
dP |
0 |
|
|
|
|||||||||||
|
|
|
|
|
|
||||||||||||||||
CV |
|
|
|
|
|
|
|
|
|
|
|
V |
|
P |
|
|
|
|
|
||
d (ln PV ) 0 PV Const уравнение адиабаты или уравнение Пуассона
PV const
- уравнение адиабаты или уравнение Пуассона.
PV Mm RT ;
PVV 1 Mm RTV 1 const ;

TV 1 const .
Адиабата в PV координатах убывает круче, чем изотерма.
|
|
|
dP |
|
P |
tg 1 ; |
|
||||
|
PV=const |
dP*V+P*dV=0 |
|
|
|
|
|||||
|
dV |
V |
|
||||||||
PV |
const |
dP *V P V 1 * dV 0 |
|
dP |
|
|
P |
tg |
2 ; |
||
|
dV |
V |
|||||||||
|
|
|
|
|
|
|
|
||||
tg 2 tg tg
tg 1 2 1
Касательная у адиабаты в раз круче, чем у изотермы.
ПОЛИТРОПИЧЕСКИЙ ПРОЦЕСС
Политропический процесс – это процесс, в ходе которого теплоемкость тела не изменяется. Все рассмотренные нами изопроцессы можно представить себе, как политропические.


Изопроцессы – частные случаи политропического процесса.
|
|
C Const. PV |
n |
Const. |
n |
C CP |
||||||||
|
|
|
C C |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
1. n=0 |
|
PV0=P*1=P=const; |
|
|
|
|||||||||
|
|
|
|
C |
n * Cn C p |
|
|
C p |
C p - изобарический процесс. |
|||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
n 1 |
|
1 |
|
|
|
||
2. n |
|
PVn=const |
|
|
|
|
|
|
||||||
1 |
|
|
|
|
|
|
|
P0 1, 1*V=const, |
|
|
||||
|
|
|
|
|
, n , |
|
||||||||
P nV n C1 |
|
V=const – |
||||||||||||
|
|
|
|
|
|
|
изохорический процесс. |
|
|
|
||||
3. n=1 |
|
PV=const – изотермический процесс. |
|
|
||||||||||
4. n= |
|
PV |
const - адиабатический процесс. |
|||||||||||
РАБОТА ИДЕАЛЬНОГО ГАЗА В ИЗОПРОЦЕССАХ
dA Fdl Psdl P dV
V2
A P(V )dV
V1
1. V=const – изохорический процесс dA=PdV=0
2. P=const – изобарический процесс
|
|
A=P(V2-V1) |
|
|
|
|
|
|
|
|
|
|
|||
3. T=const – изотермический процесс |
|
|
|
|
|
|
|||||||||
V |
|
V |
|
|
|
|
V |
dV |
|
m |
RT (lnV2 lnV1 ) m |
|
|
||
A 2 |
PdV 2 |
mRTdV |
|
m |
RT 2 |
|
|
RT ln |
V2 |
||||||
V |
M |
||||||||||||||
MV |
M |
|
|
M |
V |
||||||||||
V |
|
V |
|
|
V |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
1 |
|||||
1 |
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
m |
RT ln |
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
12 |
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
4. адиабатический |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
процесс |
|||||||
PV |
Const PV |
P |
|
Const |
|
|
|
PV |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
V |
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
V2 |
|
|
|
|
V2 PV dV |
|
|
|
|
|
|
|
|
|
V2 dV |
|
|
|
|
|
|
V 1 |
|
|
V2 |
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
A |
|
PdV |
|
1 1 |
|
|
|
|
|
PV |
|
|
|
|
|
|
|
PV |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
V1 |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
V |
|
1 |
1 |
|
|
V |
|
|
1 |
1 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
V |
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PV V 1 ( |
V2 1 |
|
1) |
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
PV (V 1 |
|
|
|
1 ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
V |
|
1 1 |
|
|
1 |
|
|
|
|
V |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
1 |
|
1 |
2 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
PV V |
|
1 |
|
1) |
|
PV |
V |
|
|
1 |
1) |
RT V |
|
1 |
1) |
|||||||||||||||||||||||||||||||||||
1 1 |
(( |
2 |
) |
|
|
|
|
1 1 |
(( |
|
|
1 |
) |
|
|
|
|
1 |
(( |
1 |
) |
|
|
||||||||||||||||||||||||||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
1 |
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
V2 |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
A |
|
|
|
mRT1 |
|
|
|
(1 ( |
V1 |
)1 ) |
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
12 |
|
|
|
( 1) |
|
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
5. политропический процесс |
|
|
|
||
n |
A |
mRT1 |
(1 ( |
V1 |
)n 1 ) |
(n 1) |
|
||||
12 |
V2 |
|
|||
|
|
|
|||
