
- •КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •Сложные вещества, полученные взаимодействием соединений первого порядка, но не путем простого замещения в
- •Координационная теория Вернера
- •Виды комплексов
- •Внутренняя сфера состоит из центрального атома (комплексообразователя), а вокруг него находятся (координируются) лиганды.
- •Характеристики центрального атома: 1)степень окисления (заряд атома)
- •2) Координационное число (КЧ) - количество химических связей, которые комплексообразователь образует с лигандами.
- •Координационное число зависит от природы, степени окисления комплексообразователя, природы лиганда и условий реакции.
- •Лиганды не связаны друг с другом, и между ними действуют силы отталкивания.
- •3) По координационной емкости
- •В комплексном соединении [Co(NH3)4CO3]NO3 бидентатный лиганд – ион CO32- образует две связи с
- •Лиганды, способные образовывать две и более связи называются полидентантными.
- •Если в комплексе содержатся два и более комплексообразователя, то этот комплекс называется
- •2) Если атомы комплексообразователя связаны между
- •Номенклатура комплексных соединений
- •Комплексные соединения с комплексным анионом.
- •Комплексные соединения с комплексным катионом.
- •Нейтральные комплексы
- •Многоядерные комплексы
- •Геометрические изомеры
- •Строение комплексных соединений
- •Изомерия комплексных соединений
- •2) Геометрическая изомерия
- •3) Оптическая изомерия (зеркальная изомерия).
- •4) Сольватная (гидратная) изомерия
- •5) Ионная изомерия
- •Устойчивость комплексных соединений
- •Диссоциация имеет два этапа:
- •Процесс комплексообразования завершается, когда у комплексообразователя исчерпаны все валентные возможности.
- •Процесс диссоциации характеризуется величиной константой нестойкости.
- •Примеры образования и разрушения комплексов
- •3) Реакция:
- •Теория валентных связей
- •Ион [MnCl4]2- содержит пять не спаренных электронов на 3d-орбитали и вакантные 4s- и
- •Гибридизация орбиталей и структура комплексов
- •При объединении двух электронов 3d-подуровня в пару и высвобождение одной из квантовых ячеек
- •Если в гибридизации участвуют атомные орбитали внешнего d-подуровня, то комплекс парамагнитен и называется
- •Гексафтороферрат(II)-ион [FeF6]4- - парамагнитный
- •Гексацианоферрат(II)-ион [Fe(CN)6]4- - диамагнитный
- •Теория кристаллического поля
- •Октаэдрическое расположение лигандов
- •Атомные орбитали, вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между ними
- •Три d-АО, расположенные между осями координат и между лигандами, находятся на значительном расстоянии
- •Пять одинаковых d-АО комплексообразователя, попадая в поле лигандов, подвергаются расщеплению на две группы
- •Разность энергий двух новых подуровней d и d – это
- •Выигрыш энергии за счет заселения электронами d - атомных орбиталей называют энергией стабилизации
- •Заселение d - и d
- •При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают энергетический барьер, разделяющий
- •При сильном поле лигандов и высоком значении 0 заселение четвертым и пятым электроном
- •Шестой, седьмой и восьмой электроны в случае слабого поля оказываются снова на d
- •В случае сильного поля лигандов шестой электрон заселяет d -АО, приводя к диамагнетизму
- •Заселение орбиталей девятым и десятым электроном также не различается для комплексов обоих типов:
- •Строение октаэдрического комплексного ионов [CoF6]3-. Фторид-ион F- – лиганд слабого поля.
- •Цветность комплексных соединений
- •Избирательность поглощения света зависит: 1)от степени окисления комплексообразователя; 2)от вида лигандов.
Если в гибридизации участвуют атомные орбитали внешнего d-подуровня, то комплекс парамагнитен и называется
внешнеорбитальным и высокоспиновым.
Это отвечает типу гибридизации, например, sp3d2.
Если в гибридизации участвуют атомные орбитали предвнешнего d-подуровня, то комплекс внутриорбитальный и
низкоспиновый.
Они диамагнитны или слабо парамагнитны Это отвечает типу гибридизации, например,
d2sp3 или dsp2.
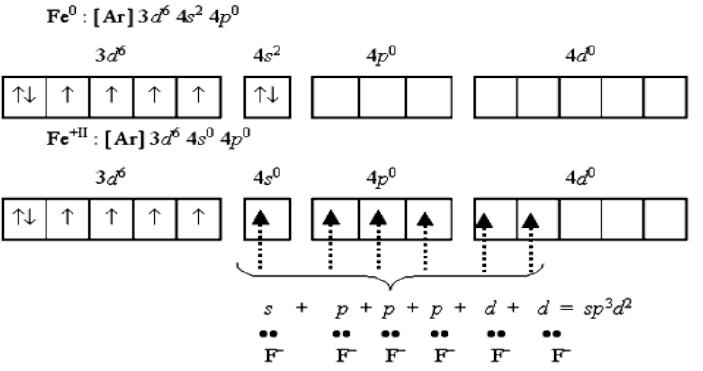
Гексафтороферрат(II)-ион [FeF6]4- - парамагнитный
высокоспиновый
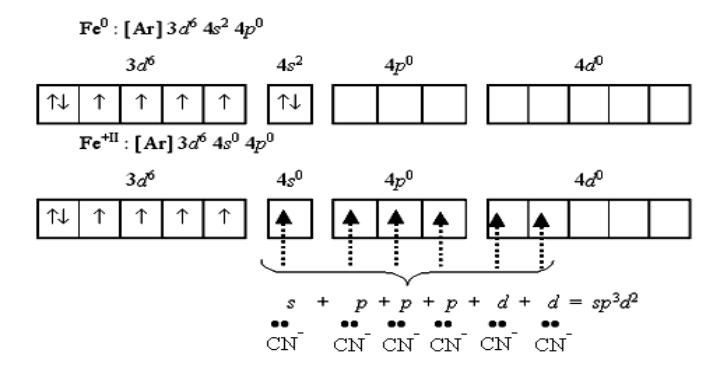
Гексацианоферрат(II)-ион [Fe(CN)6]4- - диамагнитный
низкоспиновый .
Недостатки теории валентных связей:
1)Не определяет вид комплекса в каждом случае;
2)Не учитывает влияния природы лиганда.
Теория кристаллического поля
1)Химическая связь комплексообразователь – лиганд считается электростатической.
2)Лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников в виде точечных зарядов.
3)Реальный объем лиганда не учитывается.
4)Лиганды создают вокруг комплексообразователя электростатическое поле.
5)Под действием поля энергетические уровни комплексообразователя, прежде всего d-подуровни, расщепляются, и их энергия изменяется.
Октаэдрическое расположение лигандов
В центре октаэдра атом- комплексообразователь с электронами на d- атомных орбиталях.
В его вершинах – лиганды в виде точечных отрицательных зарядов.
В условном ионе комплексообразователя, не связанном с лигандами, энергии всех пяти d-АО одинаковы.
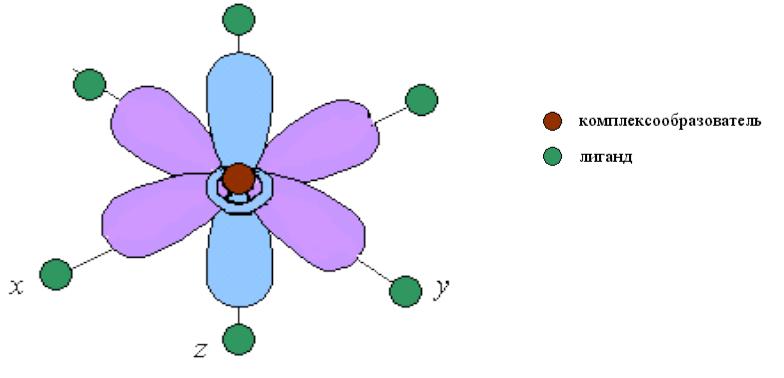
Атомные орбитали, вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между ними и лигандами возникают силы отталкивания, приводящие к увеличению энергии орбиталей.

Три d-АО, расположенные между осями координат и между лигандами, находятся на значительном расстоянии от них. Взаимодействие этих d-АО с лигандами минимально, их энергия понижается по сравнению с исходной.
Пять одинаковых d-АО комплексообразователя, попадая в поле лигандов, подвергаются расщеплению на две группы новых орбиталей – с более низкой энергией, d(xy), d(xz) и d(yz), и с более высокой энергией, d(z2) и d(x2-y2).
АО с более низкой энергией обозначаются d
АО с более высокой энергией обозначают
d .
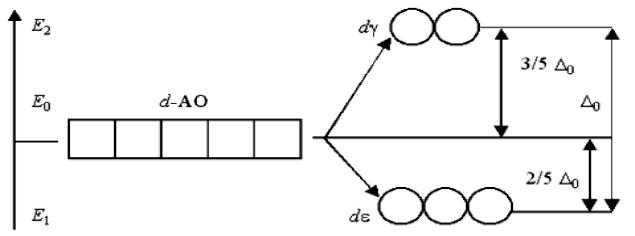
Разность энергий двух новых подуровней d и d – это
параметр расщепления. E2 – E1 = 0
Расположение d и d подуровней по отношению к исходному (d-АО) на энергетической диаграмме несимметричное:
(Е2 – Е0) > (Е0 – Е1). Мксимальное число электронов на d - 4 и d -АО – 6.
Размещение электрона на d -орбитали уменьшает (выигрыш) энергию на 2/5 0.
Размещение электрона на d -орбитали увеличивает (затрату) энергию на 3/5 0.
При полном заполнении электронами d - и d -орбитали, выигрыша энергии не будет.
Выигрыш энергии за счет заселения электронами d - атомных орбиталей называют энергией стабилизации комплекса полем лигандов.
Чем сильнее поле лигандов, чем больше значение параметра расщепления 0.
0 зависит от степени окисления и природы комплексообразователя. С ростом степени окисления комплексообразователя и его заряда значение 0 увеличивается.
Спектрохимический ряд, вдоль которого значение 0 монотонно растет:
I-<Br-<Cl-~NCS-<<NO3-<F-<OH-<H2O~H-<NH3<NO2-<CN-~NO~ CO
