
- •Электроотрицательность (ЭО) – это способность атомов в соединениях притягивать к себе
- •Степень окисления (С.О.) - это воображаемый заряд атома в соединении, вычисленный, исходя из
- •Примеры расчета СО
- •Валентность - свойство атомов данного элемента присоединять или замещать в соединении определенное число
- •ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
- •Закон сохранения массы:
- •Закон постоянства состава:
- •Газовые законы
- •Закон объёмных отношений: Объёмы газов, участвующих в реакции относятся между собой, как их
- •Объединенный газовый закон
- •Уравнения составляются на основе закона сохранения массы.
- •Эквивалент. Закон эквивалентов.
- •Эквивалентная масса простого вещества:
- •1)Эквивалентная масса оксида равна сумме эквивалентных масс кислорода и элемента, входящего в состав
- •2) Эквивалентная масса кислоты равна сумме эквивалентных масс водорода и кислотного остатка:
- •3) Эквивалентная масса основания равна сумме эквивалентных масс металла и гидроксогруппы:
- •4) Эквивалентная масса соли равна сумме эквивалентных масс металла и кислотного остатка:
- •Закон эквивалентов:
- •Способы выражения концентрации раствора.
- •Концентрация - величина, показывающая, сколько растворенного вещества (в граммах, молях, моль - эквивалентах)
- •Процентная концентрация (массовая доля) (ω) – показывает
- •Молярная концентрация (молярность) –
- •Нормальная концентрация (нормальность)–
- •Моляльная концентрация –
- •Титром– называют число грамм растворенного вещества, содержащееся в 1 мл раствора (г/мл).
- •КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
- •ОКСИДЫ И ИХ СВОЙСТВА
- •Кислотные оксиды (или ангидриды кислот)- это оксиды не металлов или d- металлов в
- •ХИМИЧЕСКИЕ СВОЙСТВА
- •ОСНОВАНИЯ И ИХ СВОЙСТВА
- •ХИМИЧЕСКИЕ СВОЙСТВА
- •КИСЛОТЫ И ИХ СВОЙСТВА
- •СВОЙСТВА КИСЛОТ
- •СОЛИ И ИХ СВОЙСТВА
- •Основными – называют такие соли, в молекулах которых кроме металла и кислотного остатка,
- •СВОЙСТВА СОЛЕЙ
- •ТИПЫ ХИМИЧЕСКИХ

Электроотрицательность (ЭО) – это способность атомов в соединениях притягивать к себе
электроны.
ЭО (по Полингу) и С.О некоторых элементов
 ЭО
ЭО  СО
СО
F O N C1 Br I C S H Металлы
4,0 |
3,5 |
3,0 |
3,0 |
2,8 |
2,5 |
2,5 |
2,5 |
2,1 |
<2,1 |
-1 -2 Рассчитывается по правилам +1 |
+n |
расчета СО |
(заряд) |
Степень окисления (С.О.) - это воображаемый заряд атома в соединении, вычисленный, исходя из предположения, что соединение состоит из ионов.
Постоянную степень окисления имеют: F (-1); O (-2); K, Na, Cs, Ag, H (+1);
Ca, Ba, Mg, Zn, Ni (+2); Al (+3).
Правила расчета степени окисления
1.С.О. элемента в простом веществе равна нулю (металлы, , H2 F2, N2 и т.д.).
2.С.О. ряда элементов фиксированы.
3. С.О. остальных элементов рассчитывается, исходя из того, что алгебраическая сумма С.О. элементов в молекуле равна нулю, в ионе - заряду иона.
Примеры расчета СО
Расчет степеней окисления элементов в молекуле:
К2Сr2О7
СО = 0 2·(+1) + 2·СОСr + 7·(-2) = 0
СОСr = +6
Расчет степеней окисления элементов в ионе:
Н4+
СО = +1 СО + 4·(+1) = +1
СО = -3

Валентность - свойство атомов данного элемента присоединять или замещать в соединении определенное число атомов другого элемента.
Валентность - число связей, образуемых элементом.
Моль - количество вещества системы, которое содержит столько определённых структурных единиц (молекул, атомов, ионов, эквивалентов), сколько атомов содержится в 0,012 кг (в 12 г)
углерода-12, а именно 6,02.1023 (число Авогадро).
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
закон сохранения массы и энергии
(закон Ломоносова – Лавуазье - Эйнштейна):
В изолированной системе сумма масс и энергий постоянна.
Уравнение Энштейна – математическое выражение закона сохранения массы и энергии:
Е= mс2
с– скорость света в пустоте, равная 3.108 м/с.
Закон сохранения массы:
При химических реакциях масса всех элементов, вступивших в реакцию, равна массе элементов, получившихся в результате реакции.
Закон сохранения энергии:
Энергия системы, включающей исходные вещества, равна энергии системы, включающей продукты реакции.
Закон постоянства состава:
Каждое химически чистое соединение, независимо от способа его получения, состоит из одних и тех же элементов, соотношения, между массами которых постоянны.
Закон кратных отношений
Если два элемента образуют между собой несколько различных соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой как простые целые числа.

Газовые законы
Закон Бойля –Мариотта показывает зависимость объёма газа от его давления при постоянной температуре:
pV = const или V = const / p
Закон Шарля и Гей-Люссака показывает зависимость объёма газа от его температуры при постоянном давлении:
V = V0T / T0
Закон объёмных отношений: Объёмы газов, участвующих в реакции относятся между собой, как их стехиометрические коэффициенты.
Vв : Vд = b : d
Закон Авогадро: В равных объёмах разных газов при одинаковых условиях содержится одинаковое число молекул (6,022х1023).
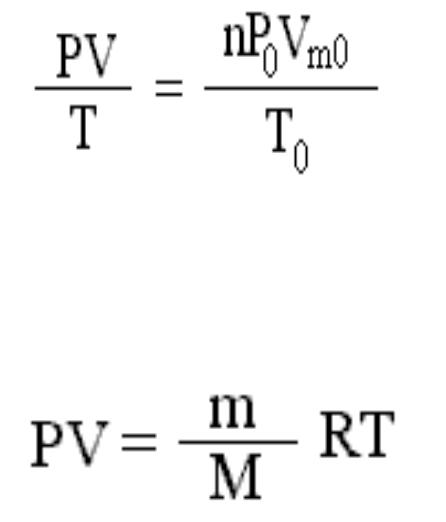
Объединенный газовый закон
Р –давление, V – объём, Т – температура,
Р0 – 101,3 кПа или 1 атмосфера или 760 мм. рт. ст., Т0 – 273 К, Vm0 – 22,4 л, n – число молей газа.
Уравнение Менделеева – Клайперона
