
- •КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •Сложные вещества, полученные взаимодействием соединений первого порядка, но не путем простого замещения в
- •Координационная теория Вернера
- •Виды комплексов
- •Внутренняя сфера состоит из центрального атома (комплексообразователя), а вокруг него находятся (координируются) лиганды.
- •Характеристики центрального атома: 1)степень окисления (заряд атома)
- •2) Координационное число (КЧ) - количество химических связей, которые комплексообразователь образует с лигандами.
- •Координационное число зависит от природы, степени окисления комплексообразователя, природы лиганда и условий реакции.
- •Лиганды не связаны друг с другом, и между ними действуют силы отталкивания.
- •3) По координационной емкости
- •В комплексном соединении [Co(NH3)4CO3]NO3 бидентатный лиганд – ион CO32- образует две связи с
- •Лиганды, способные образовывать две и более связи называются полидентантными.
- •Если в комплексе содержатся два и более комплексообразователя, то этот комплекс называется
- •2) Если атомы комплексообразователя связаны между
- •Номенклатура комплексных соединений
- •Комплексные соединения с комплексным анионом.
- •Комплексные соединения с комплексным катионом.
- •Нейтральные комплексы
- •Многоядерные комплексы
- •Геометрические изомеры
- •Строение комплексных соединений
- •Изомерия комплексных соединений
- •2) Геометрическая изомерия
- •3) Оптическая изомерия (зеркальная изомерия).
- •4) Сольватная (гидратная) изомерия
- •5) Ионная изомерия
- •Устойчивость комплексных соединений
- •Диссоциация имеет два этапа:
- •Процесс комплексообразования завершается, когда у комплексообразователя исчерпаны все валентные возможности.
- •Процесс диссоциации характеризуется величиной константой нестойкости.
- •Примеры образования и разрушения комплексов
- •3) Реакция:
- •Теория валентных связей
- •Ион [MnCl4]2- содержит пять не спаренных электронов на 3d-орбитали и вакантные 4s- и
- •Гибридизация орбиталей и структура комплексов
- •При объединении двух электронов 3d-подуровня в пару и высвобождение одной из квантовых ячеек
- •Если в гибридизации участвуют атомные орбитали внешнего d-подуровня, то комплекс парамагнитен и называется
- •Гексафтороферрат(II)-ион [FeF6]4- - парамагнитный
- •Гексацианоферрат(II)-ион [Fe(CN)6]4- - диамагнитный
- •Теория кристаллического поля
- •Октаэдрическое расположение лигандов
- •Атомные орбитали, вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между ними
- •Три d-АО, расположенные между осями координат и между лигандами, находятся на значительном расстоянии
- •Пять одинаковых d-АО комплексообразователя, попадая в поле лигандов, подвергаются расщеплению на две группы
- •Разность энергий двух новых подуровней d и d – это
- •Выигрыш энергии за счет заселения электронами d - атомных орбиталей называют энергией стабилизации
- •Заселение d - и d
- •При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают энергетический барьер, разделяющий
- •При сильном поле лигандов и высоком значении 0 заселение четвертым и пятым электроном
- •Шестой, седьмой и восьмой электроны в случае слабого поля оказываются снова на d
- •В случае сильного поля лигандов шестой электрон заселяет d -АО, приводя к диамагнетизму
- •Заселение орбиталей девятым и десятым электроном также не различается для комплексов обоих типов:
- •Строение октаэдрического комплексного ионов [CoF6]3-. Фторид-ион F- – лиганд слабого поля.
- •Цветность комплексных соединений
- •Избирательность поглощения света зависит: 1)от степени окисления комплексообразователя; 2)от вида лигандов.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Неизменные группировки атомов могут взаимодействовать в растворе с ионами металлов или нейтральными молекулами с образованием более сложных частиц.
Образовавшиеся соединения имеют новые свойства.
Так, иодид ртути (II) взаимодействует в растворе с нитратом серебра: HgI2+2AgNO3=2AgI+Hg(NO3)2
После образования сложного соединения с иодидом калия:
HgI2 + 2KI = K2[HgI4], свойства иодида ртути(II) как индивидуального вещества исчезают.
Продукт состава K2[HgI4] обладает другими химическими свойствами, т.к. анион [HgI4]2- ведет себя в обменных реакциях как неразрывное целое:
K2[HgI4] + 2AgNO3 = Ag2[HgI4] + 2KNO3

Сложные вещества, полученные взаимодействием соединений первого порядка, но не путем простого замещения в них одних компонентов на другие, называют
соединениями высшего порядка.
Сложные соединения, имеющие в своем составе устойчивые, не укладывающиеся в рамки формальной валентности комплексные группы с ковалентными связями, образованными по донорно-акцепторному механизму называются комплексными
соединениями (координационными
соединениями).

Координационная теория Вернера
Комплексное соединение состоит из двух сфер – внешней и внутренней.
Внутреннюю сферу называют комплексом.
Ионы, нейтрализующие заряд внутренней сферы, но не связанные с комплексообразователем ковалентно, образуют
внешнюю сферу комплексного соединения.
Между комплексным ионом и внешней сферой – ионная связь. Внутри комплексного иона связи ковалентные донорно-акцепторные связи.
Внешнюю сферу составляют простые одноатомные или многоатомные ионы.
Комплексное соединение может состоят из нескольких внутренних сфер [Cu(NH3)4][PtCl6].
Виды комплексов
Катионный - результат координации вокруг положительно заряженного иона нейтральных молекул (Н2О, NН3 и др.), например: [Сu(NН3)4]SО4.
Анионный – результат координации вокруг положительно заряженного иона отрицательно заряженныхчастиц, например: К4[Fе(СN)6].
Нейтральный - результат координации вокруг атома молекул, а также при одновременной координации вокруг положительного иона отрицательных, например [Ni(СО)4]; [CoC13(NH3)3].
Заряд комплексной частицы численно равен заряду внешней сферы, но противоположен по знаку.
Например:
[Сu(NН3)4]SО4, заряд внешней сферы 2-, тогда заряд комплексной частицы равен 2+.
К4[Fе(СN)6], заряд внешней сферы равен (+1)*4 = +4, тогда заряд комплексной частицы равен 4-.
Внутренняя сфера состоит из центрального атома (комплексообразователя), а вокруг него находятся (координируются) лиганды.
M + n L =[MLn] Комплексообразователями могут быть нейтральные и заряженные частицы. Нейтральный комплексообразователь:
[Cr(CO)6], [Fe(CO)4], [Ni(CO)4]. Положительный комплексообразователь:
[Ag(NH3)2]+, [SiF6]2- Отрицательный комплексообоазователь:
[NH4]+
Характеристики центрального атома: 1)степень окисления (заряд атома)
Степень окисления центрального атома
- разность между зарядом комплекса и суммой зарядов лигандов.
Например: [Сu(NН3)4]2+
Лиганды - нейтральные молекулы воды. Заряд комплексу придает центральный атом, т.е. степень окисления меди равна +2.
[Fе(СN)6]4-
СОFе = заряд иона – Σзарядов лигандов = -4–6*(-1) =+2.
2) Координационное число (КЧ) - количество химических связей, которые комплексообразователь образует с лигандами.
Определяется строением электронной оболочки и обусловливается валентными возможностями центрального атома.
Если комплексообразователь координирует
монодентатные (односвязевые) лиганды, то координационное число равно числу присоединяемых лигандов.
Если комплексообразователь координирует
полидентатные (многосвязевые) лиганды, то число лигандов меньше значения координационного числа.
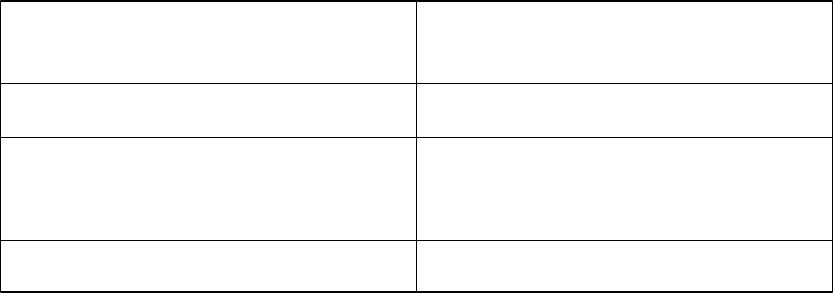
Координационное число зависит от природы, степени окисления комплексообразователя, природы лиганда и условий реакции. Принимает значения от 2 до 8 и даже выше. Более распространенными 4 и 6.
Связь степени окисления комплексообразователя и координационного числа
Степень окисления |
Координационное число |
|||
комплексообразователя |
|
|
|
|
+I |
2 |
[Ag(NH3)2]+ |
||
+II |
4 |
[Zn(NH ) |
]2+ |
|
|
|
3 |
4 |
|
аквакомплексы II |
6 |
[Со(H О) |
]2+ |
|
|
|
2 |
6 |
|
+III и +IV |
6 |
[Co(NH3)6]3+ |
||
КЧ=3, 5, 7, 8 и 9 встречаются сравнительно редко. |
|
|||
Есть всего несколько соединений с КЧ=12 K9[Bi(NCS)12].
Лиганды не связаны друг с другом, и между ними действуют силы отталкивания.
Лиганды различаются: 1) По заряду.
Лигандами могут быть нейтральные молекулы и отрицательно заряженные ионы (NH3, H2O, СО, NO, ОН-, Cl-, NO2-, CN-, SO42- и др.). Все лиганды обязательно обладают неподеленными электронными парами.
2) По активности.
По силе лиганды можно расположить в ряд:
CN-> NO2-> NH3>SCN-> H2O> F-> ОН-> Cl-
Более сильный лиганд способен вытеснять слабый из комплекса.
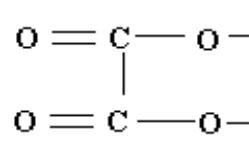
3) По координационной емкости
Координационная емкость лиганда – число мест, занимаемых каждым лигандом во внутренней сфере комплекса.
Лиганды, занимающие одно координационное место у центрального атома, называют мондентантными.
Он связан с комплексообразователем через один из своих атомов одной двухцентровой химической связью. К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие.
Каждая молекула бидентатногобидентатного лиганда образуетс комплексообразователем
две химические связи. Например, оксалат-ион С2O42-
