
- •КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •Сложные вещества, полученные взаимодействием соединений первого порядка, но не путем простого замещения в
- •Координационная теория Вернера
- •Виды комплексов
- •Внутренняя сфера состоит из центрального атома (комплексообразователя), а вокруг него находятся (координируются) лиганды.
- •Характеристики центрального атома: 1)степень окисления (заряд атома)
- •2) Координационное число (КЧ) - количество химических связей, которые комплексообразователь образует с лигандами.
- •Координационное число зависит от природы, степени окисления комплексообразователя, природы лиганда и условий реакции.
- •Лиганды не связаны друг с другом, и между ними действуют силы отталкивания.
- •3) По координационной емкости
- •В комплексном соединении [Co(NH3)4CO3]NO3 бидентатный лиганд – ион CO32- образует две связи с
- •Лиганды, способные образовывать две и более связи называются полидентантными.
- •Если в комплексе содержатся два и более комплексообразователя, то этот комплекс называется
- •2) Если атомы комплексообразователя связаны между
- •Номенклатура комплексных соединений
- •Комплексные соединения с комплексным анионом.
- •Комплексные соединения с комплексным катионом.
- •Нейтральные комплексы
- •Многоядерные комплексы
- •Геометрические изомеры
- •Строение комплексных соединений
- •Изомерия комплексных соединений
- •2) Геометрическая изомерия
- •3) Оптическая изомерия (зеркальная изомерия).
- •4) Сольватная (гидратная) изомерия
- •5) Ионная изомерия
- •Устойчивость комплексных соединений
- •Диссоциация имеет два этапа:
- •Процесс комплексообразования завершается, когда у комплексообразователя исчерпаны все валентные возможности.
- •Процесс диссоциации характеризуется величиной константой нестойкости.
- •Примеры образования и разрушения комплексов
- •3) Реакция:
- •Теория валентных связей
- •Ион [MnCl4]2- содержит пять не спаренных электронов на 3d-орбитали и вакантные 4s- и
- •Гибридизация орбиталей и структура комплексов
- •При объединении двух электронов 3d-подуровня в пару и высвобождение одной из квантовых ячеек
- •Если в гибридизации участвуют атомные орбитали внешнего d-подуровня, то комплекс парамагнитен и называется
- •Гексафтороферрат(II)-ион [FeF6]4- - парамагнитный
- •Гексацианоферрат(II)-ион [Fe(CN)6]4- - диамагнитный
- •Теория кристаллического поля
- •Октаэдрическое расположение лигандов
- •Атомные орбитали, вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между ними
- •Три d-АО, расположенные между осями координат и между лигандами, находятся на значительном расстоянии
- •Пять одинаковых d-АО комплексообразователя, попадая в поле лигандов, подвергаются расщеплению на две группы
- •Разность энергий двух новых подуровней d и d – это
- •Выигрыш энергии за счет заселения электронами d - атомных орбиталей называют энергией стабилизации
- •Заселение d - и d
- •При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают энергетический барьер, разделяющий
- •При сильном поле лигандов и высоком значении 0 заселение четвертым и пятым электроном
- •Шестой, седьмой и восьмой электроны в случае слабого поля оказываются снова на d
- •В случае сильного поля лигандов шестой электрон заселяет d -АО, приводя к диамагнетизму
- •Заселение орбиталей девятым и десятым электроном также не различается для комплексов обоих типов:
- •Строение октаэдрического комплексного ионов [CoF6]3-. Фторид-ион F- – лиганд слабого поля.
- •Цветность комплексных соединений
- •Избирательность поглощения света зависит: 1)от степени окисления комплексообразователя; 2)от вида лигандов.

Строение комплексных соединений
Координаци |
Строение молекулы |
Пример |
онное число |
|
|
2 |
линейное |
3 |
равносторонний треугольник |
3 |
пирамидальное |
4 |
тетраэдрическое |
4 |
плоскоквадратное |
5 |
тригональное бипирамидальное |
5 |
квадратная пирамида |
6 и выше |
октаэдрическое |
7 |
Пентагональная бипирамида |
[С1-Сu-С1]-
[НgI3]- [SnС13]-
[ВF4]- [РtС14]2-
Изомерия комплексных соединений
Изомерия - способность веществ образовывать несколько соединений одинакового состава, отличающихся взаимным расположением атомов в молекуле, а следовательно, различных по свойствам.
1) Изомерия лигандов
а)связевая - определяется разным типом координации одного и того же лиганда
Например, [Ag(CN)2]- через С и [Ag(CN)2]- через N б) изомерия лиганда
Например, [Ag(CN)2]- и [Ag(NC)2]-
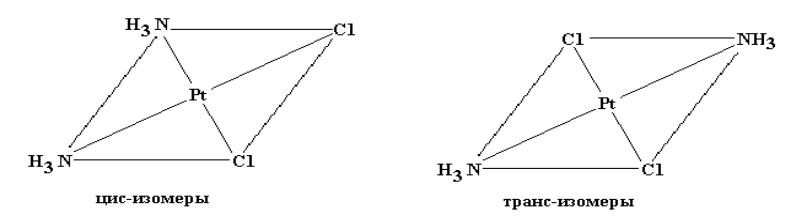
2) Геометрическая изомерия
Неодинаковое размещение лигандов во внутренней сфере относительно друг друга.
Условие изомерии - наличие во внутренней сфере не менее двух различных лигандов.
Проявляется у соединений с октаэдрическим, плоско- квадратным или квадратно- пирамидальным строением.
Не имеют соединения с тетраэдрическим, треугольным и линейным строением, т.к. места расположения лигандов разных видов вокруг центрального атома равноценны.
Увеличение числа различных лигандов во внутренней сфере увеличивает число геометрических изомеров.
3) Оптическая изомерия (зеркальная изомерия).
Способность комплексных соединений существовать в виде двух форм, не совмещаемых в трехмерном пространстве и являющихся зеркальным отображением друг друга.
Их растворы способны вращать плоскость поляризации светового луча: один изомер вращает плоскость поляризации влево (L-изомер), другой – вправо (D-изомер).
По физико-химическим свойствам оптические изомеры не отличаются друг от друга. Оптическая изомерия чаще всего встречается у комплексных соединений с координационным числом 6.
4) Сольватная (гидратная) изомерия
Различное распределение молекул растворителя между внутренней и внешней сферами комплексного соединения.
Например, CrCl3* 6H2O.
Первый изомер, [Cr(H2O)6]Cl3 при растворении в воде образуют фиолетовый раствор. Из раствора под действием ионов Ag+ осаждаются все три хлорид-аниона:
[Cr(H2O)6]Cl3 + 3AgNO3 = [Cr(H2O)6](NO3)3 + 3AgCl
Второй изомер, [Cr(H2O)5Cl]Cl2*H2O придает раствору голубовато-зеленый цвет, а ионы Ag+ осаждают два С1-:
[Cr(H2O)5Cl]Cl2 + 2AgNO3=[Cr(H2O)5Cl](NO3)2+2 AgCl
Третий изомер, [Cr(H2O)4Cl2]Cl*2H2O окрашивает раствор в темно-зеленый цвет, а ионы Ag+ осаждают один С1-:
[Cr(H2O)4Cl2]Cl+AgNO3=[Cr(H2O)4Cl2]NO3+AgCl
Изменяя pH либо температуру раствора можно добиться постепенного взаимного перехода изомеров.
5) Ионная изомерия
Различное распределение заряженных лигандов между внешней и внутренней сферами комплексного соединения.
Ионные изомеры по-разному диссоциируют в водном растворе.
Например, [Co(NH3)4Cl2]NO3 при растворении диссоциирует на ионы:
[Co(NH3)4Cl2]NO3 = [Co(NH3)4Cl2]+ + NO3-
При добавлении к такому раствору AgNO3 осадка хлорида серебра не образуется.
Его ионный изомер [Co(NH3)4Cl(NO3)]Cl при растворении в воде диссоциирует иначе:
[Co(NH3)4Cl(NO3)]Cl = [Co(NH3)4Cl(NO3)]+ + Cl-
Из этого раствора при добавлении AgNO3 выделяется осадок AgCl.
Устойчивость комплексных соединений
Делятся на электролиты и неэлектролиты.
К неэлектролитам относят прежде всего внутрикомплексные соединения (хелаты), карбонилы металлов и p-комплексы и др.
Растворимые комплексные соединения, не имеющие внешней сферы, ведут себя в растворах как слабые электролиты.
Комплексные соединения, имеющие ионную внешнюю сферу, в растворе подвергаются диссоциации.
Диссоциация имеет два этапа:
1) ведут себя как сильные электролиты, т.е. полностью диссоциируют на внутреннюю и внешнюю сферы.
K3[Fe(CN)6] 3K+ + [Fe(CN)6]3-
Комплексные основания и кислоты являются сильными электролитами.
2) комплексные ионы диссоциируют как слабые электролиты в незначительной степени, обратимо и ступенчато.
На каждой ступени комплекс отщепляет одну частицу – лиганд. Новый уменьшенный комплекс на следующей стадии снова отщепляет один лиганд и т. д.
[Fe(CN)6]3- [Fe(CN)5]2-+С -
........................................................................................................
[FeCN]2+ Fe3+ + С -
Процесс комплексообразования завершается, когда у комплексообразователя исчерпаны все валентные возможности.
Присоединения лигандов происходит ступенчато.
Полная константа образования комплекса Кn(обр) характеризует устойчивость комплексного соединения: чем она больше, тем более устойчив комплекс данного состава.
Например,
Ag+ + 2NH3 =[Ag(NH3)2]+; К1(обр) = 2,5*106 Ag+ + 2CN- =[Ag(CN)2]-; К2(обр) = 1,2*1021
К2(обр) > К1(обр) более прочен второй комплекс.
Кn(обр) = K1(обр) * K2(обр) * K3(обр) * … * Kn(обр)
Процесс диссоциации характеризуется величиной константой нестойкости.
Kn(обр)=1/Kn(нест)
Константа нестойкости характеризует устойчивость комплексного иона в водной среде.
[Fe(CN)6]3- Fe3++6С - Кнест=[Fe3+]*[С -]6/[[Fe(CN)6]3-]
Чем ниже константа нестойкости, тем стабильнее комплекс.
Прочность комплексных ионов возрастает с увеличением степени окисления металла.
Металлы побочных подгрупп дают более прочные комплексы, чем металлы главных подгрупп. Прочность комплекса возрастает с увеличением силы лиганда.
