
Для студентов 1 / описание лабораторных работ / LAB23
.RTFМИНИСТЕРСТВО ОБЩЕГО И ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КУРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ФИЗИКИ

Лабораторная работа №23
Определение изменения энтропии жидкости при испарении
по разделу “Механика молекулярная физика и термодинамика”
КУРСК 1998
Составители: доц Шумаков АИ асс Шевцова СА
УДК 6817872
Методические указания к лабораторной работе № 23 по разделу "Механика молекулярная физмка и термодинамика" / Курск Гос техн у-т Сост доц Шумаков АИ асс Шевцова СА Курск 1987
Излагаются методические рекомендации по выполнению лабораторной работы №23
Предназначена для дистанционного обучения студентов всех специальностей
Ил - Библиогр 3 назв
Рецензент Доц Родионов АА
Компьютерный вариант для дистанционного обучения отредактирован
Доц Зрайченко ВА доц Бурмистровым ВН
ЛАБОРАТОРНАЯ РАБОТА № 23
Определение изменения энтропии жидкости при испарении
Приборы и принадлежности: аналитические весы, цилиндрический стаканчик, спирт, секундомер.
Цель работы:
1Изучить строение и процесс испарения жидкости с позиций молекулярной статистической физики и термодинамики
2Определить изменение энтропии в процессе испарения системы молекул
спирта.
Теоретическое обоснование метода
При равновесной передаче малого количества тепла δQ какой-либо системе выполняется соотношение, связывающее это тепло, температуру Т, при которой оно было передано и характерную для данного состояния функцию S называемую энтропией системы
 (1)
(1)
где dS – изменение энтропии системы.
В термодинамике под энтропией понимают однозначную функцию состояния системы (как и внутренняя энергия). Энтропия не зависит от способа осуществления данного состояния.
Определяется энтропия лишь его термодинамическими параметрами P,V,T и др. с точностью до постоянной, значение которой определяется по третьему началу термодинамики о недостижимости абсолютного нуля температуры. При термодинамических расчетах обычно вычисляют разность (изменение) энтропии при переходе системы из состояния 1 в состояние 2:
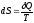 ;
;  (2)
(2)
По величине и знаку ΔS судят о направленности процесса и об интенсивности его самопроизвольного протекания.
В статической физике установлено, что энтропия, соответствующая данному состоянию системы равна произведению постоянной Больцмана К на натуральный логарифм термодинамической вероятности W этого состояния:
 (3)
(3)
где – термодинамическая вероятность (статический вес), или число микросостояний - способов, которыми может быть получено данное наблюдаемое на опыте макросостояние
k = 138 10-23 Дж/K – постоянная Больцмана
В отличие от математической вероятности, которая не может быть больше 1, термодинамическая вероятность может быть сколь угодно большим числом.
Таким образом, согласно выражению 3, численное значение энтропии определяется вероятностью данного состояния: чем вероятнее состояние изолированной системы, тем больше ее энтропия. Поскольку в природе реализуются наиболее вероятные макросостояния, то изолированная система стремится в состояние с наибольшей энтропией.
Если такое состояние равновесное, то энтропия уже не меняется, если неравновесное, то она вероятнее всего возрастет. То есть, энтропия характеризует меру приближения системы к равновесному ее состоянию. Реальные процессы, как правило, необратимы. В этом случае следует рассчитывать изменение энтропии при переходе системы из состояния 1 в состояние 2 по формуле
 (4)
(4)
Знак равенства необходимо использовать лишь для анализа равновесных процессов в термодинамически изолированной замкнутой системе, состоящей, например, из испаряющейся жидкости и пара, образовавшегося из нее.
Итак,
из формул (4) и (3) =>
 вытекают два важных следствия:
вытекают два важных следствия:
-
энтропия изолированной системы возрастает, если в системе протекают необратимые процессы – система переходит из менее вероятных - жидких состояний в более вероятные – газообразные состояния;
-
энтропия системы находящейся в равновесном состоянии максимальна и остается постоянной
Методика определения изменения энтропии испаряющейся жидкости.
-
Определить температуру, при которой идет опыт, по термометру находящемуся в лаборатории.
-
Налив в стаканчик этиловый спирт, поместить его на левую чашку аналитических весов и провести уравновешивание их в соответствие с правилами взвешивания и записать в таблицу исходное значение массы mo
-
Зафиксировать на часах начало отсчета времени, после чего в течение 5 минут наблюдать изменение массы спирта в процессе испарения по перемещению светового указателя весов. По истечении 5 минут записав в таблицу новое значение массы m 1 необходимо определить изменение показаний весов Δm1 которое будет равно массе испарившегося спирта.
m1 = mo – m1
-
Повторив опыт еще 2 раза определяем значение массы m 2 и m3 и соответственно массу испарившегося спирта за равные промежутки времени
m2 = m1 – m2 m3 = m2 – m3
-
На основании результатов трех опытов можно рассчитать среднее значение массы испарившегося спирта <Δm> и количество теплоты
Q = r <m>
-
Рассчитать изменение энтропии системы молекул спирта при испарении части спирта по формуле:
 (5)
(5)
Для рассчетов значение удельной теплоты парообразования этилового спирта "r" взять равной 925 105 Дж/кг
Т – температура по шкале Кельвина.
-
Результаты измерений и рассчетов занести в таблицу
-
Сделать выводы по работе.
Таблица 1.
|
N n/n |
T, K |
mi 10-6 кг |
∆m10-6 кг |
<∆m> 10-6кг |
r Дж/кг |
∆S Дж/K |
Контрольные вопросы
1 Расскажите чем отличаются друг от друга по строению – структуре газы жидкости и твердые кристаллические тела
2 Расскажите в каких средах имеются области ближнего и дальнего порядка
3Поясните физический смысл энтропии как функции состояния
4 Поясните статистический смысл энтропии
5 Напишите формулу связи энтропии и термодинамической вероятности
6 Сформулируйте третье начало термодинамики с использованием понятия энтропии для макросистем
7 Какие процессы называются равновесными неравновесными и квазистатическими?
Библиографический список
-
ИВ Савельев Курс физики т1М Наука1989 С292 - 300 321 - 322
-
ТИ Трофимова Курс физики 2-изд -М Высш шк 1990 С97-99 103 -105
3 Детлаф АА Яворский БМ Курс физики- М Высш шк 1989 С129 - 138 141 -143
