
- •Щелочность
- •8.1. Определение карбонатной и свободной щелочности
- •8.2. Потенциометрическое определение гидрокарбонатов
- •13. Жесткость
- •13.1. Определение общей жесткости воды комплексонометрическим методом
- •13.2. Определение массовой концентрации ионов кальция и магния комплексонометрическим методом. Расчет жесткости воды в градусах жесткости (ºЖ)
- •14. Кислород
- •14.1. Йодометрическое определение растворенного кислорода
- •17. Остаточный активный хлор
- •17.1. Определение суммарного остаточного хлора йодометрическим методом
- •17.2. Определение свободного остаточного хлора титрованием метиловым оранжевым
- •9. Хлориды
- •9.1. Аргентометрическое определение
14. Кислород
Кислород является одним из важнейших растворенных газов, присутствующих в поверхностных водах. Основным источником поступления кислорода в поверхностные воды являются процессы абсорбции его из атмосферы, а также в результате фотосинтеза водных организмов. Абсорбция кислорода из атмосферы происходит на поверхности водоема. Скорость этого процесса повышается с понижением температуры и повышением атмосферного давления.
Кислород также может поступать в водоемы с дождевыми и снеговыми водами, которые обычно им пересыщены.
Потребление кислорода в воде связано с химическими и биохимическими процессами окисления органических и некоторых неорганических веществ (Fe2+, Mn2+, NH4+, NO2−).
Растворенный кислород в поверхностных водах находится в виде молекул О2. Растворимость его растет с понижением температуры, минерализации и повышением давления.
В поверхностных водах содержание растворенного кислорода может колебаться от 0 до 14 мг/дм3 и подвержено значительным сезонным и суточным колебаниям. В речных водоемах наиболее высокие концентрации наблюдаются обычно в осеннее время, наиболее низкие – зимой, когда в результате образования ледяного покрова прекращается поступление кислорода из атмосферы.
Кислородный режим оказывает глубокое влияние на жизнь водоема. Минимальное содержание растворимого кислорода обеспечивающее нормальное развитие рыб, составляет около 5 мг О2/дм3. Понижение его до 2 мг/дм3 вызывает массовую гибель рыб.
Для систематического контроля содержания кислорода в поверхностных водах рекомендуются химические титриметрические методы (главным образом, йодометрический) и физико-химические методы (в основном электрохимические).
14.1. Йодометрическое определение растворенного кислорода
Принцип метода. Йодометрический метод определения массовой концентрации растворенного кислорода заключается в том, что к анализируемой пробе воды добавляют гидроксид натрия и хлористый или сернокислый марганец, при этом образуется гидроксид марганца согласно уравнению
MnCl2 + 2NaOH = Mn(OH)2 + 2NaCl.
Гидроксид марганца окисляется растворенным в воде кислородом и превращается в MnO2
2Mn(OH)2 + O2 = 2MnO2 + 2H2O.
Цвет осадка из белого становится бурым. Затем раствор подкисляют до кислотной реакции и прибавляют йодид калия, при этом протекает следующая реакция:
MnO2 + 2H2SO4 + 2KI = I2 + MnSO4 + K2SO4 + 2H2O.
Выделившийся йод оттитровывают тиосульфатом натрия в присутствии индикатора крахмала
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI.
Устранение мешающих влияний. Определению растворенного кислорода могут мешать взвешенные и органические вещества, нитриты, железо и другие окислители и восстановители. Влияние взвешенных и окрашенных веществ устраняют предварительным соосаждением их с гидроксидом алюминия. Для этого воду из пробоотборника сифоном переносят в склянку с притертой пробкой вместимостью около 500 см3, опуская сифон до дна склянки. После заполнения склянки продолжают ее наполнение до тех пор, пока не вытеснится вода, соприкасавшаяся с находившимся в склянке воздухом. Склянка должна быть наполнена пробой воды до краев и не иметь внутри на стенках пузырьков воздуха. Добавляют в пробу 4 см3 раствора сульфата алюминия с массовой долей равной 0,2 (20 %), 2 см3 концентрированного раствора аммиака, закрывают склянку и перемешивают содержимое. После отстаивания жидкость над осадком переливают сифоном в кислородную склянку и производят определение.
В пробы, содержащие плохо осаждающиеся взвешенные вещества, которые могут вызвать снижение концентрации кислорода вследствие интенсивной жизнедеятельности микроорганизмов, перед добавлением растворов сульфата алюминия и аммиака добавляют 2 см3 смешанного раствора сульфаминовой кислоты с массовой долей, равной 0,08 (8 %), и сульфата меди с массовой долей, равной 0,12 – 0,13 (12-13 %).
В присутствии восстановителей последовательность анализа изменяется. В этом случае после заполнения кислородной склянки пробой воды в нее добавляют 0,5 см3 раствора соляной кислоты в соотношении концентрированной кислоты к дистиллированной воде 2:1 и 0,5 см3 смешанного раствора гипохлорита и сульфата натрия, чтобы смешанный раствор содержал около 0,3 % активного хлора. Склянку закрывают пробкой, перемешивают и оставляют в темном месте. Через 30 минут для удаления избытка непрореагировавшего гипохлорита добавляют 1 см3 смешанного раствора роданида калия и сульфата натрия (50 г сульфата натрия и 2 г роданида калия растворяют в 200 см3 дистиллированной воды). Пробу перемешивают и через 10 минут выполняют фиксацию и определение кислорода.
При содержании в анализируемой пробе более 1 мг/дм3 железа в пробу перед добавлением раствора кислоты следует внести 1 см 3 раствора фторида калия с массовой долей, равной 0,4 (40 %).
Добавление всех растворов в склянку с пробой осуществляют, погружая пипетку примерно до половины склянки и поднимая ее вверх по мере выливания раствора.
Приготовление растворов. 1. Раствор хлорида (сульфата) марганца (II). 210 г MnCl2·4H2O или 260 г MnSO4·5H2O или 290 г MnSO4·7H2O растворяют в 300 – 350 см3 дистиллированной воды, фильтруют в мерную колбу вместимостью 500 см3 и доливают дистиллированной водой до метки на колбе. Для проверки чистоты приготовленного раствора к 100 см3 дистиллированной воды добавляют 1 см3 приготовленного раствора, 0,2 г сухого KI, 5 см3раствора HCl и 1 см3 0,5%-ного раствора крахмала. Отсутствие через 10 минут синей окраски указывает на чистоту реактива. В противном случае для очистки раствора на каждые 100 см3 добавляют около 0,5 – 1,0 г безводного карбоната натрия, хорошо перемешивают, отстаивают в течение суток, а затем фильтруют. Проверку чистоты раствора хлорида (сульфата) марганца (II) проводят после проверки чистоты KI.
2. Раствор крахмала с массовой долей 0,005 (0,5 %). 0,5 г крахмала взбалтывают с 15 – 20 см3 дистиллированной воды. Суспензию постепенно приливают к 80 – 85 см3 кипящей дистиллированной воды и кипятят еще 2 – 3 минуты. После охлаждения консервируют добавлением 2 – 3 капель хлороформа. Хранят не более 1 месяца.
3. Щелочной раствор йодида калия (или натрия). 15 г KI (или 18 г NaI·Н2О) растворяют в 20 см3, а 50 г NaОН – в 50 см3 дистиллированной воды. Полученные растворы смешивают в мерной колбе вместимостью 100 см3 и доводят объем до метки дистиллированной водой. Если раствор окажется мутным, его следует приготовить заново из других реактивов. Если это невозможно, то раствор фильтруют через стеклянную вату или дают ему отстояться в течение 15 – 20 дней, после чего прозрачный раствор сливают через сифон. Щелочной раствор йодида хранят в склянке из темного стекла с плотной резиновой пробкой в темном месте не более 6 месяцев. Для проверки чистоты йодистого калия 1 г сухого KI (или NaI) растворяют в 50 см3 дистиллированной воды, приливают 10 см3 раствора HCl (2:1), 1 см3 раствора крахмала и добавляют 100 см3 свежепрокипяченной и охлажденной до комнатной температуры дистиллированной воды. Если в течение 5 минут не появится голубая окраска, реактив пригоден для использования. В противном случае йодистый калий должен быть очищен. Для этого 15 г KI растворяют в 10 см3 дистиллированной воды в склянке с притертой пробкой, продувают током СО2 и оставляют в темноте на 2 – 3 суток. Затем к раствору добавляют крахмал (0,5 − 1,0 г), растертый в ступке с 10 см3 дистиллированной воды. Раствор встряхивают и быстро фильтруют через бумажный фильтр. Раствор при стоянии не должен приобретать желтую окраску. В противном случае операция очистки должна быть повторена.
Для проверки чистоты NaOH 5,0 г отмытого от поверхностного слоя карбоната натрия растворяют в 10 см3 дистиллированной воды. К 1 см3 полученного раствора добавляют 100 см3 воды, 0,2 г сухого проверенного на чистоту KI, 5 см3 раствора HCl (2:1) и 1 см3 раствора крахмала. Если в течение 5 минут не появится голубая окраска, реактив пригоден для использования. В противном случае 50 г NaОН, предварительно обмытого водой, растворяют в 30 – 40 см3 дистиллированной воды и кипятят в течение 10 минут с металлическим алюминием. Раствору дают остыть и отстояться, а затем сливают с осадка сифоном.
4. Раствор соляной кислоты 2:1. 340 см3 концентрированной соляной кислоты добавляют к 170 см3 дистиллированной воды. Вместо раствора соляной кислоты может быть использована серная кислота. Для этого 100 см3 концентрированной серной кислоты добавляют небольшими порциями к 400 см3 дистиллированной воды.
5. Стандартный
раствор дихромата калия с
с(1/6 К2Сr2O7) = 0,02 моль/дм3.
Навеску 0,4904 г К2Сr2O7,
предварительно высушенного в сушильном
шкафу при 105°С в течение 1 – 2 часов,
переносят количественно в мерную колбу
вместимостью 500 см3,
растворяют в дистиллированной воде и
доводят до метки на колбе. Хранят в
склянке с притертой пробкой в темном
месте не более 6 месяцев.
К2Сr2O7) = 0,02 моль/дм3.
Навеску 0,4904 г К2Сr2O7,
предварительно высушенного в сушильном
шкафу при 105°С в течение 1 – 2 часов,
переносят количественно в мерную колбу
вместимостью 500 см3,
растворяют в дистиллированной воде и
доводят до метки на колбе. Хранят в
склянке с притертой пробкой в темном
месте не более 6 месяцев.
6. Стандартный раствор тиосульфата натрия с с(Na2S2O3) = 0,02 моль/дм3. Навеску 2,5 г Na2S2O3·5Н2О переносят в мерную колбу вместимостью 500 см3, растворяют в дистиллированной воде, которую предварительно кипятят 1,5 часа, охлаждают до комнатной температуры и доводят до метки.
В качестве консерванта к полученному раствору добавляют 3 см3 хлороформа. Перед определением точной концентрации раствор выдерживают не менее 5 суток. Хранят в склянке из темного стекла, закрытой пробкой с вставленным в нее сифоном с бюреткой и хлоркальциевой трубкой, заполненной гранулированным КОН или NаОН, не более 4 месяцев.
Точную концентрацию стандартного раствора тиосульфата натрия определяют с помощью стандартного раствора дихромата калия. Для этого в колбу для титрования вносят 80 – 90 см3 дистиллированной воды, 10 см3 стандартного раствора дихромата калия, добавляют 1 г сухого иодида калия и 10 см3 раствора соляной кислоты. Раствор перемешивают, выдерживают 5 минут в темном месте и титруют пробу раствором тиосульфата натрия до появления слабо-желтой окраски. Затем добавляют 1 см3 раствора крахмала с массовой долей 0,005 и продолжают титрование до исчезновения синей окраски.
Определение повторяют и при отсутствии расхождения более 0,05 см3 за результат определения принимают их среднее значение.
Точную концентрацию раствора тиосульфата натрия, моль/дм3, находят по формуле
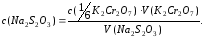
7. Калибровка кислородных склянок. Для определения точной вместимости склянки для фиксации кислорода ее тщательно моют, высушивают (снаружи и изнутри) и взвешивают вместе с пробкой на технических весах с точностью до 0,01 г. Затем наполняют ее до краев дистиллированной водой, закрывают пробкой так, чтобы не осталось пузырьков воздуха под пробкой. Обтирают склянку досуха и снова взвешивают с точностью до 0,01 г. Объем склянки V рассчитывают по формуле

где
 m1
– масса склянки с водой, г;
m1
– масса склянки с водой, г;
 m2
– масса пустой склянки, г;
m2
– масса пустой склянки, г;
ρ
 –
плотность воды при температуре
взвешивания, г/см3
(ρ
при температурах 15, 20 и 25°С равна
соответственно 0,998, 0,997 и 0,996 г/см3).
–
плотность воды при температуре
взвешивания, г/см3
(ρ
при температурах 15, 20 и 25°С равна
соответственно 0,998, 0,997 и 0,996 г/см3).
Ход определения. При отсутствии в анализируемой воде мешающих определению веществ (либо после устранения их) отбирают пробы воды так, чтобы под пробкой не было пузырьков воздуха. Для этого калиброванную кислородную склянку с пробкой помещают в стакан. Пробку открывают и опускают на дно резиновую трубку, при помощи которой склянку наполняют исследуемой водой так, чтобы весь воздух из нее был вытеснен, а затем продолжают наполнение до тех пор, пока не выльется приблизительно 100 см3 воды, т.е. пока не вытеснится вода, соприкасавшаяся с воздухом, находящимся в склянке. Трубку вынимают, не прекращая тока воды. Склянка должна быть заполнена пробой до краев и не иметь внутри на стенках пузырьков воздуха.
В кислородную склянку, заполненную доверху пробой, вводят пипеткой 1 см3 раствора MnCl2 или MnSO4 . Наполненную этим раствором пипетку надо погрузить до самого дна кислородной склянки, открыть верхний ее конец и по мере вливания раствора поднимать вверх. Затем другой пипеткой наливают 1 см3 щелочного раствора KI.
В этом случае конец пипетки погружают до половины склянки. Затем склянку осторожно закрывают пробкой так, чтобы под пробкой не оставалось пузырьков воздуха. При этом из склянки выливается 2 см3 анализируемой воды, т.е. столько, сколько налили в склянку реактивов. На эту потерю вносят при расчете соответствующую поправку. Закрытую пробкой склянку тщательно перемешивают 15 − 20 кратным переворачиванием склянки до равномерного распределения осадка в воде и помещают в темное место для отстаивания (не менее 10 мин).
После этого, как отстоявшийся осадок будет занимать менее половины высоты склянки, к пробе приливают 5 см3 или 10 см3 (в зависимости от вместимости склянки) раствора соляной кислоты, погружая при этом пипетку до осадка (не взмучивать!) и медленно поднимая ее вверх по мере опорожнения. Вытеснение из склянки части прозрачной жидкости для анализа значения не имеет.
Склянку снова закрывают пробкой, и содержимое тщательно перемешивают. Осадок MnO2 растворяется, а раствор от выделившегося йода приобретает желтый цвет. После этого содержимое склянки переносят и ополаскивают склянку дистиллированной водой, сливая ее в ту же колбу. Через 5 минут титруют выделившийся йод раствором тиосульфата натрия до светло-желтой окраски. Прибавляют 1 − 2 см3 раствора крахмала и продолжают титрование до исчезновения синей окраски.
Расчет. Массовую концентрацию растворенного кислорода Х, мг/дм3, в анализируемой пробе воды находят по формуле

где c – молярная концентрация раствора тиосульфата натрия, моль/дм3;
V – объем раствора тиосульфата натрия, израсходованный на титрование, см3;
Vск – вместимость кислородной склянки,
см3;
– вместимость кислородной склянки,
см3;
V1 – суммарный объем растворов хлорида марганца и йодида калия, добавленных в склянку при фиксации растворенного кислорода;
8,0 – молярная масса эквивалента кислорода, мг/ммоль.
