
- •Щелочность
- •8.1. Определение карбонатной и свободной щелочности
- •8.2. Потенциометрическое определение гидрокарбонатов
- •13. Жесткость
- •13.1. Определение общей жесткости воды комплексонометрическим методом
- •13.2. Определение массовой концентрации ионов кальция и магния комплексонометрическим методом. Расчет жесткости воды в градусах жесткости (ºЖ)
- •14. Кислород
- •14.1. Йодометрическое определение растворенного кислорода
- •17. Остаточный активный хлор
- •17.1. Определение суммарного остаточного хлора йодометрическим методом
- •17.2. Определение свободного остаточного хлора титрованием метиловым оранжевым
- •9. Хлориды
- •9.1. Аргентометрическое определение
17.2. Определение свободного остаточного хлора титрованием метиловым оранжевым
Метод основан на окислении свободным хлором метилового оранжевого, в отличие от хлораминов, окислительный потенциал которых недостаточен для разрушения метилового оранжевого.
Приготовление растворов. 1. Приготовление раствора метилового оранжевого с массовой долей 0,00005 (0,005 %). 50 мг метилового оранжевого растворяют в дистиллированной воде в мерной колбе и доводят дистиллированной водой до 1 дм3. 1 см3 этого раствора соответствует 0,0217 мг свободного хлора.
2. Приготовление 5 моль/дм3 раствора соляной кислоты. В мерную колбу наливают дистиллированную воду, затем медленно добавляют 400 см3 соляной кислоты плотностью 1,19 г/см3 и доводят дистиллированной водой до 1 дм3.
Ход определения. 100 см3 анализируемой воды помещают в фарфоровую чашку, добавляют 2 – 3 капли 5 моль/дм3 раствора соляной кислоты и, помешивая, быстро титруют раствором метилового оранжевого до появления неисчезающей розовой окраски.
Расчет. Содержание свободного остаточного хлора Х1, мг/дм3, вычисляют по формуле
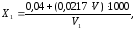
где V – объем раствора метилового оранжевого, см3;
0,0217 – титр раствора метилового оранжевого, мг/см3;
0,04 – эмпирический коэффициент;
V1 – объем воды, взятый для анализа, см3.
По разности между содержанием суммарного остаточного хлора, определенного йодометрическим методом (Х), и содержанием свободного остаточного хлора, определенного методом титрования метиловым оранжевым (Х1), находят содержание хлораминового хлора (Х2) в мг/дм3:
Х2 = X – X1.
9. Хлориды
Хлориды в воде имеют большое распространение и могут поступать в нее в результате обмена с океаном через атмосферу, взаимодействия атмосферных осадков с почвами, особенно засоленными, с бытовыми и промышленными сбросами. В отличие от карбонатных и сульфатных ионов, хлориды не склонны к образованию ассоциированных ионных пар. Обладают наибольшей миграционной способностью, что объясняется их хорошей растворимостью, слабо выраженной способностью к сорбции на взвесях и потреблением водными организмами.
Большинство рек и пресных озер содержат хлорид-ионов от долей миллиграмма до десятков, а иногда и сотен миллиграммов на литр. Повышенные содержания хлоридов ухудшают вкусовые качества воды и делают ее малопригодной для питьевого водоснабжения и ограничивают применение для многих технических целей.
При определении хлоридов в воде используют химические титриметрические методы, фотоколориметрические, потенциометрические с использованием ионоселективных электродов.
9.1. Аргентометрическое определение
Принцип метода. В основе метода лежит реакция между ионами хлора и серебра, образующими малорастворимое соединение хлорид серебра, количественно выпадающее в осадок из раствора
Cl− + Ag+ = AgCl↓.
белый осадок
В качестве индикатора применяют K2Cr2O7. После полного выделения в осадок ионов хлора в виде хлорида серебра начинается образование осадка Ag2CrO4 красно-бурого цвета. Изменение окраски вследствие образования Ag2CrO4 и служит указанием на конец реакции. Метод предназначен для анализа вод при содержании хлоридов выше 10 мг/дм3. Точность метода 1 – 3 мг/дм3.
В данном методе вместе с хлоридами титруются бромиды и иодиды, но этим пренебрегают, так как в природных водах их содержание невелико.
Устранение мешающих влияний. Если вода мутная, ее фильтруют через беззольный фильтр, промытый горячей водой. Если вода имеет цветность, пробу обесцвечивают добавлением гидроксида алюминия (к 200 см3 пробы добавляют 6 см3 суспензии гидроксида алюминия и смесь встряхивают до обесцвечивания, затем пробу фильтруют через беззольный фильтр). Если в воде имеется сероводород и гидросульфид-ионы, воду следует подкислить 0,1 М раствором азотной кислоты по лакмусовой бумаге и пропустить ток воздуха в течение нескольких минут.
Ход определения. Качественное определение. В колориметрическую пробирку наливают 5 см3 воды и добавляют 3 капли раствора с массовой долей азотнокислого серебра в растворе 0,10 (10 %). Примерное содержание хлорид-иона определяют по осадку или мути в соответствии с требованиями табл. 3.1.
Таблица 3.1
Качественная оценка содержания хлоридов в воде
|
Характеристика осадка или мути |
Содержание Сl−, мг/дм3 |
|
Опалесценция или слабая муть |
1 – 10 |
|
Сильная муть |
10 – 50 |
|
Образуются хлопья, осаждающиеся не сразу |
50 – 100 |
|
Белый объемный осадок |
Более 100 |
Количественное определение. В зависимости от результатов качественного определения отмерят 100 см3 или меньший объем пробы, доводя его до 100 см3 дистиллированной водой. Титруемая проба должна иметь рН от 6 до 10. Затем к пробе добавляют 2−3 капли насыщенного хромата калия и титруют 0,02 моль/дм3 раствором азотнокислого серебра до неисчезающей при перемешивании окраски буроватого цвета, появляющейся от одной капли раствора AgNO3.
Расчет. Массу хлорид-ионов в мг/дм3 рассчитывают по формуле
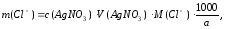
где c(AgNO3) – молярная концентрация азотнокислого серебра, моль/дм3;
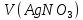 V(AgNO3) – объем
раствора азотнокислого серебра, пошедшего
на титрование, см3;
V(AgNO3) – объем
раствора азотнокислого серебра, пошедшего
на титрование, см3;
 M(Cl-) – молярная
масса хлорид ионов, мг/ммоль;
M(Cl-) – молярная
масса хлорид ионов, мг/ммоль;
а – объем пробы, взятый для титрования, см3.
1При величине щелочности более 200 мг/дм3 объем пробы уменьшается до 10, 25 или 50 см3. В этом случае пробу разбавляют дистиллированной водой, свободной от СО2, до 100 см3.
