
- •Щелочность
- •8.1. Определение карбонатной и свободной щелочности
- •8.2. Потенциометрическое определение гидрокарбонатов
- •13. Жесткость
- •13.1. Определение общей жесткости воды комплексонометрическим методом
- •13.2. Определение массовой концентрации ионов кальция и магния комплексонометрическим методом. Расчет жесткости воды в градусах жесткости (ºЖ)
- •14. Кислород
- •14.1. Йодометрическое определение растворенного кислорода
- •17. Остаточный активный хлор
- •17.1. Определение суммарного остаточного хлора йодометрическим методом
- •17.2. Определение свободного остаточного хлора титрованием метиловым оранжевым
- •9. Хлориды
- •9.1. Аргентометрическое определение
13. Жесткость
Жесткость воды представляет собой свойство природной воды, зависящее от наличия в ней главным образом растворенных солей кальция и магния. Суммарное содержание этих солей в воде в ммоль/дм3 называют общей жесткостью.
Главными источниками поступления кальция и магния в поверхностные воды являются процессы химического выветривания и растворения минералов, прежде всего известняков и доломитов. Значительные количества ионов кальция и магния могут поступать в водоемы со сточными водами предприятий силикатной, металлургической, текстильной, стекольной, химической и других отраслей промышленности.
Ионная
форма кальция и магния характерна для
маломинерализованных вод. Значительная
часть их находится в виде нейтральных
или заряженных форм (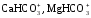 )
ионных пар, а также связанных в комплексы
с органическими веществами вод.
)
ионных пар, а также связанных в комплексы
с органическими веществами вод.
Общая жесткость колеблется от единиц до десятков, иногда сотен ммоль/дм3. Обычно преобладает (до 70 %) жесткость, обусловленная ионами кальция.
Жесткость морской воды и воды океанов обычно выше, причем часто магниевая жесткость превосходит кальциевую.
Общая жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период паводка. Жесткость подземных вод более постоянна.
Высокая жесткость, особенно обусловленная солями магния, ухудшает органолептические свойства воды, придавая ей горьковатый вкус, и оказывает действие на органы пищеварения. В зависимости от рН и щелочности воды жесткость выше 10 ммоль/дм3может вызывать образование шлаков в распределительной системе водоснабжения и накипи при нагревании.
13.1. Определение общей жесткости воды комплексонометрическим методом
Принцип метода. Метод основан на образовании комплексных соединений трилона Б с ионами щелочноземельных элементов. Определение проводят титрованием пробы раствором трилона Б при рН 10 в присутствии индикатора эриохром черного Т.
При рН 10 трилон Б способен образовывать с ионами магния и кальция малодиссоциированные комплексы:
Na2H2Y + Ca2+ ↔ Na2CaY + 2H+;
Na2H2Y + Mg2+ ↔ Na2MgY + 2H+.
Индикатор эриохром черный Т (хромоген черный специальный ЕТ−100) при добавлении в пробу воды образует с ионами магния красно-фиолетовое комплексное соединение. При титровании трилон Б соединяется с ионами кальция, а затем с ионами магния и вытесняет индикатор, который в свободной форме имеет голубую окраску. В точке эквивалентности индикатор дает резкий переход окраски:
HInd2- + Mg2+ ↔ MgInd- + H+
красно-фиолетовый
голубой
MgInd- + Na2H2Y ↔ Na2MgY + HInd2- + H+.
голубой
красно-фиолетовый
Такого четкого изменения окраски индикатора ионы Са2+ не дают, а поэтому отдельно ионы Са2+ в присутствии индикатора эриохром черного Т определить нельзя.
Для получения воспроизводимых результатов необходимо, чтобы титруемый раствор имел рН = 10 ± 0,2 и достаточное количество ионов магния.
Если исследуемая проба была подкислена для консервации или проба имеет кислую среду, то в аликвоту пробы добавляют раствор гидроксида натрия молярной концентрации 0,2 моль/дм3 до рН 6 – 7. Если проба воды имеет сильнощелочную среду, то в аликвоту пробы добавляют раствор соляной кислоты молярной концентрации 0,1 моль/дм3 до рН 6 – 7. Контроль рН проводят по универсальной индикаторной бумаге или с использованием рН-метра.
Устранение мешающих влияний. Присутствие в воде более 10 мг/дм3 ионов железа, более 0,05 мг/дм3 каждого из ионов меди, кадмия, кобальта, свинца, более 0,1 мг/дм3 каждого из ионов марганца (II), алюминия, цинка, никеля, олова, а также цветность более 200º и повышенная мутность вызывают при титровании нечеткое изменение окраски в точке эквивалентности, и приводит к завышению результатов определения жесткости. Ортофосфат- и карбонат-ионы могут осаждать кальций в условиях титрования при рН 10. Мешающее влияние ионов Zn2+ до 200 мг/дм3; Al3+, Cd2+, Pb2+ до 20 мг/дм3; Fe3+ до 5 мг/дм3; Mn2+, Co2+, Cu2+, Ni2+ до 1 мг/дм3 устраняют прибавлением к титруемой пробе раствора сульфида натрия с массовой долей 0,05 (5 %). Для уменьшения влияния марганца до 1 мг/дм3, железа, алюминия до 20 мг/дм3, меди до 0,3 мг/дм3 добавляют от 5 до 10 капель раствора гидроксиламина гидрохлорида. Мутность пробы устраняют фильтрованием через мембранные фильтры с порами диаметром 0,45 мкм или бумажные обеззоленные фильтры «синяя лента».
Если мешающее влияние устранить невозможно, то определение жесткости проводят методами атомной спектроскопии.
Выбор объема пробы для анализа. Перед выполнением анализа пробы воды с неизвестной величиной жесткости проводят оценочное титрование. Для этого берут 10 см3 воды, добавляют 0,5 см3 буферного раствора, индикатор и титруют раствором трилона Б с с(1/2 Na2H2Y) = 0,05 моль/дм3 до перехода окраски в голубую. По величине израсходованного на титрование объема раствора трилона Б выбирают из табл. 13.1 соответствующий объем пробы воды.
Ход определения. В коническую колбу вместимостью 250 см3 отмеряют пипеткой требуемый объем пробы, доводят, если необходимо, до 100 см3 дистиллированной водой, добавляют 5 см3 буферного раствора, от 0,05 до 0,1 г сухой смеси индикатора. Пробу тщательно перемешивают и титруют раствором трилона Б с с(1/2 Na2H2Y) = 0,05 моль/дм3 до перехода красно-фиолетовой окраски в голубую. Повторяют титрование и, если расхождение между параллельными титрованиями не превышает 0,05 см3 при объеме раствора трилона Б 5 см3 или менее 0,1 см3 при объеме более 5 см3, за результат принимают среднее значение объема раствора трилона Б. В противном случае повторяют титрование до получения допустимого расхождения результатов.
Таблица 13.1
Объем пробы воды, рекомендуемый для определения жесткости по результатам оценочного титрования
|
Объем израсходованного раствора трилона Б, см3 |
< 2 |
2 − 4 |
6 – 8 |
>8 |
|
Рекомендуемый объем пробы, см3 |
100 |
50 |
25 |
10 |
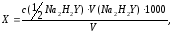
где с(1/2 Na2H2Y) – молярная концентрация эквивалента трилона Б, моль/дм3;
V(Na2H2Y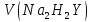 )
– объем раствора трилона Б, пошедшего
на титрование пробы, см3;
)
– объем раствора трилона Б, пошедшего
на титрование пробы, см3;
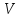 V
– объем пробы воды, взятый для определения,
см3.
V
– объем пробы воды, взятый для определения,
см3.
