
- •Щелочность
- •8.1. Определение карбонатной и свободной щелочности
- •8.2. Потенциометрическое определение гидрокарбонатов
- •13. Жесткость
- •13.1. Определение общей жесткости воды комплексонометрическим методом
- •13.2. Определение массовой концентрации ионов кальция и магния комплексонометрическим методом. Расчет жесткости воды в градусах жесткости (ºЖ)
- •14. Кислород
- •14.1. Йодометрическое определение растворенного кислорода
- •17. Остаточный активный хлор
- •17.1. Определение суммарного остаточного хлора йодометрическим методом
- •17.2. Определение свободного остаточного хлора титрованием метиловым оранжевым
- •9. Хлориды
- •9.1. Аргентометрическое определение
8.1. Определение карбонатной и свободной щелочности
Определение карбонат- и гидрокарбонат-ионов проводят в одной пробе титрованием 0,1 моль/дм3 раствором соляной кислоты в присутствии фенолфталеина (фф.), а затем метилового оранжевого (м.о.).
При наличии в воде карбонатов прибавленный к ней фенолфталеин окрасит раствор в розовый цвет. В этом случае титруют 0,1 моль/дм3 раствором НСl до полного обесцвечивания раствора.
При
титровании карбонат (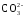 )
и гидрокарбонат (
)
и гидрокарбонат (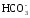 )
ионов, при их совместном присутствии,
протекают следующие реакции:
)
ионов, при их совместном присутствии,
протекают следующие реакции:
 +
НСl
= Cl−
+
+
НСl
= Cl−
+
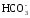 I
стадия; фенолфталеин
I
стадия; фенолфталеин
 +
НСl
= Cl−
+ CO2
+Н2О
+
НСl
= Cl−
+ CO2
+Н2О
II стадия; метиловый оранжевый
 +
НСl
= Cl−
+ CO2
+Н2О
+
НСl
= Cl−
+ CO2
+Н2О
В этой смеси на I стадии в присутствии индикатора фенолфталеина оттитровываются карбонат-ионы до гидрокарбонат-ионов, а затем в присутствии метилового оранжевого (II стадия) – гидрокарбонат-ионы, образовавшиеся из карбонат-ионов, и гидрокарбонат-ионы, изначально находившиеся в смеси.
Ход определения. В коническую колбу емкостью 200 – 250 см3 отмеряют пипеткой 100 см3 исследуемой воды и прибавляют 2 − 3 капли фенолфталеина. При появлении розовой окраски проводят титрование 0,1 моль/дм3 раствором НСl до полного обесцвечивания. Затем к той же пробе прибавляют 2 – 3 капли метилового оранжевого и тируют до розовой окраски.
Расчет.
Массу карбонат-ионов ( )
и гидрокарбонат-ионов (
)
и гидрокарбонат-ионов ( )
в мг/дм3
рассчитывают по следующим формулам:
)
в мг/дм3
рассчитывают по следующим формулам:
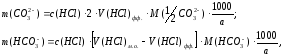
 где
с(HCl) – молярная
концентрация раствора соляной кислоты,
моль/дм3;
где
с(HCl) – молярная
концентрация раствора соляной кислоты,
моль/дм3;
V(HCl)м.о. и V(HCl)фф. – объемы раствора HCl, пошедшие на титрование с фенолфталеином и метиловым оранжевым, см3;
а – объем пробы воды, см3;
 M(1/2
M(1/2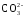 ) – молярная
масса эквивалента карбонат-ионов,
мг/ммоль;
) – молярная
масса эквивалента карбонат-ионов,
мг/ммоль;
M( )
– молярная масса гидрокарбонат-ионов,
мг/ммоль.
)
– молярная масса гидрокарбонат-ионов,
мг/ммоль.
В случае отсутствия карбонатов, исследуемую воду титруют в присутствии метилового оранжевого и определяют общую щелочность (Щ) в ммоль/дм3 по формуле
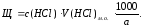
8.2. Потенциометрическое определение гидрокарбонатов
Принцип
метода.
Метод предназначен для анализа
неокрашенных, окрашенных и мутных вод.
Минимально определяемая концентрация
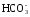 –ионов
– 0,5 мг/дм3.
На результаты определения могут оказывать
влияние анионы слабых кислот, которые
титруются вместе с гидрокарбонат ионами.
–ионов
– 0,5 мг/дм3.
На результаты определения могут оказывать
влияние анионы слабых кислот, которые
титруются вместе с гидрокарбонат ионами.
Ход
определения. В
стакан емкостью 200 см3
отмеряют пипеткой 100 см3
исследуемой воды1и устанавливают на магнитную мешалку.
В стакан с пробой воды погружают
закрепленные на штативе электроды.
Ручку диапазона измерений рН-метра
устанавливают на диапазон 1 − 14
рН. Заполняют микробюретку стандартным
раствором соляной кислоты сс(НСl) = 0,05
моль/дм3.
Включают мешалку и титруют сначала
грубо – по 0,1 см3
раствора соляной кислоты, а затем тонкое
– по 0,03 – 0,05 см3
раствора НСl.
После каждой порции титранта через
7 – 10 с измеряют рН. Значения
рН, соответствующие различным моментам
титрования, наносят на график и получают
кривую титрования с резким изменением
рН вблизи точки эквивалентности. Точку
эквивалентности находят по максимуму
на дифференциальной кривой, построенной
в координатах
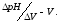
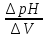
Расчет.
Массу гидрокарбонат-ионов (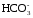 )
в мг/дм3
рассчитывают по формуле
)
в мг/дм3
рассчитывают по формуле
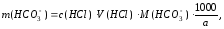
где с(HCl) – молярная концентрация раствора соляной кислоты, моль/дм3;
V(HCl) – объем раствора HCl, пошедший на титрование, см3;
а – объем пробы воды, см3;
M(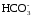 ) – молярная
масса гидрокарбонат-ионов, мг/ммоль.
) – молярная
масса гидрокарбонат-ионов, мг/ммоль.
