
- •Министерство транспорта Российской Федерации
- •Подписано в печать . Формат 60х90 1/16.
- •Введение
- •1. Эквивалент. Закон эквивалентов
- •Примеры решения задач
- •2. Строение атомов
- •3. Периодическая система химических элементов
- •4. Химическая связь
- •Примеры решения задач
- •5. Энергетика химических процессов
- •Примеры решения задач
- •6. Химическое сродство Примеры решения типовых задач
- •Поскольку rН0, rS0 и rG0 реакции связаны друг с другом уравнением:
- •7. Скорость химических реакций Примеры решения типовых задач
- •8. Химическое равновесие Примеры решения типовых задач
- •9. Коллигативные свойства растворов Примеры решения типовых задач
- •10. Ионно-молекулярные реакции обмена Примеры решения задач
- •Решение. В насыщенном растворе сульфата свинца существует гетерогенное равновесие:
- •Решение.
- •Решение.
- •12. Окислительно – восстановительные реакции
- •Примеры решения задач
- •Основные типы окислительно-восстановительных реакций (овр)
- •13. Электродные процессы и гальванические элементы
- •Примеры решения задач
- •14. Электролиз Примеры решения задач
- •15. Коррозия металлов Примеры решения задач
- •16. Комплексные соединения Примеры решений типовых задач
- •Взаимодействие металлов со щелочами
- •Взаимодействие металлов с кислотами
- •18. Полимеры
- •Примеры решения задач
- •19. Дисперсные системы Примеры решений задач
- •20. Количественный анализ
- •Примеры решения задач
- •Константы нестойкости ряда комплексных ионов
8. Химическое равновесие Примеры решения типовых задач
Пример 1. Константа равновесия гомогенной системы
СО (г)+Н2О (г) ↔СО2 (г)+Н2 (г)
при
850°С равна 1. Вычислите концентрации
всех веществ при равновесии, если
исходные концентрации: (![]() )исх.=З
моль/л, (
)исх.=З
моль/л, (![]() )исх.=2
моль/л.
)исх.=2
моль/л.
Решение. При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей называется константой равновесия данной системы и выражается через равновесные концентрации участников реакции следующим образом:
Кравн.
=
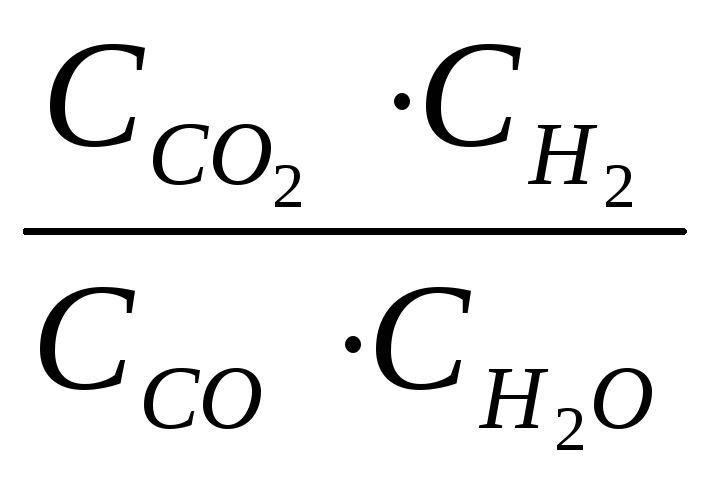
В
условии задачи даны исходные концентрации
тогда как в выражение Кравн.
входят только равновесные концентрации
всех веществ системы. Предположим, что
к моменту равновесия концентрации
(![]() )равн.==
х
моль/л. Согласно уравнению реакции:
)равн.==
х
моль/л. Согласно уравнению реакции:
х моль х моль х моль х моль
СО (г)+Н2О (г) ↔СО2 (г)+Н2 (г)
1моль 1моль 1моль 1моль
число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ будут:
(![]() )равн.
= (
)равн.
= (![]() )равн.
= х
моль/л;
)равн.
= х
моль/л;
(![]() )равн.
= (З
— х) моль/л;
)равн.
= (З
— х) моль/л;
(![]() )равн.
= (2 — х)
моль/л.
)равн.
= (2 — х)
моль/л.
Зная константу равновесия, находим значение х, а затем и исходные концентрации всех веществ:
1
=
![]() ,
,
Отсюда х = 1,2 моль/л. Таким образом, равновесные концентрации участников реакции:
(![]() )равн.
= (
)равн.
= (![]() )равн.
=1,2 моль/л;
(
)равн.
=1,2 моль/л;
(![]() )равн.
= (З —
1,2) = 1,8 моль/л;
)равн.
= (З —
1,2) = 1,8 моль/л;
(![]() )равн.
= (2 — 1,2) = 0,8 моль/л.
)равн.
= (2 — 1,2) = 0,8 моль/л.
Пример 2. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению
РСl5 (г) ↔РСl3 (г) + С12 (г);∆Hх.р. = + 92,59 кдж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции — разложения РСl5?
Решение. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле Шателье:
а) так как реакция разложения РСl5 эндотермическая (∆Нх.р.>0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РСl5 ведет к увеличению объема (из одной молекулы газа образуются две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление;
в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РСl5 так и уменьшением концентрации РСl3 или С12.
Пример 3. Равновесие в системе H2(г)+ I2(г)↔ 2HI(г) установилось при следующих концентрациях участников реакции: HI – 0,05 моль/л, водорода и иода – по 0,01моль/л. Как изменятся концентрации водорода и иода при повышении концентрации HI до 0,08моль/л?
Решение. Зная равновесные концентрации участников реакции, можно рассчитать константу равновесия данной реакции:
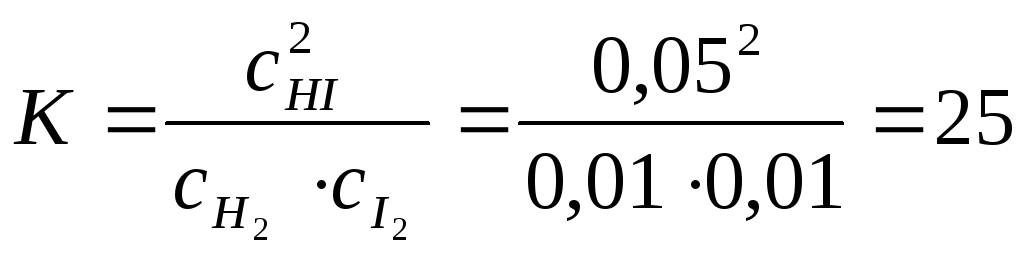 ;
;
При повышении концентрации HI до 0,08моль/л равновесие сместится в обратном направлении, т.е.более интенсивно начнет протекать обратная реакция
хмоль хмоль 2хмоль
H2(г)+ I2(г)↔ 2HI(г)
1моль 1моль 2моль
Если убыль HI к моменту достижения нового состояния равновесия принять равной 2х моль, то прирост концентраций Н2 и I2 к этому моменту составит х моль; подставив новые равновесные концентрации в выражение для константы равновесия, получим:
![]() ,
откуда х
= 0,004,
,
откуда х
= 0,004,
и новые равновесные концентрации Н2 и I2 составят (0,01+0,004) = 0,014 моль/л.
