
- •Министерство транспорта Российской Федерации
- •Подписано в печать . Формат 60х90 1/16.
- •Введение
- •1. Эквивалент. Закон эквивалентов
- •Примеры решения задач
- •2. Строение атомов
- •3. Периодическая система химических элементов
- •4. Химическая связь
- •Примеры решения задач
- •5. Энергетика химических процессов
- •Примеры решения задач
- •6. Химическое сродство Примеры решения типовых задач
- •Поскольку rН0, rS0 и rG0 реакции связаны друг с другом уравнением:
- •7. Скорость химических реакций Примеры решения типовых задач
- •8. Химическое равновесие Примеры решения типовых задач
- •9. Коллигативные свойства растворов Примеры решения типовых задач
- •10. Ионно-молекулярные реакции обмена Примеры решения задач
- •Решение. В насыщенном растворе сульфата свинца существует гетерогенное равновесие:
- •Решение.
- •Решение.
- •12. Окислительно – восстановительные реакции
- •Примеры решения задач
- •Основные типы окислительно-восстановительных реакций (овр)
- •13. Электродные процессы и гальванические элементы
- •Примеры решения задач
- •14. Электролиз Примеры решения задач
- •15. Коррозия металлов Примеры решения задач
- •16. Комплексные соединения Примеры решений типовых задач
- •Взаимодействие металлов со щелочами
- •Взаимодействие металлов с кислотами
- •18. Полимеры
- •Примеры решения задач
- •19. Дисперсные системы Примеры решений задач
- •20. Количественный анализ
- •Примеры решения задач
- •Константы нестойкости ряда комплексных ионов
7. Скорость химических реакций Примеры решения типовых задач
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе
2NО (г) +О2 (г) ↔ 2NО2 (г), если объем газовой смеси уменьшить в три раза?
Решение.
Обозначим концентрации реагирующих
веществ:
![]() =а,
=а,![]() =b,
=b,
![]() =с.
Согласно закону действия масс скорости
(v)
прямой и обратной реакции до изменения
объема
=с.
Согласно закону действия масс скорости
(v)
прямой и обратной реакции до изменения
объема
vпр.= kпр.а2b; vобр. = kобр.c2;
После
уменьшения объема гомогенной системы
в три раза концентрация каждого из
реагирующих веществ увеличится в три
раза:
![]() =За,
=За,![]() =3b,
=3b,
![]() =3с.
При новых концентрациях скорости (v’)
прямой и обратной реакции:
=3с.
При новых концентрациях скорости (v’)
прямой и обратной реакции:
![]() =
kпр.
(За)2
(3b)
= 27kпр.а2b;
=
kпр.
(За)2
(3b)
= 27kпр.а2b;
![]() =
kобр.
(3с)2
= 9kобр.c2.
=
kобр.
(3с)2
= 9kобр.c2.
Отсюда
![]() =
=
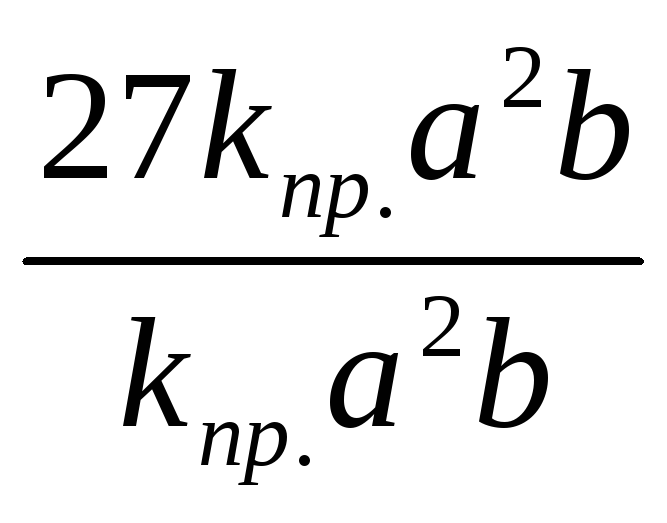 =
27;
=
27;
![]() =
=
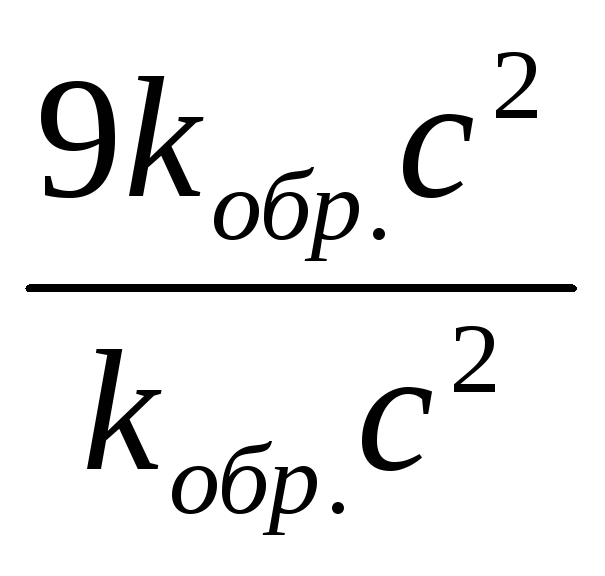 =
9.
=
9.
Следовательно, скорость прямой реакции увеличилась,. в 27 раз, а обратной — в 9 раз.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 50 до 70°С, если температурный коэффициент реакции равен 3.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле:
![]() =
=
![]() ;
;
![]() =
=
![]() =
=![]() = 9
= 9![]() .
.
Следовательно,
скорость реакции (![]() ),
протекающей при температуре 70°С,
увеличилась по сравнению со скоростью
реакции (
),
протекающей при температуре 70°С,
увеличилась по сравнению со скоростью
реакции (![]() ),
протекающей при температуре 50°С, в 9
раз.
),
протекающей при температуре 50°С, в 9
раз.
Пример 3. Энергия активации реакции равна 33кДж/моль. Во сколько раз увеличится скорость реакции при нагревании реакционной смеси с 25 до 60оС?
Решение. Зависимость константы скорости химической реакции от температуры определяется уравнением Аррениуса:
![]() ,
,
где Еа - энергия активации реакции;
А - константа для данной реакции.
Записав
выражения для констант скорости данной
реакции k2
и k1
при температурах соответственно Т2
и Т1
и разделив первое уравнение на второе,
получим:![]()
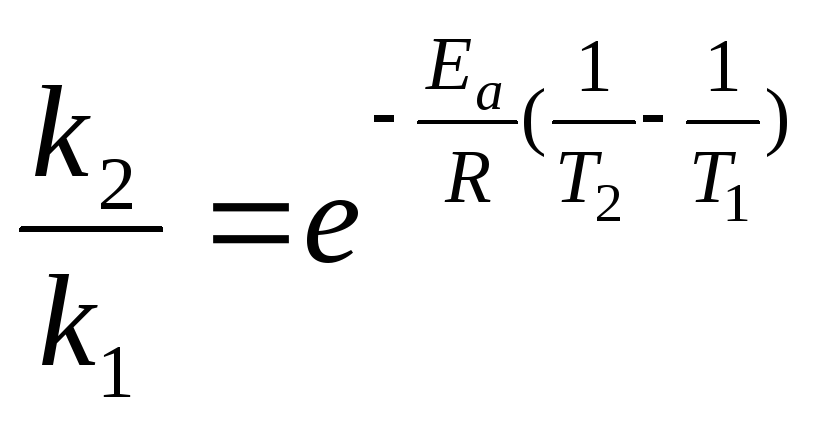 или
или
![]()
![]() отсюда
отсюда
![]() ,
,
т.е. скорость данной реакции увеличится в 4 раза.
Пример 4. Начальные концентрации исходных веществ в реакции
СН4 (г) +2Н2S(г) → CS2(г),+ 4H2(г)
были равны 0,3моль/л СН4 и 0,5моль/л Н2S. Найдите концентрации этих веществ в тот момент, когда образовалось 0,16 моль/л Н2. Как изменилась при этом скорость реакции?
Решение. По закону действия масс скорость данной реакции описывается уравнением:
![]()
Начальная скорость реакции равна:
![]() ,
,
где - константа скорости реакции, не зависящая от концентраций ее участников.
В начальный момент времени продукты реакции отсутствовали, т.е.начальные концентрации CS2 и H2 были равны 0. Расчет по уравнению реакции:
х у 0,16моль
СН4 (г) +2Н2S(г) → CS2(г),+ 4H2(г)
1моль 2моль 4моль
дает, что на образование 0,16 моль Н2 должно расходоваться
![]() и
и
![]()
![]()
Поэтому
к тому моменту, когда в системе образуется
0,16моль Н2,
концентрации исходных веществ уменьшатся
и составят:
![]()
и
![]()
Соответственно, скорость реакции к этому моменту также уменьшится и будет равна:
![]()
Отношение
![]() ,
т.е. скорость реакции уменьшится в 1,6
раза.
,
т.е. скорость реакции уменьшится в 1,6
раза.
