
Свойства белков
Взаимодействие белков с лигандами
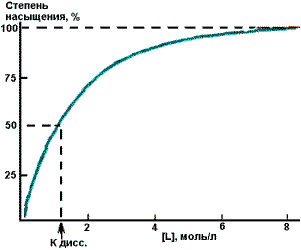
Насыщение белка лигандом
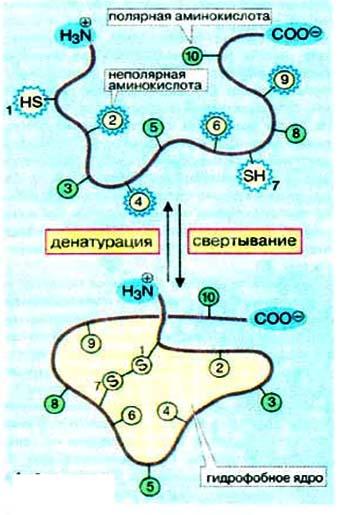
Денатурация -- Разрыв слабых связей в белке и разрушение трехмерной структуры молекулы
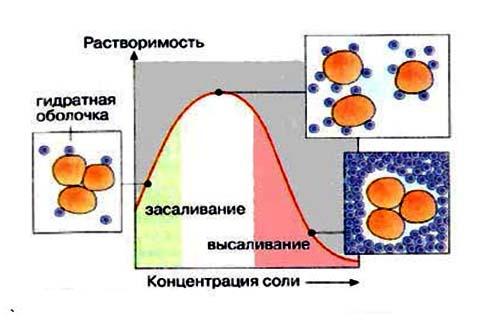
Высаливание
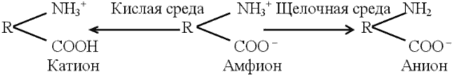
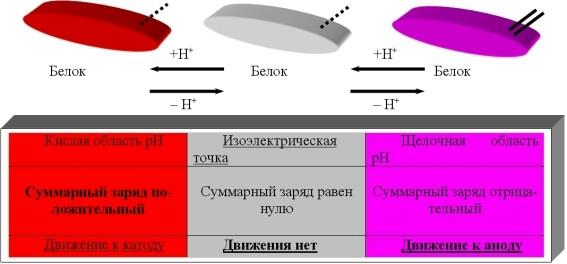
Изменение суммарного заряда молекул в соответствии с рН
Гидролиз кислотный, щелочной, ферментативный
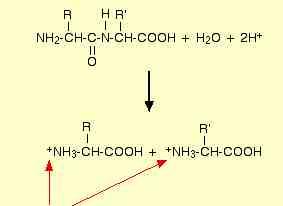
Формирование положительно зараженных аминокислот при кислотном гидролизе
Белки – это коллоиды
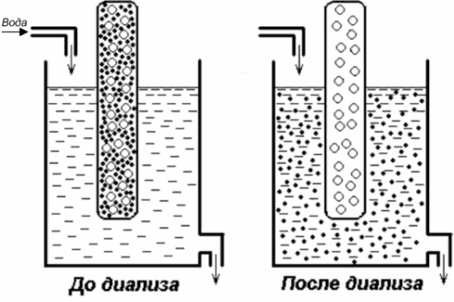 Диализ – очистка
белковых растворов от
низкомолекулярных соединений
Диализ – очистка
белковых растворов от
низкомолекулярных соединений
Размер белковых молекул лежит в пределах 1 мкм до 1 нм и, следовательно, они являются коллоиднымичастицами, которые в воде образуют коллоидные растворы. Эти рас-творы характеризуются высокой вязкостью, способностью рассеивать лучи видимого света, не проходят сквозь полу-проницаемые мембраны.
Кривая насыщения кислородом миоглобина и гемоглобина

Методы обнаружения, идентификации белков и оценки их аминокислотного состава
Химические методы. Качественные и количественные реакции на аминокислоты и белки
Физико-химические методы:
Электрофорез;
Хроматография;
Спектрометрия;
Иммуноферментные методы (ИФА)
Исследование белкового обмена
Общий белок крови и мочи
Альбумин сыворотки крови
Белковый спектр сыворотки или плазмы крови
Тимоловая проба
Остаточный азот сыворотке крови и моче :
Мочевина
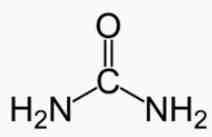
Креатинин
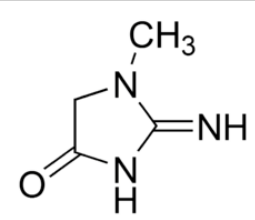
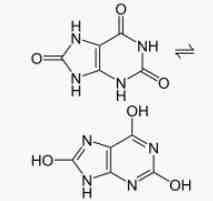
Мочевая кислота
Аммиак
Оксид азота
Ферменты
от лат. fermentum – брожение или закваска от греч. enzyme – внутри закваски
Ферменты – это органические вещества белковой природы, которые синтезируются в клетках и во много раз ускоряют протекающие в них реакции, не подвергаясь при этом химическим превращениям.
Практически все биохимические реакции катализируются ферментами.
Свойства ферментов
Все ферменты – это белки и свойства белков являются свойствами ферментов.
Кроме того, ферменты имеют уникальные свойства:
высокую эффективность действия;
специфичность действия;
способность к регуляции.
изменением эффективности в соответствии с условиями среды, т.е. скорость ферментативных реакций существенно зависит от температуры и рН.
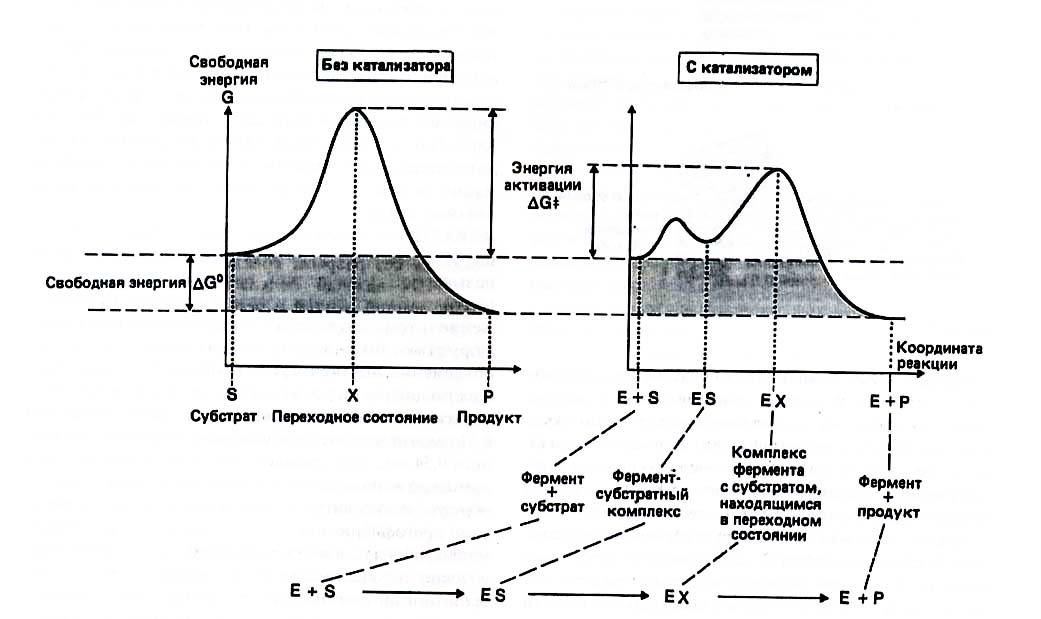
Зависимость скорости ферментативных реакций от рН
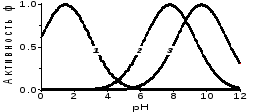
1 — пепсин ё 2 — рибонуклеаза 3 — аргиназа
Единица скорости ферментативной реакции - 1 МЕ (международная единица). Это такое количество фермента, которое катализирует превращение 1 мкМ субстрата в продукт за 1 минуту в оптимальных условиях.
Строение ферментов

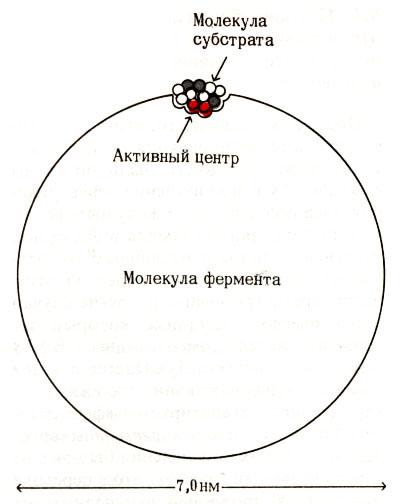 Относительные
размеры фермента
и субстрата
Относительные
размеры фермента
и субстрата
Простой фермент имеет только белковую часть.
Сложный фермент (Холофермент ) = Апофермент + кофермент или кофактор
(белок) (небелковая часть)
Кофактор сидит в ферменте.
Кофермент циркулирует от одного фермента к другому.
Ферменты и их кофакторы
|
Ферменты |
Ион металла |
|
Цитохромоксидаза, каталаза, пероксидаза |
Fe2+ Fe3+ |
|
Алкогольгидрогенеза, DNA – полимераза |
Zn2+ |
|
Гексокиназа, глюкоза – 6 – фосфатаза |
Mg2+ |
|
Уреаза |
Ni2+ |
|
Нитратредуктаза |
Mo |
|
Глутатионпероксидаза |
Se |
