
- •Лекция 1. Современное состояние грунтоведения
- •Лекции 2 и 3. Твердая компонента грунтов
- •Лекции 4 и 5. Жидкая компонента грунтов
- •Лекция 6. Газовая и биологическая компонента грунтов
- •Лекция 7 и 8. Строение грунтов
- •Лекция 9. Физические свойства грунтов
- •Лекции 10 и 11. Деформационные свойства грунтов
- •Лекции 12 и 13. Прочностные свойства грунтов
- •Лекция 14. Реологические свойства грунтов
- •Заключение
- •Учебно-методический комплекс
- •1. Цели и задачи изучения дисциплины
- •2. Требования к уровню освоения дисциплины
- •3. Объем дисциплины
- •3.1. Объем дисциплины и виды учебной работы
- •3.2. Распределение часов по темам и видам учебной работы
- •4. Содержание курса
- •5. Лабораторные работы (лабораторный практикум)
- •6. Тематика рефератов и методические указания по их выполнению
- •7.1. Литература
- •7.3. Методические указания студентам
- •7.4. Методические рекомендации преподавателю

Лекции 2 и 3. Твердая компонента грунтов
План лекции:
1.Химические связи в грунтах.
2.Классификация минералов.
3.Класс 1. Сульфиды и металлические соединения.
4.Класс 2. Простые соли.
5.Класс 3. Первичные силикаты.
6.Класс 4. Глинистые минералы.
Прежде, чем перейти к изучению твердой компоненты грунтов сделаем два отступления.
Первое отступление.
Размерность твердой компоненты грунтов во многом определяет свойства грунтов (этот вопрос более подробно рассмотрим позже). В таблице 2.1 приведены качественно-количественные данные об элементах грунтов.
Таблица 2.1
Показатели |
Наименование слагающих элементов грунта |
|
|||
Кристалл |
Калоид-частица |
Слой |
|
Массив |
|
|
(молекула) |
грунтов |
|
грунтов |
|
|
|
|
|||
|
|
|
10-1 – 102 |
|
|
Размер, м |
10-10 – 10-8 |
10-6 – 10-3 |
|
102 – 104 |
|
Прочность |
Сверхвысокая |
Высокая |
Средняя |
|
Низкая |
Вид воды, |
Прочносвязанная |
Рыхлосвязанная |
Свободы min |
|
Свободы max |
преимущественно |
|
||||
|
|
|
|
|
|
Из таблицы видно, что вещество на уровне кристалла обладает максимальной прочностью, а массива грунтового минимальной. Поэтому, когда мы с Вами будем рассматривать строение грунтов, нужно обратить внимание на то, с каким элементом (размером грунта) мы имеем дело.
Второе отступление.
Каждый из вышеназванных элементов грунта – кристалл, калоид, слой грунтовой массы – имеет специфические структурные связи, которые во многом определяют прочностные и деформационные характеристики грунтов.
Рассмотрение твердой компоненты мы начнем с уровня кристалла. Для него характерны химические связи, которые рассмотрим ниже.
1. Химические связи в грунтах
Выделяют пять типов характеров связей (таблица 2.2). Таблица 2.2
Тип связей |
Энергия структуры, |
Энергия связи, эВ |
Характерные свойства тела |
|
ккал/моль |
|
|
Ковалентная |
170–290 |
3,1 |
Высокая твердость |
Ионная |
180–220 |
1,3 |
Высокая растворимость |
Металлическая |
25–100 |
0,1–0,5 |
Высокая электропроводимость |
Водородная |
3–12 |
0,13 |
Склонность к полимеризации |
Молекулярная |
1,8–2,4 |
0,01 |
Низкие точки плавления |
12
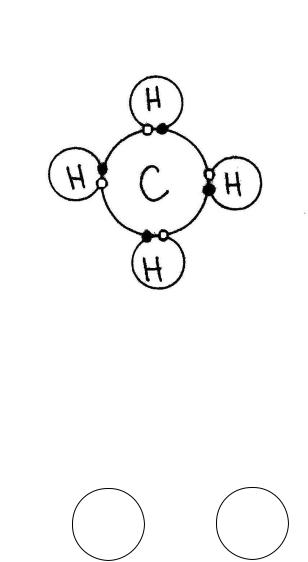
Ковалентной связью называют химическую связь, образующуюся за счет обобществления атомами своих валентных электронов. Например, молекула метана CH4, внешний энергетический уровень водорода (H) – 2 электрона, углерода (С) – 8 электронов (рисунок 2.1).
• – электроны водорода ο – электроны углерода
Рисунок 2.1 – Схема формирования ковалентной связи
Ковалентные связи очень прочные, они характерны для первичных силикатов.
Ионные связи образуются исключительно кулоновскими силами притяжения противоположено заряженных ионов: катионов и анионов.
+ → ← –
Na |
Cl |
Рисунок 2.2 – Схема ионной связи
Ионные связи характерны для многих солей: галоидов, сульфатов, карбонатов.
Металлические связи – это связи, обусловленные наличием не связанных с ядрами подвижных электронов.
Атомы металлов отличаются от атомов других элементов тем, что сравнительно слабо удерживают свои внешние электроны. Поэтому в кристаллической решетке металла эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. «Обобществленные» электроны передвигаются в пространстве между катионами и удерживают их на месте. Межатомные расстояния в металлах больше, чем в их соединениях с ковалентной связью. Такая связь существует не только в твердых кристаллах металлов, но и в расплавах и в аморфном состоянии. Она называется металлической.
13

Рисунок 2.3 – Схема металлической связи
Металлическая связь имеет признаки, характерные как для ковалентной, так и для ионной связей (таблица 2.3).
Таблица 2.3
Ковалентная связь |
Металлическая связь |
Ионная связь |
||
Образование |
связи за счет |
Образование связей одновременно |
||
общих электронов |
между большим числом частиц |
|||
Пара электронов, |
Электроны, образующие |
Взаимное притяжение |
Взаимное притяжение |
|
образующая связь, |
связь, в равной мере |
между катионами |
||
принадлежит двум |
принадлежат |
металлов и |
между катионами |
|
и анионами |
||||
связываемым атомам |
всем атомам |
электронным газом |
||
|
||||
Взаимное смещение |
Взаимное смещение катионов |
Взаимное смещение |
||
атомов (при ударе) |
катионов и анионов |
|||
(при ударе) не приводит |
||||
приводит к разрыву |
(при ударе) приводит |
|||
к разрыву связи |
||||
связи |
к разрыву связи |
|||
|
|
|||
Водородные связи представляют собой связь, где центральный атом водорода Н с одной стороны соединен ковалентной связью с электроотрицательным атомом (х), а с другой – образует дополнительную связь с атомом (у).
Х – Н … У
ковалентная связь |
водородная связь |
Молекулярные связи (силы Ван-дер-Ваальса). Основу Ван-дер-вааль- совских сил составляют кулоновские силы взаимодействия двух и более молекул.
молекулы
– + ↔ – +
Силы Ван-дер-ваальсовские
Силы Ван-дер-Ваальса – это весьма слабые связи.
14
2. Классификация минералов
При изучении грунтов важно знать, из каких минералов состоит грунт и как минералы влияют на свойства грунта.
По химическому составу выделяется десять классов грунтов. Но как было сказано выше, прочностные и деформационные свойства минералов определяются не только химическим составом, но и типом химических связей.
Используя в качестве классификационного признака преобладающий тип химической связи, минералы можно подразделить на следующие (таблица 2.4) классы:
1.Сульфидыи металлические соединения (металлическая связь, ковалентная);
2.Простые – соли (ионные связи);
3.Первичные – силикаты (ковалентные связи);
4.Глинистые минералы (ковалентные, водородная и молекулярная связи).
Таблица 2.4 – Классификация минералов
Класс |
Классификационный признак |
классы |
Преимущественный вид |
||
По химическому |
По типу |
||||
№ t |
химических связей |
||||
|
составу |
химической связи |
|
|
|
1. |
Самородные |
Сульфиды и металлические |
|
|
|
элементы |
|
|
|||
|
|
соединения – окислы |
I |
Металлическая |
|
2. |
Сульфиды |
||||
и гидроокислы |
|||||
|
Окислы |
|
|
||
3. |
(металлические) |
|
|
||
|
и гидроокислы |
|
|
|
|
4. |
Галоиды |
|
|
|
|
5. |
Карбонаты |
|
|
|
|
6. |
Сульфаты |
Простые соли |
II |
Ионная |
|
7. |
Вольфроматы |
||||
|
|
|
|||
8. |
Фосфаты |
(ионная) |
|
|
|
9. |
Бораты |
|
|
||
|
|
|
|||
|
|
Первичные силикаты |
III |
Ковалентная |
|
|
|
(ковалентные) |
|||
10. |
Силикаты |
|
|
||
Глинистые минералы |
|
Смашанные – |
|||
|
|
(смешанные: ковалентные, |
IV |
ковалентные, водородные, |
|
|
|
водородные, молекулярные) |
|
молекулярные |
|
Следует обратить внимание на то, что минералов с предельно выраженным каким-либо одним типом связи очень мало. В большинстве случаев находим в них промежуточное состояние между двумя, тремя и даже четырьмя видами связи. Причем наиболее слабый, остаточный (молекулярный) тип связей имеет место при любом сочетании основных типов связей.
Ниже рассмотрим классы минералов. С позиции инженерной геологии наибольший интерес представляют минералы, входящие в группу главных породообразующих.
В природе известно более трех с половиной тысяч породообразующих минералов, из них около ста наиболее часто встречаются в грунтах, а из этих ста минералов силикаты составляют 75–80 % веса земной коры, а вместе с кварцем SiO2 на долю соединений кремния приходится до 90 % веса земной коры.
Поэтому более детально рассмотрим класс силикатов. Для остальных классов дадим общую характеристику.
15
3. Класс 1. Сульфиды и металлические соединения
В этот класс входит один из главнейших породообразующих минералов – кварц (SiO2). Некоторые авторы относят кварц к силикатам, другие к окислам (Г.Д. Ажгирей). Мною принята последняя версия.
Другие минералы имеют подчиненное значение, и для нас, с позиции инженерной геологии, интереса не представляют (таблица 2.5).
Таблица 2.5
Наименование минералов |
|
Твердость |
|
Содержание в земной коре, % |
||
|
Золото – Аu |
|
3 |
|
Следы |
|
|
Алмазы – С |
|
10 |
|
Следы |
|
|
Пирит – FeS2 |
|
6,5 |
|
Следы |
|
|
Кварц – SiO2 |
|
7,0 |
|
12,0 |
|
Характеристика кварца: |
|
|
0 |
|
||
1. |
Состоит из тетраэдров, имеет жесткую |
|
||||
|
|
|||||
|
каркасную структуру. Поэтому |
|
Si |
|||
|
изоморфным замещениям мало подвержен. |
0 0 |
||||
2. |
Имеет высокую прочность; |
• |
||||
3. |
Имеет низкую растворимость; |
|
|
|||
4. |
Выветриванию мало подвержен. |
0 |
0 |
|||
4. Класс 2. Простые соли
Минералы, входящие в этот класс, с позиций породообразующих представляют для нас небольшой интерес, т. к. их содержание в земной коре незначительно (таблица 2.6).
Таблица 2.6
Наименование минерала |
Растворимость, моль/л |
Содержание в земной коре |
Галит – NaCl |
6,19 |
≈ 0,1 |
Сильвинит – KCl |
4,65 |
Следы |
Ангидрид – CaSO4 |
0,013 |
≈ 0,01 |
Гипс – CaSO4•2H2О |
0,008 |
≈ 0,01 |
Кальцит – CaCO3 |
0,00012 |
≈ 0,01 |
Доломит – CaMg (CO3)2 |
0,000035 |
≈ 0,01 |
Однако, с позиции их специфических свойств (достаточно высокая растворимость), приводящих к образованию карстовых процессов, которые, в свою очередь, могут привести к снижению устойчивости инженерных сооружений, данные минералы все же требуют особого внимания при их изучении.
5. Класс 3. Первичные силикаты
Класс силикатов по типу химических связей был нами разделен на два класса: первичные силикаты и глинистые минералы.
Термин первичные силикаты обусловлен тем, что минералы этого класса являются главными породообразующими минералами магматических пород.
16
Термин глинистые минералы обусловлен тем, что в процессах физического, химического и биологического выветривания магматических пород первичные силикаты преобразовались и появились новые, вторичные минералы.
Содержание силикатов в земной коре приведено в таблице 2.7. Таблица 2.7
Наименование класса |
Главные породообразующие минералы |
Содержание |
|
в земной коре, % |
|||
|
Полевые шпаты |
|
|
Первичные силикаты |
Пироксены |
50 |
|
|
Кварц |
|
|
Глинистые минералы |
Каолинит |
|
|
Монтмориллонит |
40 |
||
(вторичные силикаты) |
|||
Гидрослюда |
|
||
|
|
||
Другие (класс 2 и ?) |
– |
10 |
Первичные силикаты Характеристика первичных силикатов.
1.Имеют высокую прочность;
2.Имеют низкие значения деформируемости;
3.Слабо подвержены выветриванию;
4.Состоят из тетраэдров и октаэдров.
Представляют большой интерес инженеров-геологов, как основной материал грунта.
6. Класс 4. Глинистые минералы
Особенностью этого класса минералов является то, что даже при небольшом добавлении этих минералов в грунт, резко меняются свойства грунта. Поэтому данный класс нам очень интересен.
Строение глинистых минералов.
a)Тетраэдр и октаэдр;
b)Сетки тетраэдные и октаэдреные;
c)Структурный слой.
а) Тетраэдр состоит из кремния (Si) и кислорода (О)
0
Si
•(SiO4)-4 – тетраэдр
0 |
0 |
Октаэдры состоят из атомов алюминия (Al), магния (Mg), железа (Fe) и атомов кислорода (О) или гидроксильной группы (ОН).
17
Al |
– октаэдр |
|
|
б) Сетки тетраэдра и октаэдра |
|||
|
0 |
0 |
0 |
|
|
|
Si |
Si |
• |
Si |
– сетка тетраэдра |
|
• |
• |
|
|
|
0 |
0 |
|
0 |
0 |
|
|
Al |
Al |
Al |
|
– сетка октаэдра |
|
|
|
|
|
|
|
|
в) Слой структурный |
|
|
|
|
сетка тетраэдра |
слой |
|
||
структурный |
|
сетка октаэдра |
|
|
|
|
|
|
|
|
|
18
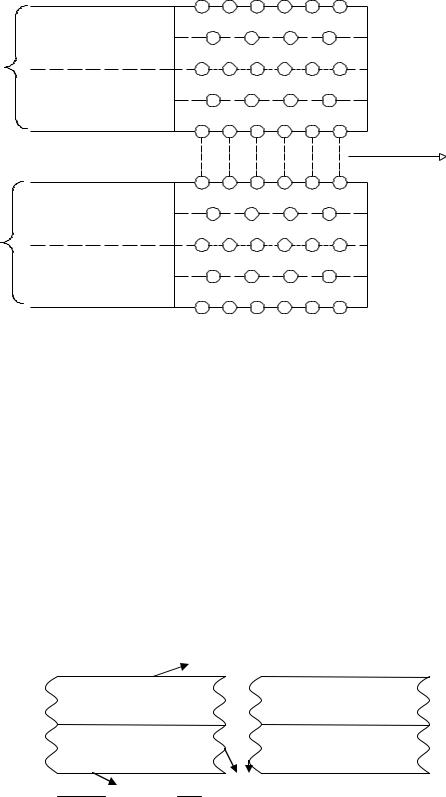
Строение минералов грунта. Каолинит (Al2 O3 • 2SiO2 • 2H2 O)
Структура каолинита – 2 сетки, октаэдрическая и тетраэдрическая.
Структурный слой
Структурный слой
|
6 O |
|
|
|
Тетраэдрическая |
4Si |
|
|
|
сетка |
2(OH)+4O |
|
||
Октоэдрическая |
|
|||
4Al |
|
|
||
сетка |
|
|
||
6 OH |
|
|
||
|
|
|
||
|
+ 1. Водородные |
|||
|
– |
|
химические связи |
|
|
6 O |
2. |
Молекулярная |
|
Тетраэдрическая |
4Si |
|||
|
|
|||
сетка |
2(OH)+4O |
|
||
Октоэдрическая |
|
|||
4Al |
|
|
||
сетка |
|
|
||
6 OH |
|
|
||
|
|
|
||
Характеристика каолинита
Каолинит образуется при выветривании гранатов, которые состоят из кварца – 20 %, полевых шпатов (плагиоклазов) – 50 %, биотитов – 10 % и 20 % других минералов. Полевой шпат представлен натриево-кольцеватыми плагиоклазами Na[AlSi3O8]. Натрий не может заместить Al и Si.
Поскольку изоморфного замещения в тетраэдрических и октаэдрических сетках не происходит, поверхности сеток электронейтральные. Энергией облада-
ют лишь поверхности краевых участков кристалла в |
местах разрыва связей |
Si – O – Si, OH – Al – OH. |
|
Структурные слои связанны между собой |
водородными связями |
(О – Н…О) и молекулярными.
Водородная связь достаточно жесткая, поэтому внутренняя поверхность кристалла не принимает участия в обменных реакциях.
S внеш.
S внутр. |
Sk поверхность краевых участков кристалла |
Рисунок 2.4 – Схема формирования активных поверхностей в каолините
19
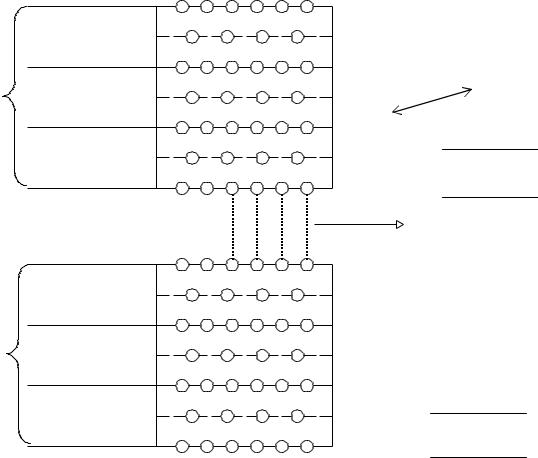
Для количественной оценки активных площадей произведен простейший расчет.
Исходные данные:
a)1 см 3 грунта (без пор, трещин и т.д.);
b)Мощность структурного слоя 10 Å (10-9 м). Результат приведен в таблица 2.8.
Таблица 2.8
Наименование |
Численные значения |
Площадь краевых участков |
2 • 10-4 |
Площадь внешних поверхностей |
4 • 10-4 |
Площадь внутренней поверхности |
2 • 103 |
Площадь активной зоны каолинита составляет 2 · 10–4 м, поэтому он обладает низкой абсорбционной способностью и набуханием.
Строение минералов грунта. Монтмориллонит (SiO2 – 67 %, Al2 O3 – 28 %, H2 O ≈ 5 %)
Структура монтмориллонита – 2 тетраэдрических и 1 октаэдрическая сетка.
Структурный слой
Структурный слой
|
O |
|
|
Тетраэдрическая |
Si |
|
|
сетка |
OH+O |
|
|
Октоэдрическая |
Mg |
||
Al |
|||
|
|||
сетка |
|
||
OH+O |
|
||
|
|
||
Тетраэдрическая |
Si |
Изоморфные |
|
сетка |
|||
|
|||
|
O |
замещения |
|
|
|
Слабые |
|
|
|
молекулярные |
|
|
O |
связи |
|
|
|
||
Тетраэдрическая |
Si |
|
|
сетка |
OH+O |
|
|
Октоэдрическая |
|
||
Al |
|
||
сетка |
|
||
OH+O |
|
||
|
|
||
Тетраэдрическая |
Si |
|
|
сетка |
Изоморфные |
||
O |
|||
|
замещения |
Характеристика монтмориллонита
Монтмориллонит образуется при выветривании пироксенов Mg, Ca, Fe [Si2O6].
20
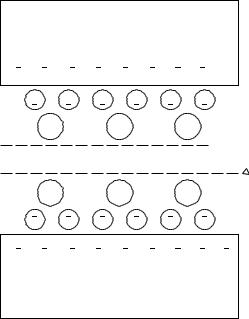
Для монтмориллонита характерны изоморфные замещения в октаэдрической сетке. В результате этих изоморфных замещений на поверхностях структурных слоев появляются некомпенсированный отрицательный заряд, равный 0,66 эв. Этот заряд компенсируется молекулами воды и обменными катионами Na.
Связь между структурными слоями слабая молекулярная, поэтому структурные слои могут раздвигаться при поступлении воды и обменных катионов.
В работе участвуют внутренние поверхности структурных слоев, поэтому активные площади у монтмориллонита значительные.
Вследствие этого монтмориллонит обладает высокой сорбционной способностью набухаемостью.
Структурный слой 
Связь между слоями очень  слабая
слабая
молекулярная
Структурный слой 
+ + + + + +
Na Na Na
|
Na |
Na |
|
|
Na |
+ |
+ |
+ |
+ |
+ |
+ |
Некомпенсированный 
 отрицательный
отрицательный
заряд


 нейтральный
нейтральный  заряд
заряд
 Обменные катионы
Обменные катионы  Молекулы воды
Молекулы воды
Рисунок 2.5 – Схема химической связи в монтмориллоните
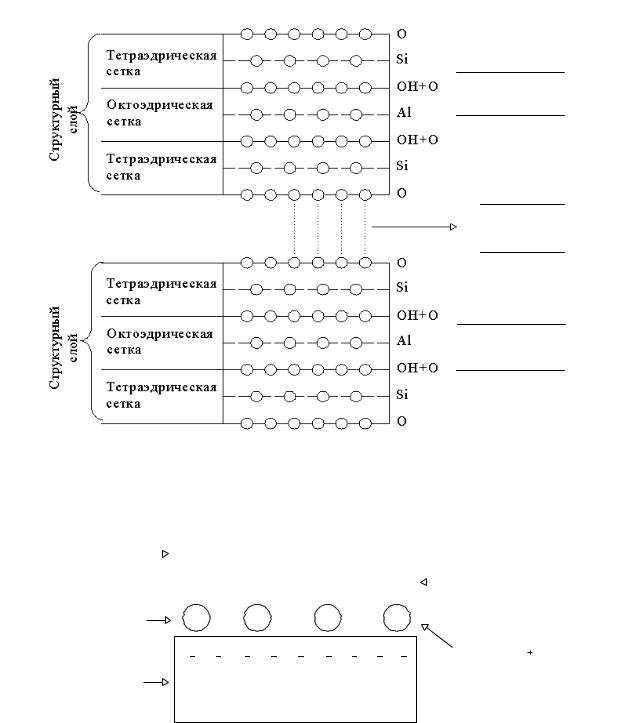
Строение минералов грунта. Гидрослюды
Структура гидрослюд – 2 тетраэдрических сетки, 1 октаэдрическая сетка.
21
Изоморфные
замещения
Ионная
связь
Изоморфные
замещения
Гидрослюды образуются при выветривании полевых шпатов к [AlSi3O8]. Поэтому в химическом растворе есть катионы калия.
Структурный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
слой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Некомпенсированный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
отрицательный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
заряд |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Ионная связь |
K |
K |
K |
K |
|
|
|
|
Необменные |
|
|
|
|
катионы К |
Структурный |
|
|
|
|
слой |
|
|
|
|
Рисунок 2.6 – Схема ионной химической связи в гидрослюдах
Для гидрослюд характерны значительные изоморфные замещения в тетраэдрических и октоэдрических сетках. В тетраэдрических сетках каждый шестой атом Si+4 замещается на Al+3, а в октоэдрических Al+3 на Mg+2 и Fe+2. В результате этих изоморфных замещений на поверхности структурных слоев появляется некомпенсированный отрицательный заряд, равный 1,3 эв. Этот заряд компенсируется необменным катионом К, который находится в химическом растворе.
Связь между структурными слоями жесткая, поэтому внутренние поверхности структурных слоев не участвуют в химических реакциях.
22
Активными поверхностями являются внешние поверхности кристалла и поверхности разрыва. Поэтому по величине адсорбционной способности и набухаемости гидрослюды принимают промежуточное значение между каолинитами и монтмориллонитами.
Рассмотрев глинистые минералы с позиций инженерной геологии можно сделать следующие выводы:
1. Наибольшей площадью с активной поверхностью обладают минералы монтмориллонита, наименьшей – каолинита. Промежуточное значение имеют
гидрослюды. |
Соотношение |
активных |
площадей |
следующее: |
Sмонтмориллонита = 2000 м2 в пересчете |
на 1 см3 кристалла, Sгидрослюд = 4 • 10-10м2 и |
|||
Sкаолинита = 2 • 10-4 м2. |
|
|
|
|
2. Величина (площадь) активных поверхностей определяет свойства глинистых минералов. Так, для монтмориллонита характерны высокие значения адсорбции и набухаемости. Для каолинита значения этих показателей минимальные. Гидрослюды имеют промежуточные значения показателей свойств минералов.
Заключение по твердой компоненте грунтов
1.В земной коре содержание силикатов составляет 75 %, а в осадочных породах – до 90 %.
2.Силикаты, за исключением глинистых минералов, характеризуются:
отсутствием заряда на поверхности;
высокой прочностью;
низкой растворимостью.
3.Глинистые минералы характеризуются:
наличием заряда на поверхности кристаллов;
низкой прочностью;
высокими значениями набухаемости и адсорбционной способностью.
4.Класс простых солей, хотя содержание минералов этого класса в земной коре незначительно, играет огромную роль в инженерной геологии. Это связано, прежде всего, с высокой растворяемостью солей и как результат – процессами карстообразования.
23
