- •Глава 4. Физико-химическая механика в
- •4.1. Основные положения
- •4.2. Структуры дисперсных материалов и эффект Ребиндера
- •4.3. Поверхностно-активные вещества
- •4.4. Механизмы и кинетика действия поверхностно активных веществ
- •Влияние концентрации пав на вязкость суспензии
- •4.5. Влияние пав и подогрева на распылительную сушку
Влияние концентрации пав на вязкость суспензии
|
ПАВ, % |
Вязкость, Пас |
|
0 |
0,137 |
|
0,10 |
0,113 |
|
0,25 |
0,090 |
|
0,50 |
0,083 |
|
0,80 |
0,080 |
|
1,00 |
0,078 |
|
1,20 |
0,076 |
|
1,40 |
0,079 |
Видно, что при использовании ПАВ без изменения влагосодержания вязкость снизилась почти в два раза.
Хорошими разжижающими способностями обладают электролиты. С коллоидно-химической стороны процесс дефлокуляции тонкодисперсных систем состоит в обмене двухвалентных катионов сольватного слоя на одновалентные, в значительном увеличении при этом электрокинетического потенциала, что является причиной высвобождения связанной воды. Чем больше обменных катионов, тем больше требуется электролита-разжижителя, но до определенного предела (рис. 22). Вязкость при этом становится минимальной. Дальнейшее увеличение электролита (при неизменном количестве воды) вызывает понижение потенциала из-за увеличения диффузионного слоя; происходит сближение частиц и вязкость системы возрастает. Вязкость проходит через минимум, при котором определяется оптимальная концентрация электролита. На разжижение влияет также и анионная часть электролита. Концентрация электролита влияет и на другие химические показатели суспензии (рис. 23): рН увеличивается, т. е. среда приобретает щелочной характер, – потенциал изменяется противоположно вязкости, при этом оба показателя хорошо коррелируют.
|
| |
|
Рис. 22. Характер разжижения суспензии электролитами |
Рис. 23. Кинетика изменения электрохимических свойств суспензий от содержания катионов натрия
|
Регулирование рН является эффективным методом разжижения и стабилизации водных систем. При химическом взаимодействии поверхности частиц с водой часть образующихся продуктов реакции переходит в дисперсионную среду, изменяя рН. На этот процесс существенно влияет введение электролитов, рН суспензий ZrO2 и ТiO2 без добавок 6–7 (нейтральные); для SiO2 – 4–5 (кислые); Аl2O3 – 9 (слабоосновные); МgО – 11 (основные).
Определенные значения рН характерны и для других оксидов, хотя они и считаются практически нерастворимыми. Растворенные частицы становятся заряженными ионами, а молекулы воды поляризуются. Адсорбция соответствующих ионов на поверхности суспензированных частиц создает заряд и изменяет рН. В результате изменения рН можно наблюдать две области максимального разжижения и противоположных значений -потенциала (рис. 24).


Рис. 24. Влияние рН на разжижение суспензий:
а – кислые суспензии; б – основные
В промежуточной области, где происходит перезарядка частиц, значение снижается, а вязкость возрастает. При этом условно кислые материалы лучше разжижаются при добавке щелочи (например, KаОН), а основные – при добавке кислоты (например, НСl).
|
На
рис. 25 видно наличие двух интервалов
рН
с
удовлетворительными свойствами, так
называемых литейных
интервалов. В
кислой среде создаются наиболее
благоприятные условия, так как литейный
интервал шире, а значение вязкости
при той же влажности несколько ниже.
Дефлокулянты снижают вязкость литейных
шликеров (рис. 26). рН | |
|
Рис. 25. Изменение вязкости кислых и основных суспензий в зависимости от рН и влажности
|
Рис. 26. Снижение вязкости литейных шликеров за счет дефлокулянтов |
В нейтральной среде суспензия резко загустевает, даже при повышенном значении влажности литье почти невозможно. Суспензии на основе Аl2O3 удовлетворительно дефлокулируют при значениях рН 3–4 и 9–10.
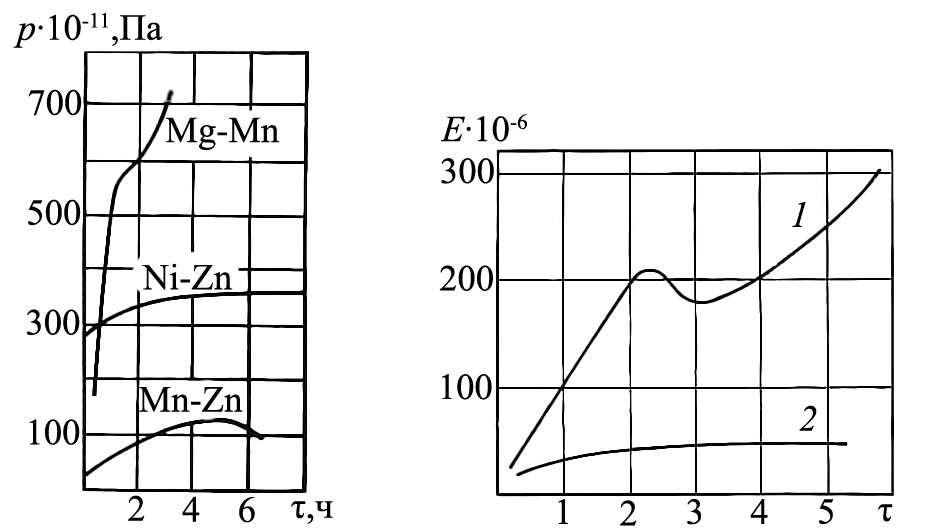
Стабилизация суспензии. В технологических процессах важна временная стабильность дисперсий. Это в первую очередь относится к реологическим характеристикам. Изучение структурообразования суспензий шихт ферритовых порошков разных химических составов показывает, что поведение их во времени различно (рис. 27). Марганец-цинковые (марка 2000 НМ) и никель-цинковые (марка 600 НН) композиции после незначительного тиксотропного упрочнения в течение 1–2 ч стабилизируют свои структурные характеристики. Совершенно другая картина наблюдается у магнийсодержащих ферритов (2,1 ВТ).
|
|
|
Рис. 27. Кинетика структурообразования суспензий ферритовых материалов |
Из-за некоторой растворимости оксида в воде (0,007 г/л) наблюдается склонность суспензий к загустению. Исследование кинетики этого процесса показало, что через 5–6 ч после приготовления суспензия становится непригодной для распыления (рис. 28), о чем можно судить по возрастающему модулю деформации Е. Молекулы МgО, находящиеся в растворе, взаимодействуют с водой и образуют довольно прочные связи между твердыми частицами в виде цепей ОН–Мg–О–(МgО)n–Мg–ОН.
|
|
|
Рис. 28. Кинетика структурообразования суспензии MgO: кривая 1 – без ПАВ; кривая 2 – в присутствии 1%-ой лимонной кислоты
|
Со временем эти цепи создают пространственный каркас и переходят в конденсационно-кристаллизационные структуры, проявляя вяжущие свойства МgО. Для предотвращения явления необходимо ограничение роста цепей и их взаимодействия. Это было достигнуто с помощью введения в состав суспензии 0,5–1,0% лимонной кислоты С3Н5О(СООН)3, которая вступает в химическое взаимодействие с гидратированной поверхностью частиц МgО и его молекулами, находящимися в растворе.
Константа диссоциации лимонной кислоты мала, поэтому реакция протекает медленно. Образующиеся продукты реакции блокируют поверхности частиц МgО и стабильность свойств системы возрастает (рис. 28, кривая 2), т. е. суспензия становится текучей и стабильной. Аналогичный эффект дает соляная кислота, но так как это сильная кислота, то время стабильного существования суспензии мало и неприемлемо для производственных условий.
Некоторые органические соединения с сильной полярной группой и цепочкой углеводородных атомов не адсорбируются на поверхности твердой фазы, а размещаются на поверхности раздела жидкой фазы с воздухом. Тогда в дисперсных системах происходит крайне нежелательное для технологии явление дестабилизации суспензий – пенообразование. Это результат того, что понижение поверхностной энергии на указанной границе больше, чем на границе раздела жидкость – твердое тело. Такое явление может иметь место, например, у поливинилового спирта при мокром смешении, измельчении и т. п., а также у некоторых ПАВ-диспергаторов. Пенистая суспензия имеет в два и более раз меньшую плотность, что ухудшает технологичность получаемых из нее пресс-порошков. Разрушить пену можно введением ПАВ-декомпенсатора (пеногасителя), например октилового спирта, сивушного масла и т. п. Октиловый спирт СН3(СН2)6СН2ОН, не растворяясь в воде, адсорбируется на границе жидкость – воздух, вытесняет пенообразователь внутрь раствора, значительно понижая при этом прочность пленок пузырьков воздуха. Они лопаются и происходит пеногашение (концентрация пеногасителя 0,05%).