
- •51. Схема проведения, достоинства и недостатки рентгено-абсорбционного анализа.
- •52. Физические основы молекулярной спектроскопии поглощения уф- и видимого диапазона.
- •53. Вид и основные характеристики молекулярных спектров поглощения уф- и видимого диапазона.
- •57. Основные положения количественного фотометрического анализа.
- •60. Метод Фирордта.
- •62. Физические основы ик-спектроскопии. Типы колебаний в молекулах.
- •63.Типичный вид ик - спектра сложного органического вещества. Основные характеристики ик - спектров.
- •64.Подготовка образцов в ик - спектроскопии.
- •65.Особенности конструкции ик - спектрометров.
- •66. Порядок идентификации веществ по их ик- спектрам.
- •67.Использование ик-спектроскопии для определения молекулярной структуры неизвестного вещества.
- •68.Исп. Ик-спектроскопии для колич. Анализа, анализа смеси вещ-в.
- •69.Физические основы люминесцентного метода. Виды люминесценции и способы ее возбуждения.
- •70. Схема возбуждения и эмиссии люминесцентного излучения.
- •71. Взаимосвязь спектров поглощ. И люминесценции. Правило Стокса, з-н Стокса-Ломмеля.
- •72. Квантовый и энергетический выход люминесценции. Закон Вавилова.
- •73. Вид спектров люминесценции и их основные характеристики.
- •74. Зависимость интенсивности люминесценции от конц. Люминесцируемого вещества, температуры, рН, примесей.
- •Iфл Iфл Iфл
- •75.Прямой и косвенный флуоресцентный анализ.
- •76.Аппаратура и практическое применение люминесцентного анализа.
51. Схема проведения, достоинства и недостатки рентгено-абсорбционного анализа.
Анализ по спектрам поглощения рентгеновского излучения.





















1 2 3 4 5
Анализируемая проба 2 в виде плоскопараллельной пластинки устанавливается на пути потока рентгеновского излучения от источника 1(рентгеновская трубка или радиоактивный источник) с непрерывным или линейчатым спектром, кванты которого имеют большую энергию, чем энергия краёв поглощения элементов, определяемых в пробе.
Излучение, прошедшее через образец, разлагается в спектр анализатором 3. Из разложенного в спектр излучения выбираются аналитические линии определяемого элемента, которые попадают на приемник излучения 4 и далее регистрируется электрической схемой 5.
Для определения концентрации каждого элемента интенсивность их спектральных линий измеряется дважды: до введения пробы в поток излучения источника и с пробой. Затем определяется оптическая плотность, по которой при соответствующей калибровке прибора (по эталонам) определяется искомая концентрация.
Этап атомизации пробы отсутствует.
52. Физические основы молекулярной спектроскопии поглощения уф- и видимого диапазона.
Метод является методом молекулярной абсорбционной спектроскопии, в основе которой лежит изменение электронно-колебательно-вращательного состояния вещ-ва. При пропускании через вещ-во, находящееся в молекулярном состоянии, эми УФ- и видимого диапазона, часть этого излучения может поглощаться в-вом. Хар-р этого поглощения отличается от поглощения света атомизированным в-вом. Атомы каждого элемента способны поглощать излучение с длинами волн, имеющими определенное значение. Спектр АА и АЭ имеет вид узких спектральных линий. Это связано с тем, что для атомов каждого элемента имеются свои строго определенные дискретные значения энергии валентных электронов в осн. состоянии и в состояниях возбуждения, в к-рые эти электроны переходят при поглощении излучения.
При образовании молекул из атомов внешние атомные орбитали перестраиваются, изменяются их энергетические уровни, образуются молекулярные орбитали. При этом считается, что внутренние электроны атомов и внешние электроны, не участвующие в образовании связей, сохраняют ту же энергию, что и в индивидуальном атоме.
В органических соединениях различают два типа электронов, ответственных за поглощение видимого и УФ-излучения: - непосредственно участвующие в образовании связи, таким образом связанные более чем с одним атомом; - несвязывающие внешние электроны, локализованные большей частью у атомов таких элементов как кислород, галогены, сера.
В зависимости от хар-ра исходных атомных орбиталей, могут образовываться молекулярные орбитали π- и σ-типа. σ-Связями называются связи, которые имеют цилиндрическую симметрию относительно линии, соединяющей атомы. π-Связи – это связи, симметричные относительно плоскости, проходящей ч/з линию, соединяющую центры атомов.
При
отсутствии внешнего воздействия максимум
электронной плотности в π- и σ-связях
находится м-ду ядрами, стягивая их. Такие
орбитали - связывающие.
Атомные
орбитали, не принимающие участие в
образовании связей, т.е. орбитали
п-электронов - несвязывающие
n-орбиталями.
При
некоторых условиях конфигурация
молекулярных орбиталей может измениться
- максимум электронной плотности
сместится к наружной стороне ядер,
увеличивая отталкивание между ними.
Образуются разрыхляющие
орбитали.
При поглощении ЭМИ УФ– и видимого диапазона могут происходить электронные переходы со связывающих π- и σ-орбиталей и несвязывающих n-орбиталей на разрыхляющие π*- и σ*-орбитали. σ-σ* переход может произойти при поглощении вещ-вом излучения с относительно высокой (в пределах рассматриваемого диапазона) энергией.
Электронные переходы с π- орбитали на π*- орбиталь происходит при поглощении меньшей, но достаточно большой энергии, и соответствующие спектральные линии наблюдаются в области среднего УФ. n- π* и n- σ* переходы могут происходить при поглощении еще меньших квантов и наблюдаться в области ближнего УФ.
Е

σ*-орбиталь


π*- орбиталь
n-
σ* n-
π*
n- орбиталь
π-
π* π- орбиталь
σ-σ σ-орбиталь

Вид типичных спектров поглощения в УФ- и видимых областях представлены ниже. D- оптическая плотность; Т- пропускание;
Поскольку
поглощаемая энергия приводит к изменению
не только электронного, но и колебательного
и вращательного состояния молекул,
наблюдаемые спектры поглощения
представляют собой широкие полосы с
одним или несколькими максимумами в
непрерывной области поглощения либо
несколькими максимумами в различных
областях, разделенных областями
пропускания. Полосы поглощения в
электронном спектре хар-ся длиной волны
и интенсивностью, измеряемыми в максимуме.
Положение полосы на шкале длин волн
определяется разностью энергий состояний,
м-ду которыми происходит переход.
Интенсивность полосы поглощения
оценивается вероятностью такого
перехода. Преимущество использования
молярного коэффициента как меры
интенсивности поглощения состоит в
том, что интенсивность относится к
одному и тому же числу поглощающих
частиц.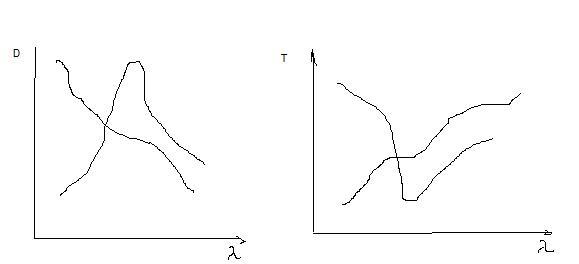
Многочисленные опыты показали, что характерные полосы поглощения наблюдаются в определенной области. Такие структурные фрагменты молекулы ковалентно ненасыщенные группировки атомов, обусловливающие электронное поглощение, например, С=С, С=О, называют хромофорами. Атомы или группы атомов, присоединение которых к хромофорной с-ме приводит как к смещению характерной для хромофора полосы, так и к изменению поглощения, называют оксохромами. Полоса поглощения хромофорной группы может сместиться не только в зависимости от внутримолекулярного окружения, но и от растворителя.
