
- •2.Сравнительная характеристика комбинированного позитивного и «тентинг» методов производства пп. Технологические характеристики, возможности методов.
- •5.Методы производства пп: фотоаддитивная технология, лазерные технологии. Технологические характеристики, возможности метода.
- •7.Способы изготовления мпп: метод «пафос». Технологические характеристики, возможности метода.
- •10,Способы создания защитного рельефа. Трафаретная печать. Трафаретные печатные формы, трафаретные краски, способы их сушки.
- •13,Материалы для изготовления пп: медная фольга, стеклотекстолит, полиимидные смолы, фольгированные материалы. Получение стеклотекстолита с введенным катализатором (аддитивная технология).
- •19,Классическая активация поверхности. Стадии, назначение. Способы активирования поверхности. Составы растворов.
- •21,Беспалладиевая активация. Основные параметры. Технологические возможности методов.
- •25,Травильные растворы на основе н2о2, (nh4)2s2o8, их сравнительная характеристика, способы утилизации.
21,Беспалладиевая активация. Основные параметры. Технологические возможности методов.
Беспалладиевая активация применяется: с целью уменьшения себестоимости - исключение благородны Ме. Коллоидные беспалладиевые активурующие растворы с рН=4-9, содержащие растворы сульфатов, нитратов, галогенидов, ацетатов Co, Ni, Cu, NН4OН или NаОН. Дополнительно вводят: стабилизирующие лиганды (лимонная кислота), вторичные коллоиды (гуммиарабик, желатина, агар-агар, крахмал, альбумин), различные ПАВ,
слабые восстановители (сорбитол, сахароза, гидрохинон, фенол, резорцин - предотвращают окисление активной поверхности, не восстанавливают ионы металла. После обработки коллоидными растворами - обработка сильными восстановителями: борогидридом, производными аминоборана, формальдегидом CH2O. Широкое применение затруднено, т.к. используются дефицитные и токсичные восстановители.
Предложен совмещенный раствор, г/л: FeSO4.7Н2O - 40; CuSO4.5Н2О - 3; НСl конц. - до рН=2. Восстановитель - соединения железа (II). Катализатор химического осаждения меди - частицы меди.
Механизм: 1)на поверхности ПП оседает коллоидный раствор с частицами CuFenClm (длительность операции 30 секунд); 2)ПП промокаются, высушиваются и опускаются в раствор ускорителя; 3)В растворе NaОН (рН > 13) - быстрое восстановление Сu2+ и окисление Fe2+ . Cu - на поверхности ПП, Fе(ОН)3 - в осадок в виде хлопьев. Платы не промываются, опускаются сразу в раствор химического меднения, где идет процесс химической металлизации.
25,Травильные растворы на основе н2о2, (nh4)2s2o8, их сравнительная характеристика, способы утилизации.
Растворы иа основе персульфатов. Персульфат аммония (NH4)2S208- сильный окислитель и в кислой среде растворяет медь по реакции: (NH4)2S208+Cu→(NH4)2S04+CuS04.Побочной реакцией является гидролиз персульфата: (NH4)2S208+H2→ 2NH4HS04+1/2О2.
Электролит:200—250 г/л (NH4)2S208и 5-7 г/лH2S04.tдо 50 °С, боковое травление 50- 80 мкм, емкость по меди - 35 г/л,maxскорость травления — 25 мкм/мин. Утилизация меди и более полное использование персульфата - посредством охлаждения отработанного раствора до температуры + 5 °С, при этом выпадают кристаллы солей меди в видеCuS04* (NH4)2S04*6H20. Осаждению меди должна предшествовать реакция перевода кислой солиNH4HS04(которая образуется вследствие гидролиза персульфатов) в среднюю соль (NH4)2S04 с помощью водного раствора аммиака:NH4HSO4+NH4OH→ (NH4)2SO4+H2O.
Затем следует дополнительное введение в реактор раствора CuSO4, чтобы обеспечить связывание сульфата аммония в вышеуказанную, двойную соль.
Растворы на основе персульфата аммония могут быть использованы как в негативном, так и в позитивном процессе, однако невозможность регенерации раствора, сложная система утилизации меди, неравномерный характер вытравливания, высокая стоимость и дефицитность персульфата аммония обусловливают ограниченное применение персульфатных растворов в производстве.
Пероксидный хлоридный раствор. Раствор изH2O2иH2SO4, взятых в отношении 1:3;t= 35°С. В процессе травления меди происходят реакции
Cu+H2O2→CuO+H2O;CuO+ 2НС1→CuCl+ Н2О; СuС12+ Сu→2СuCl;
2СuС1 + Н2O2+ 2НС1→2СuС12+ 2Н2O.
Травление протекает с большой и постоянной скоростью, без кристаллизации и выпадения осадка. Процесс экономичный; образующиеся в процессе травления продукты (например, СиС12) также вступают в реакцию с медной фольгой, переводя ее в раствор. Далее под действием Н2O2 однохлористая медь вновь переводится в СuС12, таким образом обеспечивается непрерывное регенерирование раствора. На растворение 1 кг меди расходуется примерно 3 лH2SO4 и 1 л Н2O2(35%-ного). Растворение протекает нормально, пока количество растворенной меди не достигнет 130 г/л. После этого часть раствора сливается на утилизацию, а свежий наливается.
В пероксидно-соляном растворе травления окислителями по отношению к меди будут являться как ионы пероксида, так и ионы меди. Процесс травления протекает по электрохимическому механизму и состоит из сопряженных стадий: анодной - окисления меди с конечным образованием СиС132-; катодной - восстановления ионов меди (II) доCuCl32и ионов пероксида.
H2O2 легко разлагается в присутствии ионов Сu2+, частиц пыли и даже под воздействием света.
Сейчас большое внимание уделяется стабилизированным пероксидным травителям, состоящим из пероксида водорода, кислоты и стабилизатора. После того как были найдены стабилизаторы, стало возможным применение пероксида водорода в струйных установках и стационарных ваннах способом погружения плат.
Растворение меди в сульфатномрастворе протекает при воздействии пероксида водорода по реакции: Сu+H2O2→CuO+H2O
В присутствии серной кислоты: CuO+H2O2+H2SO4→CuSO4+ 2Н2O.
Кроме H2O2иH2SO4, вводятся добавки стабилизаторов, катализаторов для ускорения процессов и ингибиторов для защиты покрытияSn-Pb.
Экологически чистыми являются растворы, содержащие H2O2иH2SO4, которые используют при повышен ных температурах (40-90°С). При накоплении 40-50 г/лCuраствор истощается, и скорость травления резко падает. После охлаждения растворов до комнатных температур медь из них удаляют в виде кристаллогидратов сульфата меди. После корректирования концентраций кислоты и пероксида водорода, подогретые растворы используют повторно. Длительность применения таких растворов неограничена. Регенерация раствора осуществляется перекачкой его в ванну с охлаждением, в результате чего выпадают кристаллыCuS04*5Н20, которые могут быть использованы в приготовлении растворов химического и гальванического меднения.
Эффективным методом регенерации- электролиз.Pbи тонкие медные аноды, служащие пусковой поверхностью. На аноде протекает реакция: 2H2O-4е→4Н++О2;Cuосаждается на катоде по реакции:Cu2++2e→Сu.
Суммарная реакция протекает по схеме: 2CuSO4+2Н2O→2Сu+ 2H2SO4+O2.
Остаточные количества пероксида водорода
полностью разлагаются в процессе
электролиза.
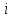 =
43-172 А/м2и напряжении на ячейке 2
В. При этом регенерированный раствор,
содержащий небольшие количества Сu,
после корректированияH2SO4,H2O2и стабилизатором вновь возвращается в
травильную ванну. Эта технология
позволяет экономитьH2SO4иH2O2,
а также рекупироватьCu.
=
43-172 А/м2и напряжении на ячейке 2
В. При этом регенерированный раствор,
содержащий небольшие количества Сu,
после корректированияH2SO4,H2O2и стабилизатором вновь возвращается в
травильную ванну. Эта технология
позволяет экономитьH2SO4иH2O2,
а также рекупироватьCu.
Преимущества раствора: допускается применение разнообразных резистов; исключается операция осветления покрытияSn-Pb; упрощается обработка стоков, а при регенерации образуется ценный продукт в видеCuS04*5Н20, который легко утилизируется; повышается четкость линий схемы; достигается возможность использования ванн вместо струйных установок; улучшается рабочая атмосфера, так как раствор не содержит аммиака.
