
Lekcii_po_bioorganicheskoi_khimii_1-5
.pdf
Лекции 1
Тема: Биологически важные спирты, фенолы.
Цель лекции: изучение электронного, пространственного строения и химических свойств биологически важных спиртов, фенолов.
Содержание лекции: Биологически важные одноатомные и многоатомные спирты, фенолы. Строение, изомерия, химические свойства. Качественные реакции. Производные спиртов и фенолов применяемые в медицине.
Спирты
Это производные УВ, у которых один или несколько атомов Н замещены на –ОН группу.
Классификация:
I. По количеству групп ОН различают одноатомные, двухатомные и многоатомные спирты:
|
|
H2C |
|
|
|
|
CH2 |
|
|
H2C |
|
|
CH |
|
|
|
CH2 |
||||||
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 СН2 ОН |
|
|
OH OH |
|
|
OH OH |
OH |
||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||
Этанол |
Этиленгликоль |
|
|
Глицерин |
|||||||||||||||||||
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
CH2 |
CH |
|
|
|
|
|
CH |
|
|
|
CH |
|
CH2 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
OH OH H OH OH OH |
|
|
|
|||||||||||||||||||
|
|
|
|
|
Сорбит |
|
|
|
|
|
|
|
|
|
|
||||||||
II. По характеру R различают: 1) предельные, 2) непредельные,
3)циклические, 4) ароматические.
2)СН2 = СН СН2 ОН Аллиловый спирт
3) |
|
|
|
|
К непредельным циклическим спиртам относятся: |
||||||||
|
OH |
|
ретинол (витамин А) и холестерин |
||||||||||
|
|
|
|
|
|||||||||
HO |
|
|
OH |
H3C CH3 |
|
CH3 |
|
CH3 |
|||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
||
HO |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
||
|
|
CH3 |
Ретинол (втитамин А) |
||||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||
Инозит |
|
|
|
|
|
|
|
|
|
|
|||
витаминоподобное в-во |
|
|
|
|
|||||||||

|
|
|
|
|
|
CH3 |
|
|
|
|
|
|||||
группы В |
|
|
|
|
|
|
|
|
CH |
|
(CH2)3 |
|
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
CH3 |
|
|
|
|
|
CH3 |
|
CH3 |
||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO
Холестерин
4)
 CH2 OH
CH2 OH
Бензиловый спирт
III. По положению гр. –ОН различают первичные, вторичные и третичные спирты.
IV. По количеству атомов С различают низкомолекулярные и высоко-
молекулярные. |
|
СН3–( СН2)14 –СН2–ОН (С16Н33ОН) |
СН3–( СН2)29 –СН2ОН (С31Н63ОН) |
Цетиловый спирт |
Мирициловый спирт |
Цетилпальмитат – основа спермацета, мирицилпальмитат содержится в пчелином воске.
Номенклатура:
Тривиальная, рациональная, МН (корень+окончание «ол»+арабская цифра).
Изомерия:
цепи, положения гр. –ОН, оптическая.
Строение молекулы спирта
СН-кислотный |
|
Nu центр |
|
|
центр |
|
|
|
|
SN |
|
|
|
SЕ |
'+ |
|
- |
|
+ |
R СН2 |
|
.. |
|
|
О |
Н |
|||
|
|
.. |
|
|
Электрофильный |
Центр |
|
Кислотный |
|
центр |
|
основности |
центр |
|
Р-ции окисления
иЕ
1)Спирты – слабые кислоты.
2)Спирты – слабые основания. Присоединяют Н+ лишь от сильных кислот, но они более сильные Nu.
3)–I эффект гр. –ОН увеличивает подвижность Н у соседнего углеродно-
го атома. Углерод приобретает + (электрофильный центр, SЕ) и становится

центром нуклеофильной атаки (Nu). Связь С–О рвется более легко, чем Н–О, поэтому характерными для спиртов явл-ся р-ции SN. Они, как правило, идут в кислой среде, т.к. протонирование атома кислорода увеличивает + атома углерода и облегчает разрыв связи. К этому типу относятся р-ции образования эфиров, галогенопроизводных.
4) Смещение элекронной плотности от Н в радикале приводит к появлению СН-кислотного центра. В этом случае идут р-ции окисления и элиминирования (Е).
Физические св-ва
Низшие спирты (С1–С12) – жидкости, высшие – твердые вещ-ва. Многие св-ва спиртов объясняются образованием Н-связи:
R O ..........H O
..........H O ..........H O
..........H O ..........
..........
H R R
Химические св-ва
I.Кислотно-оснóвные
Cпирты – слабые амфотерные соединения.
2R–ОН + 2Nа 2R–ОNа + Н2 Алкоголят
натрия Алкоголяты легко гидролизуются, что показывает – спирты более слабые
кислоты, чем вода:
R– ОNа + НОН R–ОН + NаОН Оснóвный центр в спиртах – гетероатом О:
.. |
|
|
|
СН3СН2 О Н + Н Сl [СН3СН2 О |
Н]Сl |
||
Осн-ие |
К-та |
| |
|
Н |
|
||
|
|
|
|
Этилоксонийхлорид
II. Реакции SN по гр. –ОН
Гр. ОН является плохоуходящей группой (связь мало полярна), поэтому большинство р-ций проводят в кислой среде. Механизм р-ции:
|
СН3СН2ОН + Н+ СН3СН2 |
|
Н СН3СН2+ + Н2О |
||||||
|
О |
||||||||
|
|
|
|
|
| |
|
Карбокатион |
|
|
|
|
|
|
|
Н |
|
|
|
|
|
Если р-ция идет с галогеноводородами, то присоединяться будет галоге- |
||||||||
нид-ион: СН3СН2+ + Сl СН3СН2Сl |
|
|
|
|
|||||
|
НС1 |
RОН |
R-СООН |
|
|
NН3 |
С6Н5ОNа |
||
|
|
|
|
|
|
|
|
|
|
|
С1 |
R-О |
R-СОО |
|
|
NН2 |
С6Н5О |
||
|
|
|
|
Анионы |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Анионы в таких р-циях выступают в качестве нуклеофилов (Nu) за счет « » заряда или неподеленной электронной пары. Анионы являются более сильными основаниями и нуклеофильными реагентами, чем сами спирты. Поэтому

на практике для получения простых и сложных эфиров используются – алкоголяты, а не сами спирты. Если нуклеофилом является другая молекула спирта, то она присоединяется к карбокатиону:
|
|
|
СН3СН2+ + : О - Н СН3СН2+ О Н СН3СН2ОR |
||
| |
| |
Н |
R |
R |
Простой эфир |
Это р-ция алкилирования (введение алкила R в молекулу). Заместить –ОН гр. на галоген можно при действии РСl3, РСl5 и SОСl2. По такому механизму легче реагируют третичные спирты.
Р-цией SЕ по отношению к молекуле спирта является р-ция образования сложных эфиров с органическими и минеральными к-тами:
|
Н |
,t |
|
|
|
R – О Н + Н О – C О R – О – C О + Н2О |
|
||||
| |
|
|
| |
|
|
R |
|
|
R |
|
|
|
Сложный эфир |
|
|
||
Это р-ция ацилирования – введение ацила в молекулу. |
|||||
R - C О |
|
|
|
|
|
| |
|
Н ,t |
|
|
|
R – О Н + Н О – NО2 R – О –NО2 + Н2О |
|
||||
Азотная |
|
Сложный |
|
|
|
к-та |
|
эфир |
|
|
|
III. Р-ции Е (отщепления, или элиминирования) |
|
||||
Эти р-ции конкурируют с реакциями SN. |
|
|
|||
|
Н2SО4 |
,t |
|
|
|
СН3СН2ОН + Н+ |
|
|
|
СН3СН2+ |
|
|
СН3СН2 О Н |
||||
Этанол |
НSО 4 |
| |
Н2О |
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
При избытке Н2SО4 и более высокой температуре, чем в случае р-ции образования простых эфиров, идет регенерация катализатора и образуется алкен:
СН3СН2+ + НSО4 СН2 = СН2 + Н2SО4
Легче идет р-ция Е для третичных спиртов, труднее для вторичных и первичных, т.к. в последних случаях образуется менее стабильные катионы. В данных р-циях выполняется правило А. Зайцева: «При дегидратации спиртов атом Н отщепляется от соседнего атома С с меньшим содержанием атомов Н».
|
|
|
Н 2SО4 , t |
|
СН 3 |
СН СН СН |
3 |
|
СН3СН = СН СН3 |
|
| | |
|
Н2О |
Бутен-2 |
|
|
|
|
НОН
Бутанол-2 В организме гр. –ОН превращается в легкоуходящую путем образования
эфиров с Н3РО4:
|
фермент |
|
СН3СН2ОН + НО–РО3Н2 |
|
СН3СН2ОРО3Н2 |
Этанол |
Н2О |
Этилфосфат |
|

IV. Р-ции окисления
1) Первичные и вторичные спирты окисляются СuО, растворами КМnО4, К2Сr2О7 при нагревании с образованием соответствующих карбонилсодержащих соединений:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
Окислитель ,t |
|
|
|
|
ОН |
|
|
|
|
О |
|
||
|
| |
|
|
| |
|
|
|
|
|| |
|
||||||
|
|
|
|
|
|
|
|
|
||||||||
СН3 СН2 C |
ОН + О |
СН3CH2 C |
ОН |
СН3 СН2 С |
Н |
|||||||||||
|
| |
|
|
|
| |
|
|
|
Н2О |
Пропионовый |
||||||
|
|
|
|
|
|
|
||||||||||
|
Н |
|
|
|
|
|
|
|
Н |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
альдегид |
||||
Пропанол-1 |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
Окислитель ,t |
|
ОН |
|
|
|
|
|
|
|
||||
| |
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
СН3 СН3 С СН3 |
|
||||||||||
СН3 C |
СН3 + О |
СН3 C |
|
|
||||||||||||
| |
|
|
|
|
| |
|
|
|
|
|
|
Н2О |
|| |
|
||
ОН |
|
|
|
|
ОН |
|
|
|
|
О |
|
|||||
Пропанол-2 |
|
|
|
|
|
|
|
|
|
|
Ацетон (кетон) |
|
||||
2) Третичные спирты окисляются с трудом. |
|
|
|
|
|
|
||||||||||
К реакциям окисления относятся и р-ции дегидрирования: |
|
|||||||||||||||
|
|
|
Н |
Сu, 300о С |
|
Н |
|
|
||||||||
|
|
| |
| |
|
|
|
||||||||||
|
|
СН3 C |
ОН |
СН3 C = О + Н2 |
|
|||||||||||
| |
Этаналь |
|
Н |
||
|
Этанол
V. По радикалу (R) протекают р-ции, характерные для соответствующих углеводородов (УВ). В случае предельных – SR, непредельных – АN, ароматических – SЕ:
|
t |
СН3 СН2 ОН + 3Вr2 СВr3 СН2 ОН + 3НВr |
|
Этанол |
Нарколан |
СН2 = СН СН2 ОН + Вr2 СН2 Вr–СНВr–СН2ОН
Аллиловый спирт |
|
|
2,3-Дибромпропанол |
|||||||
|
|
CH2OH |
|
|
H2SO4, t |
|
|
CH2OH |
||
|
|
|
|
|
||||||
|
|
|
+ HO |
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
-H2O |
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|||
Бензиловый спирт |
|
n-Нитрофенилметанол |
||||||||
Многоатомные спирты
Для этих спиртов характерны все р-ции одноатомных спиртов, однако имеется ряд особенностей.
1) За счет – I гр. –ОН многоатомные спирты обладают более выраженными кислотными свойствами. Они образуют алкоголяты не только с щелочными Ме, но и с щелочами:
|
CH2 |
|
OH |
CH |
|
|
OH |
||||||
|
|
||||||||||||
|
|
|
|
||||||||||
|
CH |
|
|
OH + NaOH |
|
|
2 |
|
ONa + H2O |
||||
|
|
|
|
|
|||||||||
|
|
|
|
CH |
|
||||||||
|
|
|
|||||||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
||||||||
CH2 |
|
|
OH |
CH |
|
|
|
OH |
|||||
|
|
||||||||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|||
Глицерин Качественной р-цией на двухатомные и многоатомные спирты (диольный
фрагмент) является р-ция с Сu(ОН)2 в щелочной среде:
CH |
|
|
OH |
|
HO |
|
|
CH |
|
|
|
CH |
|
|
|
OH |
|
|
HO |
|
CH |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
2 |
|
OH + HO-Cu-OH + |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
2 |
.. |
|
|
.. |
|
|
2 |
|||||||||||||||||
CH |
|
|
HO |
|
|
CH |
- 2H2O |
CH |
|
|
|
|
O |
|
|
Cu |
|
O |
|
|
CH |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
CH2 |
|
|
OH |
|
HO |
|
|
CH2 |
CH2 |
|
|
|
OH |
|
|
HO |
|
CH2 |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
Глицерин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гликолят меди (II) |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2- |
|
|
|
|
|
|
|
|
|
|
|
2KOH |
|
H2C |
|
|
|
O |
|
|
|
O |
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
или |
К2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
HC |
|
|
O |
|
Cu O |
|
|
CH |
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
Н2О |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
|
|
HO |
|
|
|
HO |
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Синее окрашивание Р-ции многоатомных спиртов могут протекать по одной или всем груп-
пам –ОН. Они образуют алкоголяты, простые и сложные эфиры, дегидратируются, окисляются.
2) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
OH |
HO |
|
|
|
CH2 |
H+, t |
|
|
|
|
CH2 |
|
O |
|
|
CH2 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
+ HO |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
CH2 |
|
OH |
|
|
CH2 |
- 2H2O |
|
|
|
CH2 |
|
O |
|
CH2 |
|||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
Элилен- |
|
|
|
Диоксан |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
гликоль |
|
|
|
(Циклический диэфир) |
|||||||||||||||||||
3) |
|
|
|
|
|
|
|
|
+ C17H35COOH |
H2C |
|
|
|
|
O-CO-C17H35 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
-3 H |
O |
HC |
|
|
|
|
|
|
|
|
O-CO-C17H35 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
H2C |
|
|
|
|
O-CO-C17H35 |
|||||||||||
H2C |
|
OH |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
Тристеарин (жир) |
||||||||||||||||||||
HC |
|
|
OH |
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
OH |
|
|
|
|
|
|
|
|
H2C |
|
|
|
|
O-NO2 |
|
|
|
|
|||||||||
Глицерин |
|
|
+ 3 HO-NO2 |
|
|
|
|
|
|||||||||||||||||||||
|
|
HC |
|
|
|
|
|
|
|
|
O-NO2 |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
-3 H O |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
H2C |
|
|
|
|
|
|
|
O-NO2 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Глицеринтринитрат, нитроглицерин

Нитроглицерин – бесцветная маслянистая жидкость. В виде разбавленных спиртовых растворов (1%) применяется при стенокардии, т.к. оказывает сосудорасширяющее действие. Нитроглицерин – сильное взрывчатое вещество, способное взрываться от удара или при нагревании. При этом в малом объеме, который занимает жидкое вещество, мгновенно образуется очень большой объем газов, что и вызывает сильную взрывную волну. Нитроглицерин входит в состав динамита, пороха.
H2C |
|
O-NO2 |
6 N2 + 12 CO2 + O2 + 10 H2O |
|||
|
||||||
4 HC |
|
|
|
O-NO2 |
||
|
|
|
||||
|
||||||
H2C O-NO2
Представители пентитов и гекситов – ксилит и сорбит – соответственно, пяти- и шестиатомные спирты с открытой цепью. Накопление –ОН групп ведет к появлению сладкого вкуса. Ксилит и сорбит – заменители сахара для больных диабетом.
Глицерофосфаты – структурные фрагменты фосфолипидов, применяются как общеукрепляющее средство.
В результате действия Н3РО4 на глицерин получают смесь - и-глицерофосфатов:
|
CH2 |
|
|
OH |
|
|
CH2 |
|
|
O |
|
PO3H2 |
|
CH2 |
|
|
OH |
|||||
|
|
|
|
|
|
|
|
|
||||||||||||||
2 |
CH |
|
|
OH + 2 H3PO4 - 2H O |
|
CH |
|
|
OH |
+ |
CH |
|
|
O |
|
PO3H2 |
||||||
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||
CH2 |
|
|
OH |
2 |
CH2 |
|
|
OH |
CH2 |
|
|
OH |
||||||||||
|
|
|
|
|
|
|
||||||||||||||||
- - Глицерофосфаты
Глицерофосфат железа (III) – при анемии, астении, общем упадке сил. Детям по 0,3 – 0,5 г 2 – 3 раза в день, взрослым по 1 г 3 – 4 раза:
|
CH2 |
OH |
|
|
|
|
|
CHOPO3 |
Fе2+3 nН2О |
||
|
|||||
CH2 |
OH |
3 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
Глицерофосфат кальция – при переутомлении, рахите, упадке питания. Детям по 0,05 – 0,2 г на прием, взрослым 0,2 – 0,5 г.
C Н2 ОН |
C Н |
2 ОН |
|
||||
| |
|
|
| |
|
|
|
|
C НОН |
|
Са Н2О + C НОРО |
|
Са nН2О |
|||
| |
|
|
| |
|
|
3 |
|
|
|
|
|
|
|
|
|
CН2 |
ОРО3 |
|
CН |
2 ОН |
|
|
|
|
|
|
|
|
|
|
|
1) При действии КНSО4 и при нагревании – образуется акролеин:

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC |
|
|
OH |
|
|
CHCH |
|||||||||||
H |
C OH |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
CH2 |
|
|
||||||||||||||||||||
2 |
|
|
|
|
|
|
|
KHSO4, t |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
2 |
|||
|
CH |
|
|
|
OH |
-2 |
H |
O |
|
CC |
|
|
|
|
|
|
CH |
CH |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
C |
|
OH |
|
|
C |
|
|
O |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
||||||||||
|
CH |
|
OH |
|
|
|
|
C |
|
|
OH |
|
|
|
|
|
|
|
O |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
HH |
|
|
|
|
|
|
H H |
|
|
|||||||
H |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
АкролеинАкролеин
2) При окислении глицерина образуется ряд продуктов. При мягком окислении – глицериновый альдегид (1) и дигидроксиацетон (2):
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
H C |
|
|
OH |
|
|
C |
H2C |
|
|
OH |
|||||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
2 HC |
|
|
|
OH + 2 O |
-2 |
H O |
HC OH + |
C |
|
|
|
O |
|||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
H2C OH |
H2C |
|
|
|
OH |
|||||
H C |
|
|
|
OH |
|
2 |
|
||||||||||
|
|
||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
2 |
|
|
|
При окислении в жестких условиях образуется 1,3-диоксоацетон.
Химические свойства непредельных спиртов аналогичны предельным, однако за счет двойных или тройных связей они вступают в р-ции присоединения, полимеризации, окисления.
Фенолы
Это производные ароматических УВ, в которых один или несколько атомов Н замещены на –ОН группу.
|
|
OH |
|
|
CH3 |
|
|
CH3 |
|
|
CH3 |
|
|
CH2OH |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
OH |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
||
Фенол |
I-Гидрокси- 2- |
I-Гидрокси-3- |
I-Гидрокси-4- Бензиловый |
||||||||||||||||
|
|
|
|
метилбензол, |
метилбензол, |
метилбензол, |
спирт |
||||||||||||
|
|
|
|
|
О-крезол |
|
М-крезол |
n-крезол |
|
|
|
|
|||||||
Изомеры положения
Двухатомные фенолы:

|
|
OH |
OH |
OH |
|
|
|
OH |
|
|
|
|
|
OH |
OH |
|
|
|
|
Пирокатехин, |
|
Резорцин, |
Гидрохинон, |
1,2-Дигидрокси- |
1,3-Дигидрокси- |
1,4-Дигидрокси- |
|
бензол |
|
бензол |
бензол |
|
Изомеры положения |
|
|
Трехзамещенные фенолы: рядовой (пирогаллол), симметричный и |
|||
несимметричный. |
|
OH |
OH |
|
|
||
OH |
|
|
OH |
OH |
OH |
OH |
|
|
|
|
|
OH |
|
|
OH |
Пирогаллол |
|
|
|
Каждый фенол дает свое характерное окрашивание в качественной реакции с FеС13:
Фенол Фиолетовое, Гидрохинон Грязно-зеленое, Пирокатехин Зеленое, Пирогаллол Красное. Резорцин Фиолетовое,
|
|
Строение молекулы |
|
|
|
. |
. |
|
Связь очень прочная |
||
|
|
|
|||
. |
. |
.. |
|
|
|
|
|
|
|
||
. |
. |
|
|
|
|
O |
H |
||||
H |
|||||
|
|
||||
|
|
|
|
|
|
|
|
|
Связь менее прочная |
||
–ОН группа проявляет + М >, чем –I, являясь ЭД.
Р-ции SЕ протекают легко за счет +М гр. –ОН, р-ции SN не характерны.
Химические свойства
I. Реакции замещения Н в группе –ОН
Это проявляется при образовании фенолятов, простых и сложных эфиров. 1) Фенолы за счет р, -сопряжения являются более сильными к-тами, чем
спирты и образуют соли (феноляты) в р-циях с Ме, МеОН и даже солями:
С6Н5ОН + NаОН С6Н5ОNа + Н2О Фенолят натрия,
феноксид натрия Однако фенолы более слабые к-ты, чем Н2СО3, поэтому при действии
Н2СО3 (СО2 + Н2О) и др. к-т феноляты легко разлагаются и обратная р-ция не возможна.
С6Н5ОNа + СО2 + Н2О С6Н5ОН + NаНСО3
3С6Н5ОН + FеС13 (С6Н5О)3Fе + 3НС1
|
|
|
Фиолетовое окрашивание |
||||
2) |
OH |
|
|
t |
|
|
O-R |
|
+ |
|
|
|
|
|
|
|
HOR |
-H2O |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Простой эфир |
|
||
На практике используют феноляты. |
|
|
|
||||
3) |
|
|
|
|
|
|
O |
|
ONa |
|
O |
|
+ |
, t |
O C |
|
|
|
|
H |
|
||
|
|
+ |
|
C CH3 |
CH3 |
||
|
|
Cl |
-NaCl |
||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сложный эфир |
4)Р-ция восстановления с цинковой пылью при нагревании:
Zn, t
С6Н12 + ZnО
Р-ции по –ОН группе не характерны! II. Р-ции по бензольному кольцу (SЕ)
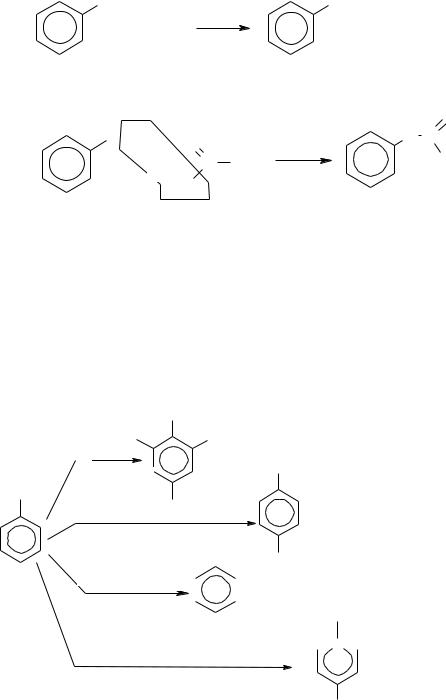
–ОН группа – ориентант I рода, облегчает р-ции по бензольному кольцу, направляя атаку электрофильного реагента преимущественно в орто- и параположения:
|
|
|
OH |
|
|
+ 3 Br2 |
Br |
|
Br |
|
-3 BrH |
|
OH |
|
|
|
|
||
OH |
3HBr |
|
|
|
|
|
|
|
|
|
HO-SO3H |
Br |
+ H2O |
|
|
|
|
|
|
|
|
OH |
|
|
+ 3HO-NO2 (разб.) |
|
|
|
|
|
|
|
|
|
|
|
|||
-3 H2O |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
NO |
2 |
|
+ 3HO-NO2 (конц.) |
||||
H2SO4
SO3H
n-Нитрофенол (индикатор)
OH
O2N
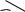
 NO2
NO2
+ 3 H2O
Пикриновая кислота
NO2
Пикриновая к-та близка по силе (степени диссоциации) к соляной к-те, т.к. содержит три ЭА группы, усиливающие кислотность.
