
- •Ароматичность
- •Взаимное влияние атомов в молекуле
- •Индуктивный эффект
- •Мезомерный эффект
- •Классификация органических реакций
- •Вопросы для самоконтроля:
- •Упражнения
- •Тесты для самостоятельной работы студентов
- •Органические кислоты
- •Основность органических соединений.
- •Факторы, влияющие на основность
- •Вопросы для самоконтроля
- •Упражнения
- •Тесты для самостоятельной работы студентов Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
Основность органических соединений.
Органические соединения, в состав молекулы которых входят атомы азота, кислорода, серы, могут выступать в роли оснований, присоединяя протон водорода за счет неподеленной пары электронов на внешнем энергетическом уровне. Гетероатом в молекуле органического вещества, присоединяющий протон, называется центром основности.
Основания по Бренстеду делятся на n – основания и π – основания.
n – Основания могут быть нейтральными или отрицательно заряженными частицами. К ним относятся:аммониевые (R3N, R=NH, RCN), оксониевые (RC(O)R1, R-O-R1), сульфониевые (R-S-R1, RC(S)R1).
π-основания (алкины, алкены, диены, арены) в них центром основности являются электроны π-связи. Это очень слабые основания, так как протонируемые электронные пары несвободны.
Сила основания определяется стабильностью образующегося катиона (сопряженной кислоты). Чем стабильнее катион, тем сильнее основание.
Для количественной характеристики основности обычно используют величину pK BH+ - показатель константы основности сопряженной кислоты. Чем больше pK BH+, тем сильнее основание.
Факторы, влияющие на основность
Природа гетероатома в основном центре
Н3С - NH2 > Н3С - OH Н3С - OH > Н3С – SH
Сила оснований зависит от электроотрицательности гетероатома в основном центре. Чем больше ЭО атома, тем слабее основные свойства, поэтому спирты и простые эфиры являются более слабыми основаниями по сравнению с аминами.
Строение радикала, связанного с основным центром.
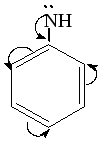 анилинН3С
→ СН2
→ NH2 этиламин
анилинН3С
→ СН2
→ NH2 этиламин
Алифатические амины проявляют более сильные основные свойства, чем ароматические. Объясняется это тем, что алкильные радикалы являются электронодонорами (электронная плотность на атоме азота повышается, что облегчает присоединение протона), а бензольное кольцо электроноакцептором (электронная плотность на атоме азота понижается, что затрудняет присоединение протона).
Электронодонорые заместители усиливают основные свойства, а электроноакцепторные – уменьшают, например:
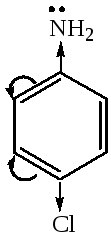 4-хлоранилин
4-хлоранилин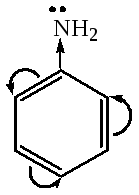 анилин
анилин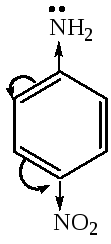 4-нитроанилин
4-нитроанилин
РКВН+ 5,1 4,6 1,0
уменьшение основности
Влияние растворителя
В водной среде важную роль играет уменьшение пространственных препятствий для гидратации, поэтому вторичные амины лучше гидратируются, чем третичные, которые пространственно труднодоступны.
H 3C
- NH – CH3
> H3C
– NH2
> H3C
- N – CH3
3C
- NH – CH3
> H3C
– NH2
> H3C
- N – CH3
CH3

основность уменьшается
В газовой среде основность возрастает с увеличением углеводородных радикалов, так как усиливается их стабилизирующее действие за счет +I-эффекта на катион сопряженной кислоты, поэтому третичные амины проявляют более сильные основные свойства по сравнению с другими аминами.
H 3C
- N – CH3
> H3C
- NH – CH3
> H3C
– NH2
3C
- N – CH3
> H3C
- NH – CH3
> H3C
– NH2
CH3
о сновность
уменьшается
сновность
уменьшается
Вопросы для самоконтроля
Теория Бренстеда - Лоури. Сопряженные кислоты и основания.
Кислотные свойства органических соединений с водородосодержащими функциональными группами (спирты, фенолы, тиолы, карбоновые кислоты, амины).
Основные свойства органических соединений.
Факторы, влияющие на реакционную способность кислот и оснований.
