
Метод реком для студ зан 1
.doc
![]()
Министерство здравоохранения и социального развития Российской Федерации
Государственное бюджетное образовательное учреждение высшего
профессионального образования
«Саратовский государственный медицинский университет
имени В.И. Разумовского» Министерства здравоохранения и социального
развития Российской Федерации
(ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздравсоцразвития России)
«УТВЕРЖДАЮ»
Зав. кафедрой общей и биоорганической
химии профессор _____________ П.В. Решетов
«______» _____________________20 ____ г.
Методические указания
практического (семинарского, лабораторного) занятия для студентов
Специальность, курс: 060103 Педиатрия; курс I
Дисциплина: химия
Тема: Термодинамика.
Разработка составлена асс. Куликовой Л.Н.
2011 г
Тема: Растворы.
1. Место проведения: кафедра общей и биоорганической химии
2. Продолжительность: 3 часа (из них самостоятельная аудиторная работа 1 час)
3. Цель занятия: формирование представлений о физико-химических аспектах как о важнейших биохимических процессах в организме.
4. Мотивационная характеристика занятия:
Знание термодинамических свойств систем, а так же закономерностей, протекающих в нашем организме необходимо не только для изучения курса химии, но дальнейшего изучения дисциплин: микробиологии гистологии, эмбриологии, цитологии, нормальной физиологии, патофизиологии, клинической патофизиологии, фармакологии, вирусологии и клинических дисциплин.
5. В результате занятия
Студент должен знать:
Первое начало термодинамики. Понятия: энтальпия, энтропия. Закон Гесса. Применение первого начала термодинамики к биосистемам. Второе начало термодинамики. Энергия Гиббса.
Студент должен уметь:
Прогнозировать направление и результат физико-химических процессов и химических превращений биологически важных веществ. Выполнять термохимические расчеты, необходимые для составления энергоменю. Рассчитывать стандартную энтальпию химической реакции по стандартным энтальпиям образования и сгорания химических соединений, по закону Гесса, энтропию химической реакции, энергию Гиббса.
Студент должен познакомиться:
С функциями состояния термодинамической системы.
6. Графологические схемы, таблицы по данной теме, учебные элементы по данной теме:
-
№ п/п
Учебные элементы
1.
Проверка домашнего задания - опрос по теме: «Термодинамика»
2.
Решение задач по теме «Термодинамика»
3
Тестированный контроль по теме: «Буферные растворы».
7. Контрольные вопросы для подготовки к занятию:
-
Предмет и методы химической термодинамики. Взаимосвязь между процессами обмена веществ и энергии в организме. Химическая термодинамика как теоретическая основа биоэнергетики.
-
Основные понятия термодинамики. Интенсивные и экстенсивные параметры. Функция состояния. Внутренняя энергия. Работа и теплота - две формы передачи энергии.
-
Типы термодинамических систем (изолированные, закрытые, открытые).
-
Типы термодинамических процессов (изотермические, изобарные, изохорные).
-
Первое начало термодинамики.
-
Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции.
-
Закон Гесса.
-
Применение первого начала термодинамики к биосистемам.
-
Второе начало термодинамики. Обратимые и необратимые в термодинамическом смысле процессы. Энтропия.
-
Энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов. Термодинамические условия равновесия.
-
Стандартная энергия Гиббса образования вещества, стандартная энергия Гиббса биологического окисления вещества. Стандартная энергия Гиббса реакции.
-
Понятие экзергонических и эндергонических процессов, протекающих в организме. Принцип энергетического сопряжения.
8. Содержание самостоятельной работы:
Выполнение тестированного контроля по теме «Термодинамика».
Самостоятельная работа студентов:
|
№№ |
Содержание работы (виды самостоятельной аудиторной работы) |
Учебно - методическая литература |
Наглядные средства обучения, технические средства обучения |
|
1 |
Выполнение текущей тестированной контрольной работы |
Микролекция, учебники. |
|
9. Методическое и наглядное обеспечение занятия:
Учебники, учебно – методические пособия, лекции, таблицы, электронно – образовательные ресурсы.
10. Литература:
А) Основная:
-
Общая химия. Биофизическая химия. Химия биогенных элементов: Учебник для медицинских вузов. /Ю.А. Ершов, В.А. Попков, А.С. Берлянд и другие. Под ред. Ю.А. Ершова, 8 изд.,560 с. – М.: Высш. Шк., 2010.
-
Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учебное пособие для студентов медицинских вузов.(Ред. В.А. Попков).- М., Высшая школа, 4 изд., 239 с., 2008 г.
-
Сборник задач и упражнений по общей химии. Учебное пособие. (С.А.Пузаков, В.А. Попков, А.А. Филиппова). М: Высшая школа, 4 изд., 255с., 2010г.
Б) Дополнительная
-
Общая химия. Учебник для медицинских вузов. (В.А. Попков, С.А. Пузаков), 976с.-ГЭОТАР Медиа, 2007г.
В) Методические пособия, рекомендации и т.д., изданные кафедрой:
1. Лекции по общей химии для студентов лечебного и педиатрического факультетов (Ю.А. Алексашин, Ю.В. Куляш, Р. Т. КУцемако), Изд-во СГМУ,186 с., Саратов, 2002.
Составитель: ___________________
_____________________________
«______»_______________ 2011 г.
Методические указания обсуждены на заседании учебно-методической конференции кафедры протокол № __2_ от «22 »__сентября__________2011__г
Приложение 1: Тренировочный тест
-
Термодинамика изучает:
а) взаимосвязь теплоты и энергии;
б) скорость протекания химических процессов;
в) свойства основных классов химических соединений;
-
Энтропия - это…
а) теплосодержание участников реакции;
б) способность совершать работу;
в) мера неупорядоченности в системе;
3) Первый закон термодинамики описывает:
а) энтропию термодинамической системы;
б) связь между внутренней энергией, теплотой и работой;
в) динамическую вязкость веществ.
4) Самопроизвольно протекают процессы, сопровождаемые:
а) уменьшением энергии;
б) уменьшением энтропии;
в) увеличением энтропии.
5) Закрытая система характеризуется:
а) отсутствием обмена веществом и энергией;
б) отсутствием обмена энергией;
в) отсутствием обмена веществом;
Ответы: 1а, 2в, 3б, 4в, 5в
Приложение 4: Ситуационные задачи
-
Вычислите тепловой эффект реакции
4 НСl(газ) + О2(газ) = 2 Н2О(газ) + 2 Сl2(газ)
при 298 К и ΔН0обр. НСl(газ) = -92,30 кДж/моль,
ΔН0обр. Н2О(газ) = -241,84 кДж/моль.
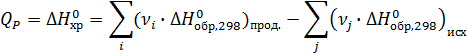
-
Вычислите тепловой эффект реакции
3 С2Н2 (газ) = С6Н6 (жид) при 298 К и
ΔН0сгор. С2Н2 (газ) = -1299,63 кДж/моль,
ΔН0сгор. С6Н6 (жид) = -3267,70 кДж/моль.
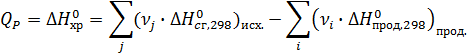
-
Вычислите изменение энтропии при 298 К (ΔS0298) для реакции
4 НСl(газ) +О2 (газ) = 2 Н2О(газ)+ 2Сl2(газ) ,
если S0298 (H2O(газ)) = 188,8 Дж/(моль·К);
S0298 (Сl2 (газ)) = 233,0 Дж/(моль·К);
S0298 (HCl(газ)) = 186,7 Дж/(моль·К);
S0298 (O2 (газ)) = 205,3 Дж/(моль·К).
![]() прод
-
прод
-![]() исх
исх
-
Для химической реакции вычислить изменение энергии Гиббса ΔG0298, используя стандартные значения энергии Гиббса ΔG0f, 298 и используя ΔН0298 и ΔS0298.
![]()
или
![]()
![]()
Задачи для решения на занятии.
-
Вычислите тепловой эффект следующей реакции С3Н8(газ)= 2 Н2 (газ) + С3Н4 (газ) при 298 К и
ΔН0обр. С3Н4(газ) = 192,10 кДж/моль,
ΔН0обр. С3Н8(газ) = -103,90 кДж/моль.
-
Вычислите ΔS0298 для реакции N2 + 3H2 = 2NH3, если
S0298 (N2) = 191,5 Дж/моль К;
S0298 (H2) = 130,6 Дж/моль К;
S0298 (NH3) = 192,5 Дж/моль К.
-
Вычислите тепловой эффект реакции
СН4 (газ) + Н2О(газ) = 3 Н2 (газ) + СО(газ) при 298 К и
ΔН0обр. СН4 (газ) = -74,85 кДж/моль;
ΔН0обр. Н2О(газ) = -241,84 кДж/моль;
ΔН0обр. СО(газ) = -110,50 кДж/моль.
-
Вычислите тепловой эффект реакции
С2Н2 (газ) + СО(газ) + Н2О(жид) = СН2=СН–СООН (жид) при 298 К и
ΔН0сгор. С2Н2 (газ) = -1299,63 кДж/моль;
ΔН0сгор. СО (газ) = -282,96 кДж/моль;
ΔН0сгор. СН2=СН–СООН (жид) = -1370,18 кДж/моль.
-
Вычислите тепловой эффект реакции
СН4 (газ) + СО2 (газ) = 2 Н2 (газ) + 2 СО(газ) при 298 К и
ΔН0обр. СН4 (газ) = -74,85 кДж/моль;
ΔН0обр. СО2 (газ) = -393,51 кДж/моль;
ΔН0обр. СО(газ) = -110,50 кДж/моль.
-
Вычислите тепловой эффект реакции
РСl5 (газ) = PCl3 (газ) + Сl(газ) при 298 К и
ΔН0обр. PCl5 (газ) = -369,45 кДж/моль;
ΔН0обр. PCl3 (газ) = -277,0 кДж/моль.
