
Билет 1
Термодинамическая система-совокупность макроскопических тел,которые могут взаимодействовать между собой и другими телами.Обмениваться с ними энергией и в-вом.
ТДС состоит из большого числа молекул,атомов,структурных единиц,что его состояние можно хар-ть макроскопическими хар-ми:обьемом,давление,тем-ра.,плотность.Концетрацией.
Виды тдс
1.Изолированные (нет обмена ни веществом ,ни энергией с окр.ср.)
2.Закрытые(нет обмена с в-вом с окр.средой)
3.Открытые( есть энерго и массообмен)
Внутренняя энергия тел включает в себя:
1.Кинетическую энергию цепи движений части.
2.Потенциальную энергию заключ. в хим. связях.
3.Внутриядерную энергию.
В
системах хим.состав хоть не изменен, в
процессе энергетич.преобразований,можно
учитывать только теплоую энергию у
примеру удельный газ. U=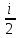 :
: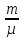 RT(i-число
степеней молек. µ-молекулярная масса.RT
RT(i-число
степеней молек. µ-молекулярная масса.RT
Внутренняя энергия состоит из 2х частей:
1.Свободная энергия Gi-которую можно исп-ть для сов.работы.
2.Связанная
энергия Gc
связи-которую в данных условиях вообще
нельзя превратить в работу.U=Gi
+
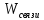
Мерой
связанной энергии системы явл-ся энтропия
S=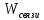 /T
/T
Энтропия S-величина связанной энергии происходящая на ед.абсолютной температуры.
Те
процессы ,которые A= назыв-ся обратимой, т.к. пустив такой
процесс в обратном направлении и
затратив работу можно полностью вернуть
систему в исх.состояние,но такие процессы
в природе не сущ-ют.Все
реальные процессы необратимые .Иными
словами,свободная энергия системы не
может быть преобразована в работу. При
таком преобраз. Часть
назыв-ся обратимой, т.к. пустив такой
процесс в обратном направлении и
затратив работу можно полностью вернуть
систему в исх.состояние,но такие процессы
в природе не сущ-ют.Все
реальные процессы необратимые .Иными
словами,свободная энергия системы не
может быть преобразована в работу. При
таком преобраз. Часть
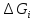 превращается в связанную,это является
диспонсией свободной энергии.
превращается в связанную,это является
диспонсией свободной энергии.
Билет №2
Первое начало термодинамики - представляет собой закон сохранения энергии. Он гласит, что энергия не может быть создана или уничтожена, она лишь переходит из одного вида в другой в различных физических процессах. Отсюда следует, что внутренняя энергия изолированной системы остается неизменной. В закрытых системах: изменение внутренней энергии; а)путем совершения работы(А); б)препятствует передачи тепла(Q). ∆U=Q-A
Тепло, переданное системе, идет на VB и совершение работы Q=∆U+A
+Q – тепло, поступающее в систему
-Q – тепло, отдаваемое системой
+A - работа совершаемая системой над телами
-А - работа совершаемая телами над системой
Первое
начало ТД справедлив и для живых
организмов, и был сформулирован Р. Майср
и Г. Геймгольд, но записан в несколько
другой форме с учетом того, что единый
источник энергии для живых организмов
является энергия химических связей
пищевых продуктов.
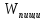 =A+Q+∆U
=A+Q+∆U
Энергия
пищи тратиться на совершение работы,
изменение внутренней энергии и отдачи
тепла. Теплокровные имеют постоянную
температуру тела, и поэтому ∆V=0
,
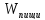 =AQ
=AQ
Изотермический процесс(const= T) Физический смысл- все количество теплоты передаваемое системе, расходуется на совершение механической работы(расширение). Вся работа внешних сил выделяется в виде тепла(сжатие)
Изохорический процесс(const=V) Физ. смысл-Все количество теплоты передаваемое системе расходуется (нагревание) на увеличение ∆V. Система уменьшает свою ∆V отдавая тепло(охлаждение)
Изобарный процесс(const=p) Физ. смысл- Все количество теплоты передаваемое системе превышении совершаемой ею мех. работу. Количество теплоты отдаваемое системой превышает работу внешних сил
Адиабатный процесс Физ. смысл- Совершение механической работы происходит путем уменьшения ∆V(расширение) V увеличение за счет работы внешних сил.
