
- •1.Структура и рольРнк
- •У мужчин:
- •У женщин:
- •3.Желчные кислоты
- •Инсулин
- •Глюкагон
- •3.Клинич знач наруш безазотист комп крови
- •Основные показатели кор:
- •3.Роль ц.Кребса в обм
- •1.Участв в биол окислении
- •3.Синтез нукл к-т
- •Ингибиторы взаимодействуют с ферментами различными путями, они могут:
- •У мужчин:
- •У женщин:
- •1.Горм гипот и гипофиза
- •Система фибринолиза
- •3.Метаболизм арахидоновой кислоты:
- •2 Этап. Окислительное декарбоксилирование пвк, катализируется мультиферментной системой и протекает в
- •Участие витамина с в метаболизме
- •Нарушения обмена порфиринов
- •Регуляция концентрации глюкозы крови.
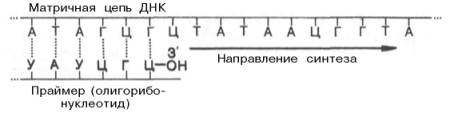
3.Синтез нукл к-т
Этап I – инициация биосинтеза ДНК – является началом синтеза дочерних нуклеотидных цепей; в инициации участвует минимум восемь хорошо изученных и разных ферментов и белков. Первая фаза – это, ферментативный биосинтез на матрице ДНК необычного затравочного олигорибонуклеотида (праймера) со свободной гидроксиль-ной группой у С-3' рибозы. При инициации к цепям ДНК последовательно присоединяются ДНК-раскручивающие и ДНК-связывающие белки, а затем комплексы ДНК-полимераз и праймаз. Инициация представляется единственной стадией репликации ДНК, которая весьма тонко и точно регулируется, однако детальные механизмы ее до сих пор не раскрыты и в настоящее время интенсивно исследуются.
Этап II – элонгация синтеза ДНК – включает два кажущихся одинаковыми, но резко различающихся по механизму синтеза лидирующей и отстающей цепей на обеих материнских цепях ДНК. Синтез лидирующей цепи начинается с синтеза праймера (при участии праймазы) у точки начала репликации, затем к праймеру присоединяются дезоксирибонуклеотиды под действием ДНК-полимеразы III; далее синтез протекает непрерывно, следуя шагу репликационной вилки. Синтез отстающей цепи, напротив, протекает в направлении, обратном движению репликационной вилки и начинается фрагментарно. Фрагменты всякий раз синтезируются раздельно, начиная с синтеза праймера, который может переноситься с готового фрагмента при помощи одного из белковых факторов репликации в точку старта биосинтеза последующего фрагмента противоположно направлению синтеза фрагментов. Элонгация завершается отделением олигорибонуклеотидных праймеров, объединением отдельных фрагментов ДНК при помощи ДНК-лигаз и формированием дочерней цепи ДНК. Нельзя исключить, однако, возможности сопряженного и согласованного механизма синтеза лидирующей и отстающей цепей ДНК при участии полимераз и всего комплекса праймасом.
Этап III – терминация синтеза ДНК – наступает, скорее всего, когда исчерпана ДНК-матрица и трансферазные реакции прекращаются. Точность репликации ДНК чрезвычайно высока, возможна одна ошибка на 1010 трансферазных реакций, однако подобная ошибка обычно легко исправляется за счет процессов репарации.
Билет19
1.Регуляция акт-ти ферментов
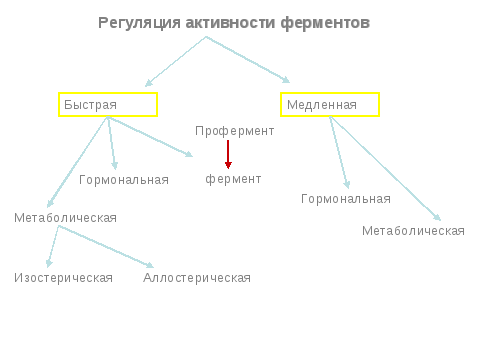
Быстрая-изм акт-ть уже имеющ мол Е в Кл.регуляция на Ур синтезир мол Е
Медл-изм к-ва Е в Кл
Изостерич метаболич быстрая-путем воздейств на ферм различн факторами(темп,рН,ингибит)
Аллостерич метаболич быстр-влияние на аллостерич мол различными модиф-ми,хар-ен для многоступенчатых реакц
Метаболич медл регуляц-регулир синтеза Е на Ур генома
Медл горм регул-белк горм=цАМФ=ПК активирует киназу=ДНК в ядре=иРНК=рибосома(синтез белка)
Гормон=рецептор=активация Е гормон-рецептор комплекса=транскрипция=мРНК
2.Распад гемоглобина
гемоглобин=вердглобин=биливердин=билирубин
Превращение билирубина в кишечнике
Билирубин=мезобилирубин=мезобилиноген(уробилиноген)=стеркобилиноген(толстый кишечник)=стеркобилин(фекалии)
Мезобилиноген=печень(обезвреживание)=экскреция с желчью=кишечник=частично всасывается в кровь=почки=моно и ди пирролы
3. Роль важнейших макроэргических соединений в обмене веществ.
1.Непосредственным источн АТФ явл процессы субстратного и окислит фосфорилир-я.
ФункцииАТФ:
Аккумулирование биологич энергии и ее послед использов для выполн клеточн функций.Макроергичность ТАФ определяется рядом особенностей его мол-лы:высокая плотность зарядов,сконцентрирлванная в хвосте мол-лы,обеспечивающая легкость диссоциации терминального фосфата при водном гидролизе.Продукты этого гидролиза представл собой АДФ и неорганич фосфат и далее-АМФ и неорг фосфат.Это обеспечивает высокую вел-ну своб энергии гидролиза терминального фосфата АТФ в водн среде
2.НАДФН и НАДН-дыхательн переносчики.Спос-ть их играть роль промежуточного переносчика водорода связана с наличием в их структуре амида никотиновой к-ты.При взаимод-и этих кофакторов с атомами водорода имеет место обратимое гидрирование.
3.Во флавиновых коферментах (ФАД) активной частью мол-лы кот явл изоаллоксазиновое кольцо,в рез восстан-я чаще всего наблюд присоед 2 протонов и 2 электронов одноврем.Восствновленные формы этих кофактров спос транспортировать водород и электроны к дыхат цепи митохондрий или иных энергосопрягающих мембран.
4.ГТФУчаств в ц.Кребса.А именно,катализирует 5 реакцию превращения сукцинилкоАв сукцинат(янтар к-ту)
Билет 20
1.Активаторы и ингибиторы Е
Активаторы Е
1. Активация ферментов ионами металловИоны Mg+2, Mn+2, Zn+
2, Co+2, K+
- Входят в состав простетической группы фермента, компонент активного центра
- Облегчают образование ES - комплекса
- Способствуют присоединению кофермента к апоферменту
- Обеспечивают становление четвертичной структуры фермента
Действуют иными путями:
- создание каталитически активной конформации белка
- влияние на поверхностный заряд молекулы фермента
- удаление ингибитора
- вытеснение неэффективного иона из связи с ферментом
2Восстановленными соединениями
3) Частичный протеолиз
пепсиноген пепсин
пепсин
4) Аллостерическими активаторами ( АДФ, АМФ)
5) Гормонами через посредников: цАМФ, цГМФ
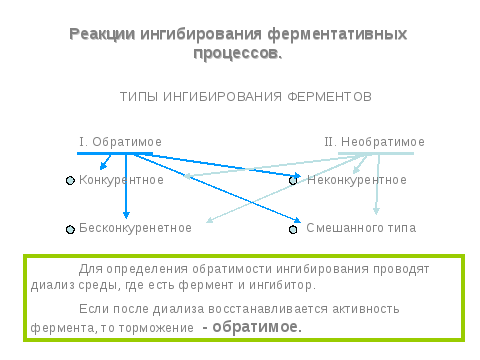
Конкурентный тип ингибирования- Осуществляется веществом, близким по химическому строению к субстату.
Неконкурентное торможение- Ингибитор реагирует с ферментом иным образом , чем субстрат, и поэтому повышение концентрации субстрата не может вытеснить ингибитор и восстановить активность фермента
Бесконкурентное торможение- Ингибитор взаимодействует с фермент – субстратным комплексом
Смешанный тип торможения - Ингибитор взаимодействует с ферментом в различных участках молекулы.
