
- •1. Основные определения и понятия термодинамики
- •2. Параметры состояния и уравнения состояния.
- •3.Термодинамическая и потенциальные работы, координаты p-V
- •4. Теплоемкость. Определение теплоемкости веществ.
- •5. Математическое выражение 1го начала термодинамики
- •6.Первое начало термодинамики по балансу рабочего тела
- •7. Аналитическое выражение первого начала термодинамики
- •8. Первое начало термодинамики для идеального газа.
- •9. Принцип существования энтропии идеального газа.
- •10. Процессы изменения состояния (изобара, изохора, изотерма и адибата)
- •11. Политропа с постоянным показателем.
- •12. Работа в термодинамических процессах простых тел (изобара, изохора, изотерма и адиабата)
- •13. Теплообмен в термодинамических процессах простых тел (изобара, изохора, изотерма и адиабата)
- •14. Процессы изменения состояния идеальных газов.
- •15. Работа и теплообмен в политропных процессах идеальных газов.
- •16. Круговые процессы. Кпд и холодильный коэффициент.
- •17. Обратимый цикл Карно.
- •18. Математическое выражение второго начала термостатики. Основные следствия.
- •19. Математическое выражение второго начала термодинамики. Основные следствия.
- •20. Смеси жидкостей, паров и газов, расчет характеристик смеси веществ. Схемы смещения.
- •21. Истечение жидкостей и газов. Основные расчётные соотношения.
- •22.Особенности истечения сжимаемой жидкости. Кризис истечения. Режимы истечения.
- •23.Переход через критическую скорость (сопло Лаваля).
- •24. Особенности истечения через каналы переменного сечения, сопло и диффузор.
- •25. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
- •26. Процессы парообразования, определение параметров насушенного пара, диаграмма h-s.
- •27. Термодинамические циклы и кпд гту.
- •28.Термодинамические циклы и кпд поршневых двс.
- •29. Теплопроводность. Закон Фурье. Коэффициент теплопроводности
- •30. Дифференциальное уравнение теплопроводности. Условия однозначности
- •31. Теплопроводность через однослойные стенки (плоские, цилиндрические).
- •32 Теплопроводность через многослойные стенки (плоские, цилиндрические)
- •33.Теплоотдача. Закон Ньютона-Рихмана. Коэффициент теплоотдачи. Критериальные уравнения.
- •34. Теплообмен излучением. Основные законы.
- •35. Теплообмен излучением между телами.
- •36. Теплопередача. Основное уравнение теплопередачи. Коэффициент теплопроводности.
- •37. Теплопередача через плоскую однослойную и многослойную плоскую стенку
- •38. Теплопередача через криволинейные однослойные и многослойные стенки.
- •39.40. Оптимизация процессов теплопередачи. Способы интенсификации теплопередачи.
- •41,43. Теплопередача при переменных температурах. Средняя разность температур.
- •44. Расчет теплообменный аппаратов первого рода.
- •45. Расчет теплообменный аппаратов второго рода.
- •46. Паросиловые установки, цикл Ренкина, методы повышения кпд.
- •48. Воздушные холодильные машины.
- •49. Рабочий процесс двухтактного и четырехтактного двигателя внутреннего сгорания.
- •50. Индикаторные и эффективные характеристики двигателей внутреннего сгорания
- •51. Рабочий процесс и характеристики гту.
19. Математическое выражение второго начала термодинамики. Основные следствия.
Все явления природы, связанные с превращением энергии имеют необратимый характер. Обобщающим законом необратимости процессов в природе является принцип возрастания энтропии изолированных систем. В основу второго начала термодинамики положен постулат: «работа может быть непосредственно и полностью превращена в теплоту путем трения или электронагрева.»
Эти формулировка подчеркивает специфичность теплоты при ее превращениях. В теплоту полностью превращаются все виды энергии. Превращения же теплоты всегда сопровождаются процессами, компенсирующими эти превращения. В тепловом двигателе такой компенсацией является передача некоторой части теплоты источнику низшей температуры (холодному источнику); в холодильных машинах такой компенсацией являются затраты работы.
Анализ постулата второго начала термодинамики приводит к некоторым весьма важным следствиям.
Следствие I. Невозможно осуществление полного превращения теплоты работу, т.е. нельзя создать вечный двигатель второго рода (Perpetuum mobile II рода) с коэффициентом полезного действия равным единице
![]()
Следствие II. КПД реального теплового двигателя и холодильный коэффициент реальной холодильной машины, в которых осуществляются циклы при температурах внешних источников Т1 и Т2 , всегда меньше КПД и холодильного коэффициента обратимых тепловых машин, циклы в которых осуществляются между теми же внешними источниками
h < hобр ; c < cобр
Следствие III.
Абсолютный нуль по термодинамической
абсолютной шкале температур (шкала
Кельвина) недостижим (![]() ).
).
Поскольку КПД любого теплового двигателя и даже работающего по эталонному циклу Карно всегда меньше 1
![]()
и в
случае, если горячий источник теплоты
имеет положительную температуру по
термодинамической абсолютной шкале
температур (![]() ),
справедливо утверждение
),
справедливо утверждение
![]()
Математическое выражение второго начала термодинамики
При наличии второго начала термостатики (принцип существования энтропии) итоговое математическое выражение второго начала термодинамики (принцип возрастания энтропии) в дифференциальной и интегральной формах, как принципа возрастания энтропии систем имеет следующий вид:
![]()
![]()
Знак неравенства справедлив в случае реальных (необратимых) процессов, а равенства – обратимых процессов.
Следствия принципа существования энтропии.
И
 зменение
энтропии всей системы может быть
подсчитано отдельно:
зменение
энтропии всей системы может быть
подсчитано отдельно: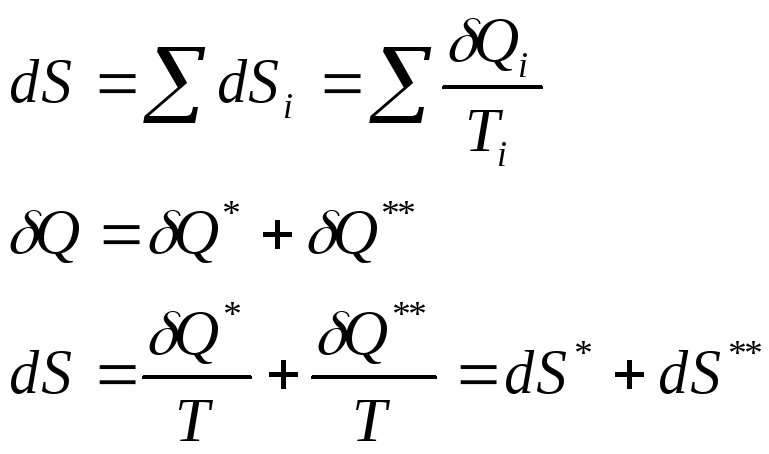
Площадь под графиком
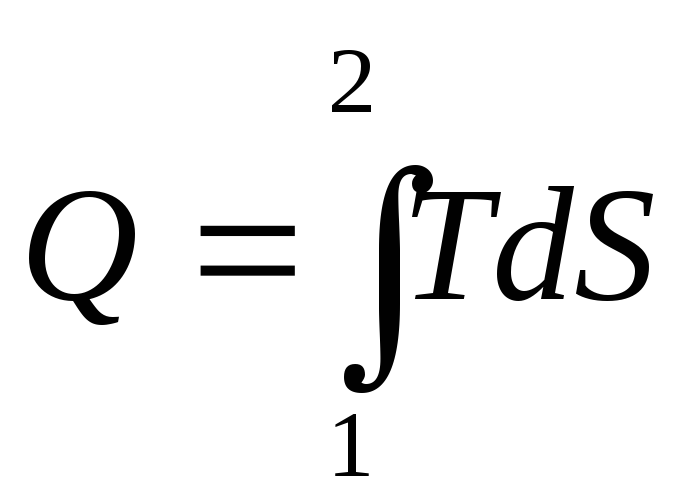 .
Если
.
Если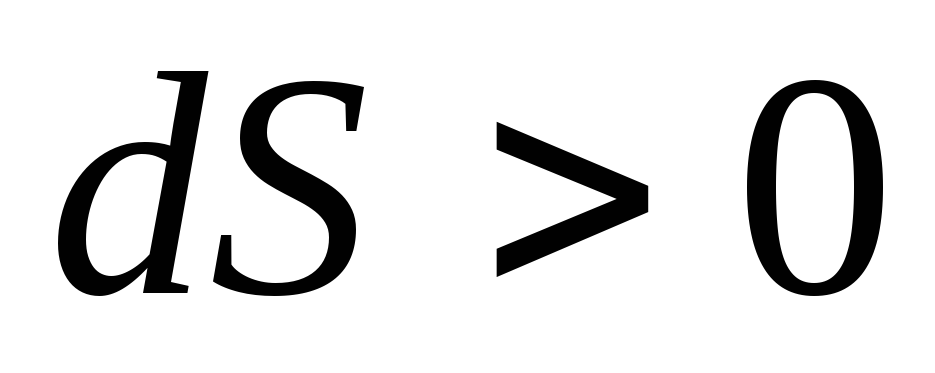 ,
то
,
то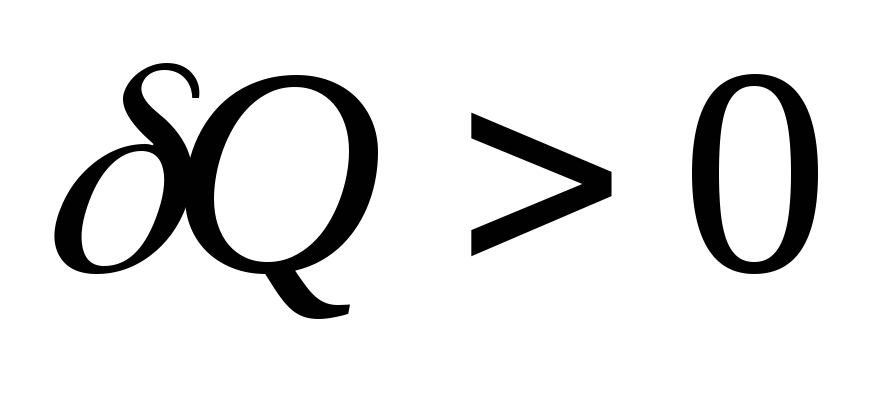 ,
если
,
если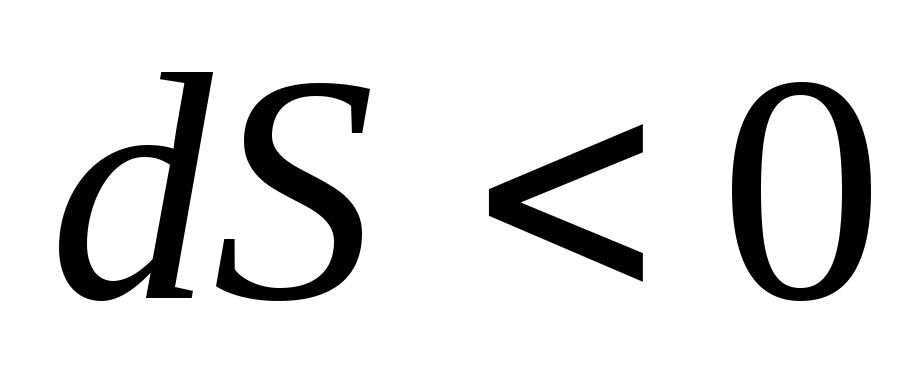 ,
то
,
то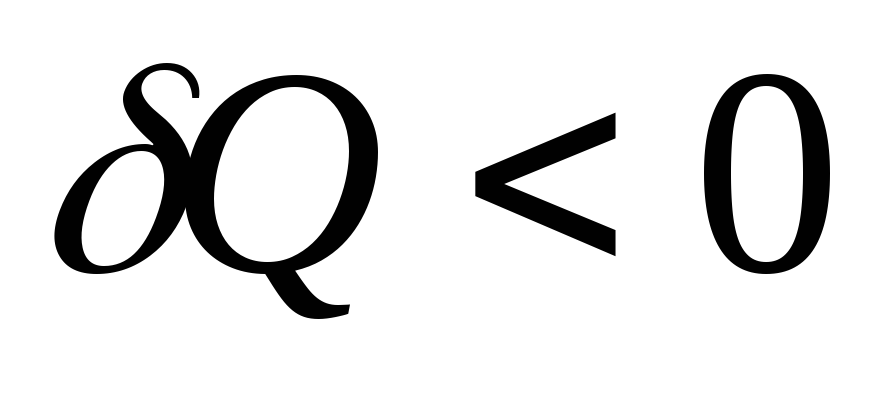 .
.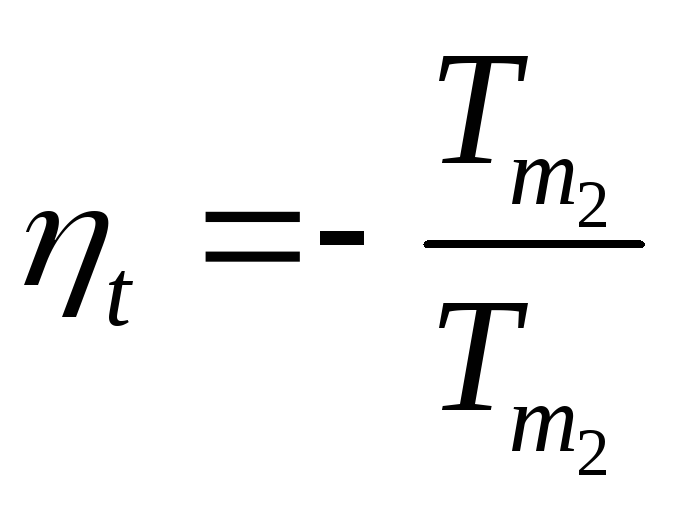
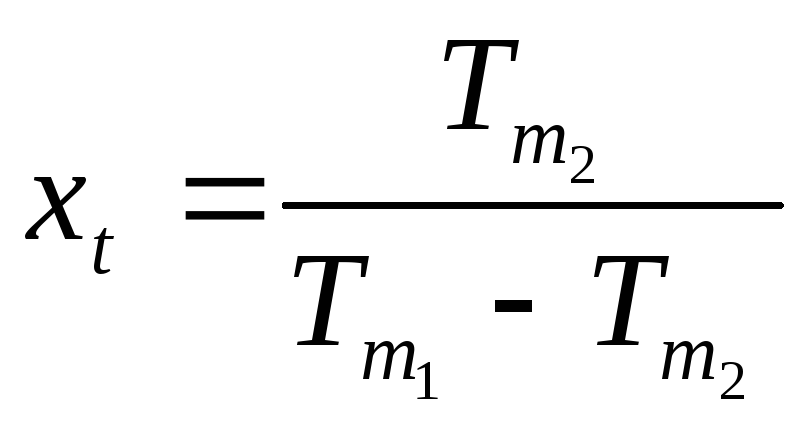
Математическое определение абсолютной температуры:
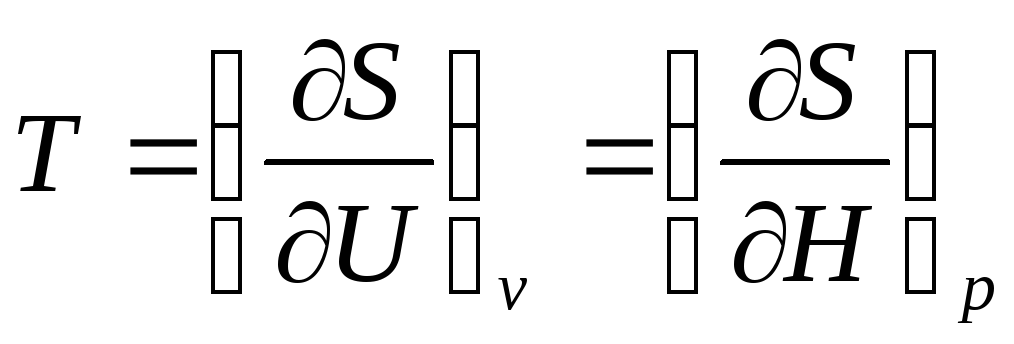 .
.
Принцип возрастания энтропии.
Работа
может быть полностью превращена в
теплоту:
![]() .
.
Принцип необратимости процессов в природе:
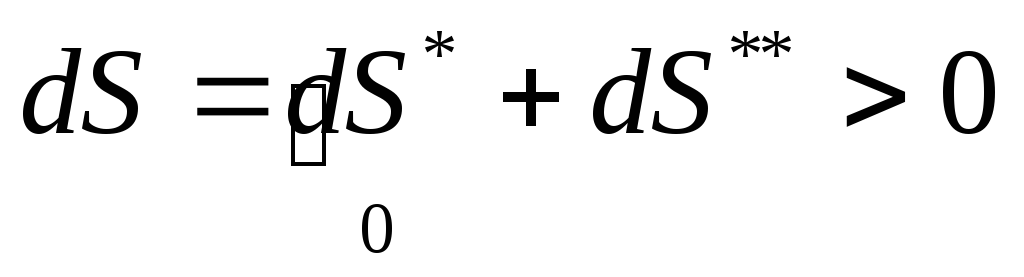 .
.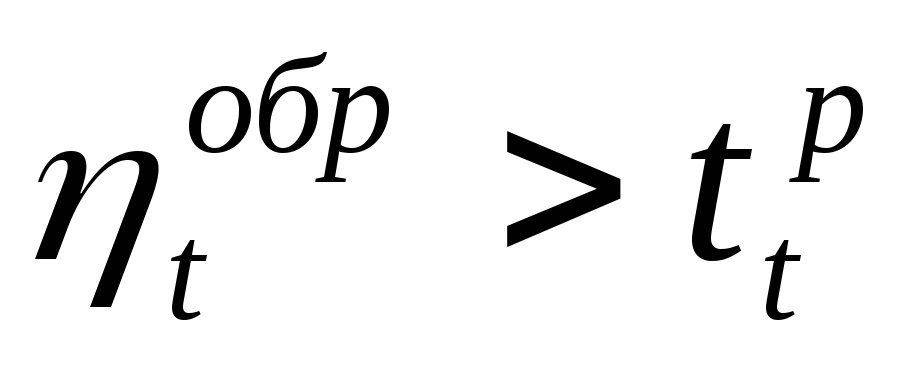 .
.Абсолютная температура
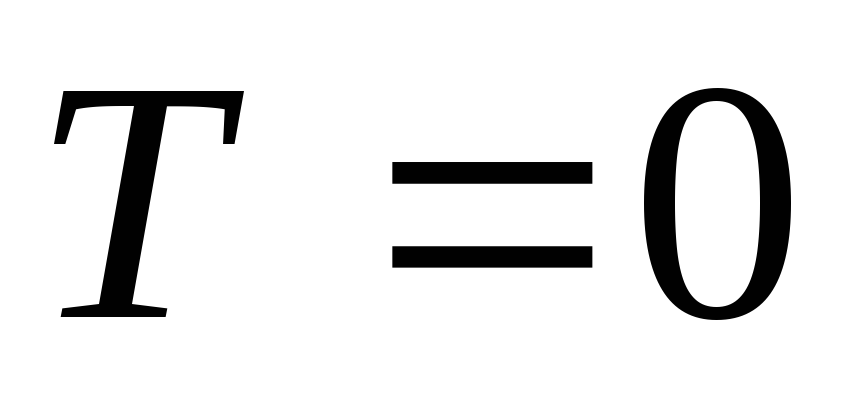 недостижима, так как
недостижима, так как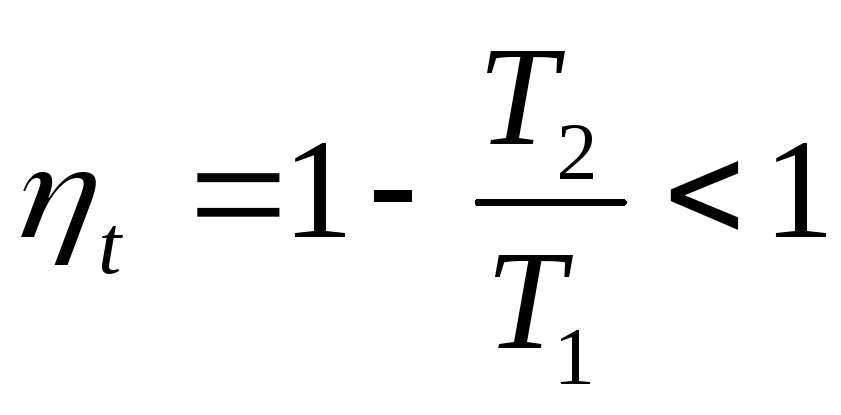 .
Так как
.
Так как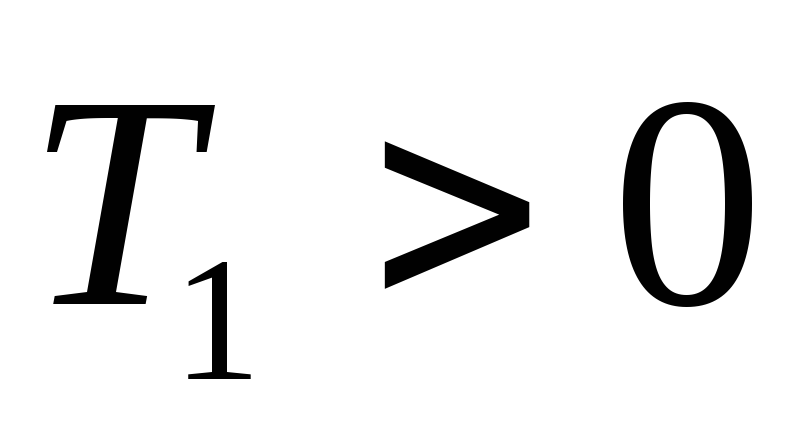 ,
то
,
то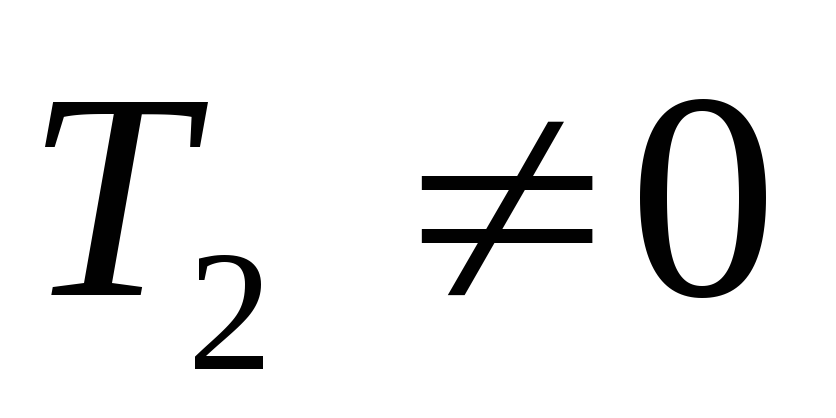 .
.
20. Смеси жидкостей, паров и газов, расчет характеристик смеси веществ. Схемы смещения.
Термодинамическая
смесь
– система, состоящая из
![]() химически невзаимодействующих друг с
другом компонентов.
химически невзаимодействующих друг с
другом компонентов.
Состав
смеси задаётся либо массовой концентрацией
компонентов -
![]() ,
либо молярным составом -
,
либо молярным составом -![]() (объёмный).
(объёмный).
![]() ,
где
,
где
![]() - масса одного компонента смеси,
- масса одного компонента смеси,![]() - масса всей смеси.
- масса всей смеси.
![]()
![]()
![]() ,
где
,
где
![]() - число киломолей вещества,
- число киломолей вещества,![]() - число киломолей смеси.
- число киломолей смеси.
![]()
Для
смеси нужно уметь определять среднюю
молекулярную массу
![]() и среднюю газовую постоянную
и среднюю газовую постоянную![]() .
.
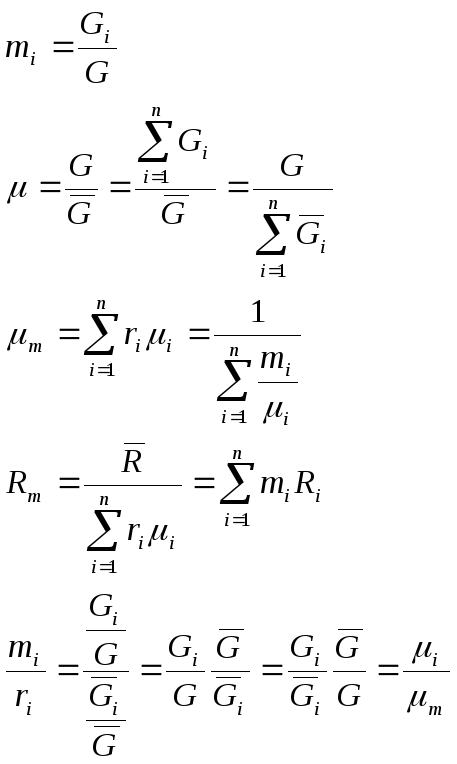
Если
смесь является идеальным газом, то
![]() .
.
Если
смесь является реальным газом, то
![]() .
.
Псевдокритические параметры:
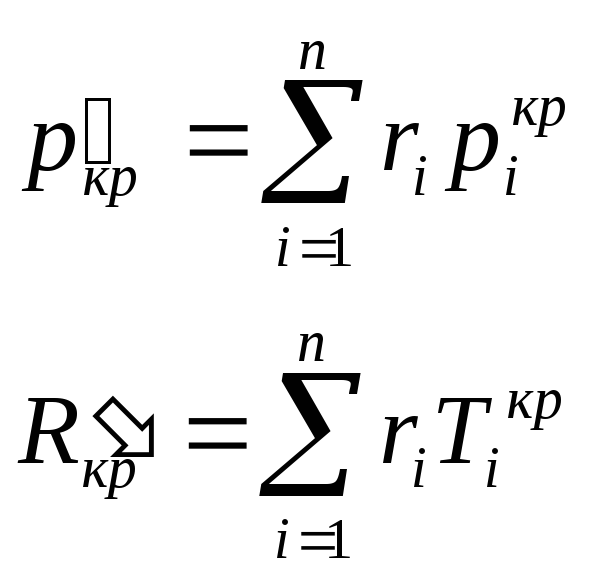
Схемы смешивания газов.
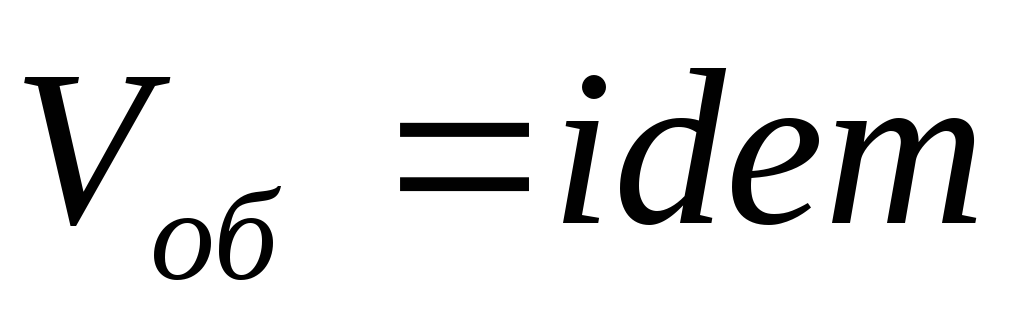 ,
следовательно
,
следовательно
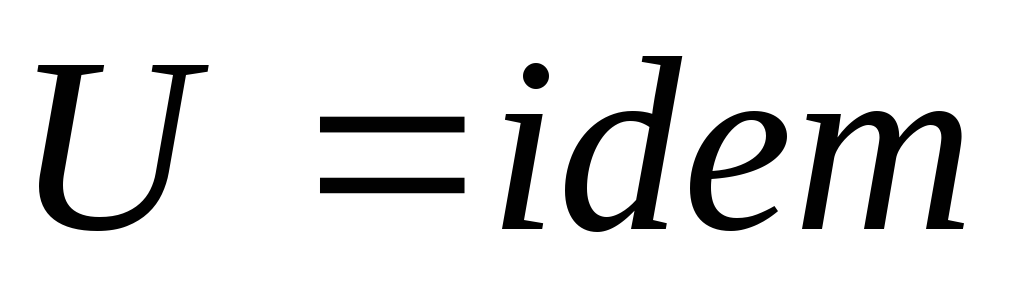 .
.
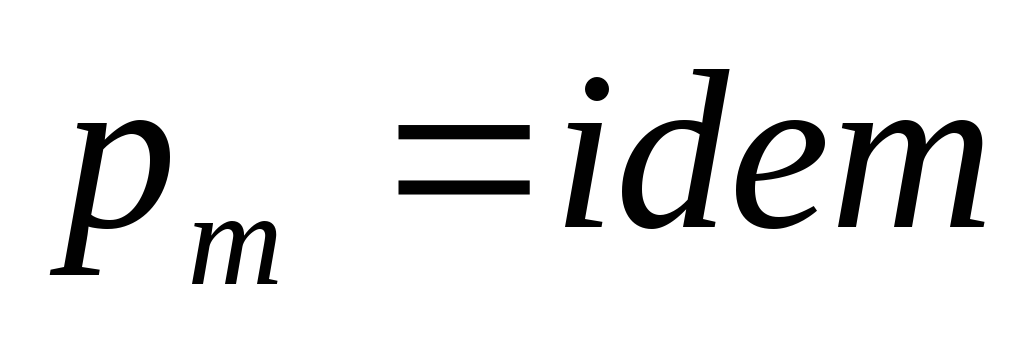 ,
следовательно
,
следовательно
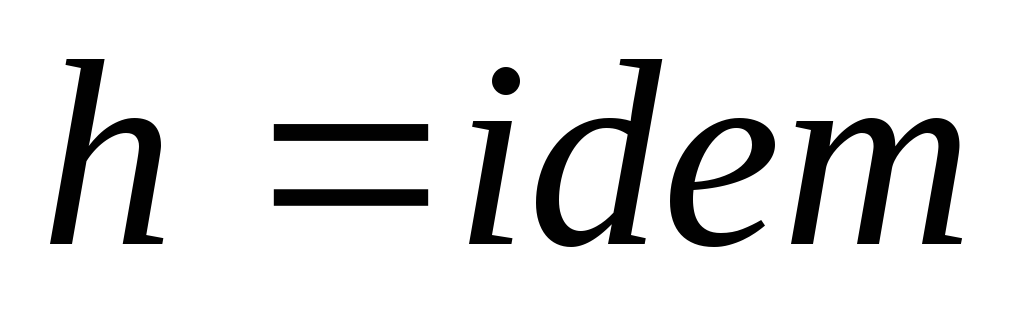 .
.
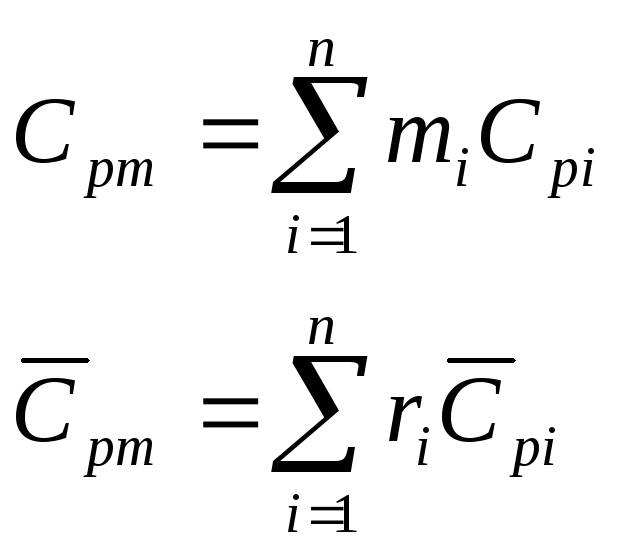
Закон Дальтона: давление смеси равно сумме парциальных давлений компонентов.
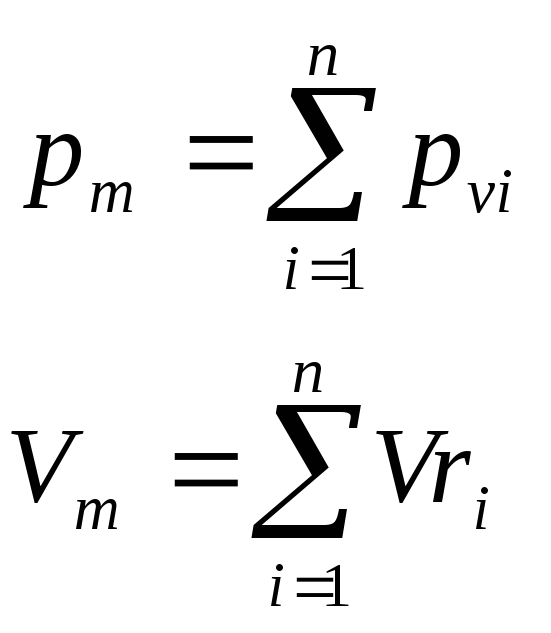
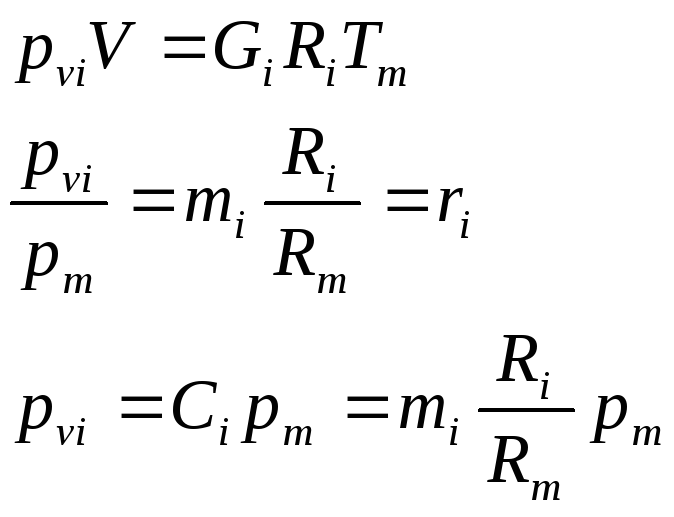
![]()
