
- •1. Основные определения и понятия термодинамики
- •2. Параметры состояния и уравнения состояния.
- •3.Термодинамическая и потенциальные работы, координаты p-V
- •4. Теплоемкость. Определение теплоемкости веществ.
- •5. Математическое выражение 1го начала термодинамики
- •6.Первое начало термодинамики по балансу рабочего тела
- •7. Аналитическое выражение первого начала термодинамики
- •8. Первое начало термодинамики для идеального газа.
- •9. Принцип существования энтропии идеального газа.
- •10. Процессы изменения состояния (изобара, изохора, изотерма и адибата)
- •11. Политропа с постоянным показателем.
- •12. Работа в термодинамических процессах простых тел (изобара, изохора, изотерма и адиабата)
- •13. Теплообмен в термодинамических процессах простых тел (изобара, изохора, изотерма и адиабата)
- •14. Процессы изменения состояния идеальных газов.
- •15. Работа и теплообмен в политропных процессах идеальных газов.
- •16. Круговые процессы. Кпд и холодильный коэффициент.
- •17. Обратимый цикл Карно.
- •18. Математическое выражение второго начала термостатики. Основные следствия.
- •19. Математическое выражение второго начала термодинамики. Основные следствия.
- •20. Смеси жидкостей, паров и газов, расчет характеристик смеси веществ. Схемы смещения.
- •21. Истечение жидкостей и газов. Основные расчётные соотношения.
- •22.Особенности истечения сжимаемой жидкости. Кризис истечения. Режимы истечения.
- •23.Переход через критическую скорость (сопло Лаваля).
- •24. Особенности истечения через каналы переменного сечения, сопло и диффузор.
- •25. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
- •26. Процессы парообразования, определение параметров насушенного пара, диаграмма h-s.
- •27. Термодинамические циклы и кпд гту.
- •28.Термодинамические циклы и кпд поршневых двс.
- •29. Теплопроводность. Закон Фурье. Коэффициент теплопроводности
- •30. Дифференциальное уравнение теплопроводности. Условия однозначности
- •31. Теплопроводность через однослойные стенки (плоские, цилиндрические).
- •32 Теплопроводность через многослойные стенки (плоские, цилиндрические)
- •33.Теплоотдача. Закон Ньютона-Рихмана. Коэффициент теплоотдачи. Критериальные уравнения.
- •34. Теплообмен излучением. Основные законы.
- •35. Теплообмен излучением между телами.
- •36. Теплопередача. Основное уравнение теплопередачи. Коэффициент теплопроводности.
- •37. Теплопередача через плоскую однослойную и многослойную плоскую стенку
- •38. Теплопередача через криволинейные однослойные и многослойные стенки.
- •39.40. Оптимизация процессов теплопередачи. Способы интенсификации теплопередачи.
- •41,43. Теплопередача при переменных температурах. Средняя разность температур.
- •44. Расчет теплообменный аппаратов первого рода.
- •45. Расчет теплообменный аппаратов второго рода.
- •46. Паросиловые установки, цикл Ренкина, методы повышения кпд.
- •48. Воздушные холодильные машины.
- •49. Рабочий процесс двухтактного и четырехтактного двигателя внутреннего сгорания.
- •50. Индикаторные и эффективные характеристики двигателей внутреннего сгорания
- •51. Рабочий процесс и характеристики гту.
4. Теплоемкость. Определение теплоемкости веществ.
Теплоемкостью называется количество теплоты, которое надо сообщить единице массы, количества или объема вещества, чтобы его температура повысилась на 1 градус.
Различают
массовую теплоемкость
с,
измеряемую в Дж/(кгК),
молярную
![]() –Дж/(кмольК)
и объемную с'
– Дж/(м3К).
–Дж/(кмольК)
и объемную с'
– Дж/(м3К).
Связь между массовой, молярной и объемной теплоемкостью представлена следующими соотношениями:
![]() ;
;
![]() .
(1.12)
.
(1.12)
Теплоемкость газов зависит от термодинамического процесса, в котором подводится или отводится теплота. Если процесс задан условием z = idem, то теплоемкость в этом процессе будет определяться следующим образом:
![]() .
(1.13)
.
(1.13)
Эта теплоемкость называется истинной.
Экспериментальное определение теплоемкости обычно проводится в двух процессах: при постоянном объеме (изохорная теплоемкость cv ) и постоянном давлении (изобарная теплоемкость cp).
Теплоемкость реального газа зависит от температуры и давления. Теплоемкость идеального газа зависит только от температуры.
Для практических расчетов вводится понятие средней теплоемкости в интервале температур от t1 до t2, значение которой принимается неизменной для всего рассматриваемого интервала температур (сzm).
Из уравнения (1.13) следует, что количество теплоты, подведенной к телу (или отведенной от него) в процессе 1–2 (изобарном или изохорном), определяется соотношением
![]() .
(1.14)
.
(1.14)
Отсюда следует выражение средней теплоемкости газа
![]() .
(1.15)
.
(1.15)
Для большинства газов значения средней теплоемкости в интервале температур от t1 до t2 приведены в специальных термодинамических таблицах.
Для некоторых газов в определенном интервале температур истинная теплоемкость изменяется по линейному закону
![]() .
(1.16)
.
(1.16)
Подставив выражение (1.16) в уравнение (1.15), получим
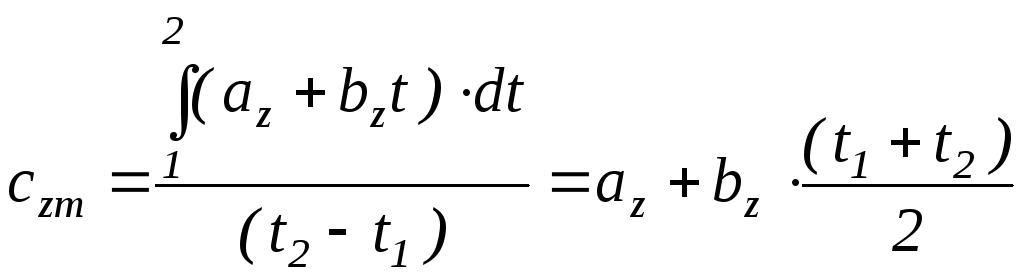 ,
(1.17)
,
(1.17)
где сzm - называется первой средней теплоемкостью. Она численно равна истинной теплоемкости при среднеарифметической температуре процесса.
5. Математическое выражение 1го начала термодинамики
Первое начало термодинамики – это количественное выражение закона сохранения и превращения энергии.
Закон сохранения и превращения энергии является универсальным законом природы и применим ко всем явлениям. Он гласит: «запас энергии изолированной системы остается неизменным при любых происходящих в системе процессах; энергия не уничтожается и не создается, а только переходит из одного вида в другой».
Это утверждение и принимается в качестве постулата первого начала термодинамики
Первое начало термодинамики как математическое выражение закона сохранения и превращения энергии:
Внутренняя
энергия изолированной системы сохраняет
своё постоянное значение при всех
изменениях, протекающих внутри системы,
то есть
![]() .
Изменение внутренней энергии
неизолированной системы складывается
из подведённой (отведённой) теплоты и
подведённой (отведённой) работы, то есть
.
Изменение внутренней энергии
неизолированной системы складывается
из подведённой (отведённой) теплоты и
подведённой (отведённой) работы, то есть![]() .
.
![]()
в интегральной форме:
![]()
![]() -
эффективная работа;
-
эффективная работа;
![]() -
внешний теплообмен
-
внешний теплообмен
Полученные уравнения учитывают только внешние эффекты и справедливы только для обратимых процессов.
Уравнения являются математическим выражением первого начала термодинамики по внешнему балансу теплоты и работы и гласят: количество теплоты, подведенное извне, идет на изменение внутренней энергии системы и совершение работы.
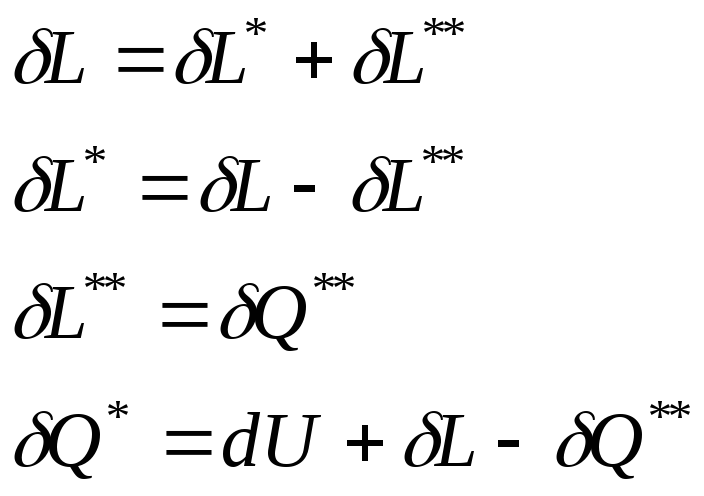
В термодинамике приняты следущие знаки при определении работы и теплоты в уравнениях первого начала термодинамики: если работа выполняется телом, то она положительная; если работа подводится к телу, то она отрицательная. Если теплота сообщается телу, она имеет положительное значение; если теплота отводится от тела, она имеет отрицательное значение.
