
- •9. I. Первый закон термодинамики
- •Термодинамические потенциалы
- •12. Зависимость скорости реакции от температуры. Энергия активации
- •13. Кинетика - это раздел химии, изучающий скорость, механизм химических реакций и влияние на них различных факторов.
- •Ферментативный катализ
- •Способы выражения концентрации растворов
- •19. Свойства растворов неэлектролитов
- •21. Электролиты – вещества, растворы или расплавы которых проводят электрический ток.
- •22. Слабые электролиты в водных растворах лишь частично (обратимо) диссоциируют на ионы.
- •Роль концентрации водородных ионов в биологических процессах
- •24. Буферные системы
- •Компоненты: н2со3 /нсо3–
- •26. Типы гидролиза солей
- •Эдс гальванического элемента
- •1) Разряд водородных ионов по реакции: 2) восстановление растворенного кислорода:
- •Водородной деполяризацией
- •Кислородная деполяризация
- •Квантово – механическая модель строения атома
- •Правило Клечковского
- •Строение молекул
- •44. Кратные связи
- •Сигма- и пи-связи
- •Длина связи
- •Энергия связи
- •Классификация анионов и групповые реагенты
Квантово – механическая модель строения атома
Недостатком постулатов Бора является то, что с точки зрения классической механики, электрон рассматривал как некоторую вращающуюся частицу, а 3-й постулат не соответствовал законам классической механики.
В начале XX в. французский физик Луи-Де-Брайлле предложил формулу, согласно которой каждая частица имеет волновые свойства:
λ=h/nV,
λ – длина волны. m – масса частицы,V – скорость движения, h – постоянная планка (h=6,6*10-34 Дж*с).
Для макромира эта формула не имеет особого значения, а для микрочастиц эффекты, связанные с их волновой природой, во многих случаях описывают поведение частиц с достаточно большой точностью.
Эрвин Шредингер предложил уравнение, которое можно использовать для описания поведения электрона в атоме:
-(h2/8π2m)*[(υ2ψ/υx2)+ (υ2ψ/υy2)+( υ2ψ/υz2)]+Vψ=Eψ
Hψ=Eψ
Ψ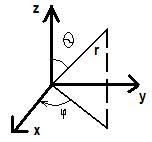 2
– вероятность нахождения электрона в
данной точке пространства.
2
– вероятность нахождения электрона в
данной точке пространства.
Точное решение уравнения Шредингера является очень сложной задачей, но приближенные методы решения позволяют получить ряд важных результатов.
Если взять определенный вектор и проекцию этого вектора на плоскости ху, то вектор можно охарактеризовать тремя величинами: углом θ, углом φ и r, т.е. получается, функция зависит от 3 переменных: θ, φ, r.
Обычно эту функцию делят на 2 составляющее, одна из которых зависит от r, другая от θ и φ. И называют их соответственнорадиальная и угловая составляющие, т.е. чтобы охарактеризовать наиболее вероятное положение электрона в атоме, необходимо знать 3 некоторых переменных.
Эти переменные получили название квантовых чисел:
1. Главное квантовое число – n. Принимает значения от 1 до +∞;
2. Орбитальное или побочное число – l. Принимает значения от 0 до -1;
3. mL, принимает значения от –l до +l.
В последствии к этим 3-м числам было добавлено спиновое квантовое число. Соответственно, принимающее 2 значения: mL = -1/2, mL = +1/2.
Используя знания этих чисел, можно рассчитать, каким образом будут заполняться электронные оболочки атома.
36. Ква́нтовое число́ в квантовой механике — численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние частицы. Задание квантовых чисел полностью характеризует состояние частицы.
Некоторые
квантовые числа связаны с движением в
пространстве и характеризуют вид волновой
функции частицы.
Это, например, радиальное
(главное) (![]() ),орбитальное (
),орбитальное (![]() ), магнитное (
), магнитное (![]() )
и спиновое
число квантовые
числа электрона в атоме, которые
определяются как число узлов радиальной
волновой функции, значение орбитального
углового момента, его проекция на
заданную ось и спин частицы, соответственно.
)
и спиновое
число квантовые
числа электрона в атоме, которые
определяются как число узлов радиальной
волновой функции, значение орбитального
углового момента, его проекция на
заданную ось и спин частицы, соответственно.
Некоторые другие квантовые числа никак не связаны с перемещением в обычном пространстве, а отражают «внутреннее» состояние частицы. К таким квантовым числам относится спин и его проекция. В ядерной физике вводится также изоспин, а в физике элементарных частиц появляется цвет, очарование, прелесть (или красота[1]) иистинность.
При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии.
Полное обобщённое доказательство принципа было сделано им в теореме Паули (теореме о связи спина со статистикой) . Из этой теоремы следовало, что волновая функция системы фермионов является антисимметричной относительно их перестановок, поведение систем таких частиц описывается статистикой Ферми — Дирака.
Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы, в данном квантовом состоянии, может находиться только один фермион, состояние другого должно отличаться хотя бы одним квантовым числом.
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
