
- •9. I. Первый закон термодинамики
- •Термодинамические потенциалы
- •12. Зависимость скорости реакции от температуры. Энергия активации
- •13. Кинетика - это раздел химии, изучающий скорость, механизм химических реакций и влияние на них различных факторов.
- •Ферментативный катализ
- •Способы выражения концентрации растворов
- •19. Свойства растворов неэлектролитов
- •21. Электролиты – вещества, растворы или расплавы которых проводят электрический ток.
- •22. Слабые электролиты в водных растворах лишь частично (обратимо) диссоциируют на ионы.
- •Роль концентрации водородных ионов в биологических процессах
- •24. Буферные системы
- •Компоненты: н2со3 /нсо3–
- •26. Типы гидролиза солей
- •Эдс гальванического элемента
- •1) Разряд водородных ионов по реакции: 2) восстановление растворенного кислорода:
- •Водородной деполяризацией
- •Кислородная деполяризация
- •Квантово – механическая модель строения атома
- •Правило Клечковского
- •Строение молекул
- •44. Кратные связи
- •Сигма- и пи-связи
- •Длина связи
- •Энергия связи
- •Классификация анионов и групповые реагенты
1.Химия, наука, изучающая строение веществ и их превращения, сопровождающиеся изменением состава и(или) строения. Хим. свойства веществ определяются гл. обр. состоянием внеш. электронных оболочек атомов и молекул. образующих вещества; состояния ядер и внутр. электронов в хим. процессах почти не изменяются. Объектом хим. исследований являются элементы химические и их комбинации, т. е. атомы, простые (одноэлементные) и сложные (молекулы, ионы. ион-радикалы, карбены, свободные радикалы) хим. соед
Приведем несколько актуальных направлений применения химии:
1. Получение электроэнергии, путем преобразования химической энергии природного топлива;
2. Получение топлива;
3. Получение металлов;
4. Получение синтетических материалов: пластмасс, каучуков, волокон, пленок, термостойких пластиков, композиционных полимеров;
5. Получение материалов с особыми свойствами для новой техники (телевизионной техники, систем связи и информационных систем): сверхчистых, сверхтвердых, сверхпроводящих, жаростойких и т.п. Такие материалы поставляет современная химическая промышленность, поэтому можно понять важность изучения химии для любой специальности;
6. Получение продуктов питания;
7. Повышение урожайности сельскохозяйственных культур и экономия сельскохозяйственного сырья;
8. Охрана окружающей среды: разработка методов обнаружения и количественного определения вредных примесей, создание безотходных или малоотходных производств, разработка способов обезвреживания и утилизации промышленных и бытовых отходов и т.п.
значение химии в жизни человека трудно переоценить. химия оказывает своё созидательное воздействие на жизнь людей.
1. Именно химические процессы, многие тайны которых учёные ещё не раскрыли, ответственны за тот гигантский переход от неживой материи к простейшим одноклеточным, и далее к вершине современного эволюционного процесса - человеку.
2. Большинство материальных потребностей, обслуживается природной химией или получает удовлетворение в результате использования в производстве химических процессов.
3. устремления людей в своей основе опираются на химию человеческого организма, и, в частности, сильно зависят от химических процессов в мозге человека.
Химия как наука, представляет собой определяющий фактор развития человеческой цивилизации.
2. Законы сохранения массы и энергии.
Закон сохранения массы. Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения энергии. Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в строго эквивалентных соотношениях.
Закон постоянства состава.(1807 г, Ж. Пруст и К. Л. Бертолле)
Каждое химически чистое соединение всегда имеет один и тот же количественный состав независимо от способов его получения.
В 1912-1913 гг. Н.С. Курнаков установил, что существуют соединения переменного состава, которые называют бертоллидами. Соединения постоянного состава называют дальтонидами.
В связи с наличием соединений переменного состава современная формулировка закона постоянства состава содержит уточнения:
Состав соединений молекулярного строения, то есть состоящих из молекул, является постоянным независимо от способа получения.
Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
Эквивалентом вещества считается такое его количество, которое соединяется с одним молем атомов Н или замещает то же количество атомов Н в хим. реакциях. Эквивалентной же массой считают массу одного эквивалента вещества. При вычисления эквивалента (или эквивалентной массы) элемента можно не исходить из его соединения с Н. Эквивалент (эквивалентную массу) легко определить по составу соединения данного элемента с каким либо другим, эквивалент которого считается известным.
Их законов эквивалентов вытекают выражения , по которым можно определить эквивалентные массы сложных веществ:
Э оксида = М оксида / (Число атомов элемента х валентность элемента)
Э кислоты = М кислоты / Основность кислоты
Э основания = М основания / Кислотность основания
Где М - мольная масса соединений
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.
Фактор
эквивалентности:Отношение
эквивалентной молярной массы к его
собственной молярной массе
называется фактором
эквивалентности (обозначается
обычно как ![]() ).
).
|
Формула |
Название |
Формула |
Название |
|
CO |
оксид углерода (II) |
Fe2O3 |
оксид железа (III ) |
|
NO |
оксид азота ( II ) |
CrO3 |
оксид хрома (VI ) |
|
N2O5 |
оксид азота (V ) |
Mn2O7 |
оксид марганца (VII ) |
|
Оксиды металлов МехОу |
Оксиды неметалловнеМехОу |
|||
|
Основные |
Кислотные |
Амфотерные |
Кислотные |
Безразличные |
|
I, II Ме |
V-VII Me |
ZnO,BeO,Al2O3,Fe2O3 |
> II неМе |
I, II неМе CO, NO, N2O |
Называются они просто - "оксид + название элемента" (см. таблицу). Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента.
Классификация оксидов: Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие (NO, N2O, CO и др)
1). Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов 1 и 2 групп, а такжеметаллов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид берилия): СaO, Na2O,CrO, MnO/
2). Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов Например:CO2,P2O5, SO3( кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например , CrO3-оксид хрома (VI), Mn 2O7 - оксид марганца (VII))
3). Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III, иногда IV, а также цинк и бериллий (Например, BeO, ZnO,Al2O3, Cr2O3).
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II(Например, N2O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:CrO (II - основный);Cr 2O3 (III - амфотерный);CrO3 (VII - кислотный).
Классификация оксидов(по растворимости в воде)
|
Кислотные оксиды |
Основные оксиды |
Амфотерные оксиды |
|
Растворимы в воде. Исключение –SiO2 (не растворим в воде) |
В воде растворяются только оксиды щелочных и щелочноземельных металлов (это металлы I «А» и II «А» групп, исключение Be ,Mg) |
С водой не взаимодействуют. В воде не растворимы |
4. Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.

Классификация кислот:
.Кислородсодержащие
.Бескислородные
1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
2. По составу:а) Таблица кислород содержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
|
Кислота (НnА) |
Кислотный остаток (А) |
Соответствующий кислотный оксид |
|
HClO4 хлорная |
ClO4 (I) перхлорат |
Cl2O7 оксид хлора (VII ) |
|
H2SO4 серная |
SO4 (II) сульфат |
SO3 оксид серы (VI ), серный ангидрид |
|
HNO3 азотная |
NO3 (I) нитрат |
N2O5 оксид азота ( V ) |
|
HMnO4 марганцевая |
MnO4 (I)перманганат |
Mn2O7 оксид марганца (VII ) |
|
H2SO3 сернистая |
SO3 (II) сульфит |
SO2 оксид серы (IV ) |
|
H3PO4ортофосфорная |
PO4 (III) ортофосфат |
P2O5 оксид фосфора (V ) |
|
HNO2 азотистая |
NO2 (I) нитрит |
N2O3 оксид азота (III ) |
|
H2CO3 угольная |
CO3 (II) карбонат |
CO2 оксид углерода ( IV), углекислый газ |
|
H2SiO3 кремниевая |
SiO3 (II) силикат |
SiO2 оксид кремния (IV) |
б) Таблица бескислородных кислот
|
Кислота (НnА) |
Кислотный остатокА |
|
HCl соляная, хлороводородная |
Cl (I) хлорид |
|
H2S сероводородная |
S(II) сульфид |
|
HBr бромоводородная |
Br (I) бромид |
|
HI йодоводородная |
I(I) йодид |
|
HF фтороводородная,плавиковая |
F(I) фторид |
Физические свойства кислот.Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорнаяHPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.
Способы получения кислот
|
бескислородные |
кислородсодержащие |
|
HCl, HBr, HI, HF, H2S |
HNO3, H2SO4 и другие |
|
ПОЛУЧЕНИЕ |
|
|
1. Прямое взаимодействие неметаллов H2 + Cl2 = 2 HCl |
1. Кислотный оксид + вода = кислота SO3 + H2O = H2SO4 |
|
2. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl |
|
Химические свойства кислот
. Изменяют окраску индекаторов
|
Название индикатора |
Нейтральная среда |
Кислая среда |
|
Лакмус |
Фиолетовый |
Красный |
|
Фенолфталеин |
Бесцветный |
Бесцветный |
|
Метилоранж |
Оранжевый |
Красный |
|
Универсальная индикаторная бумага |
Оранжевая |
Красная |
2.Реагируют с металлами в ряду активности до H2
(искл. HNO3 –азотная кислота)
Ме + КИСЛОТА =СОЛЬ + H2↑ (р. замещения)

3. С основными (амфотерными) оксидами – оксидами металлов
МехОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена)
CuO + H2SO4 = Cu SO4 + H2O
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена)
H3PO4 + 3NaOH = Na3PO4 + 3H2
5. Реагируют с солями слабых, летучих кислот - если образуется кислота, выпадающая в осадок или выделяется газ:
2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl↑ ( р. обмена)
|
Сила кислот убывает в ряду: HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2 >H2CO3 > H2S > H2SiO3 . Каждая предыдущая кислота может вытеснить из соли последующую |
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду:
H2CO3 ↔ H2O + CO2↑
H2SO3 ↔ H2O + SO2↑
Сероводородная кислота в продуктах выделяется в виде газа: СаS + 2HCl = H2S↑ + CaCl2
5. Основания – сложные вещества, состоящие из атома металла и одной или нескольких гидроксильных групп.Общая формула оснований Ме(ОН)n. Основания (с точки зрения теории электролитической диссоциации) – это электролиты, диссоциирующие при растворении в воде с образованием катионов металла и гидроксид-ионов ОН–.
Классификация. По растворимости в воде основания делят на щелочи (растворимые в воде основания) и нерастворимые в воде основания. Щелочи образуют щелочные и щелочно-земельные металлы, а также некоторые другие элементы-металлы. По кислотности (числу ионов ОН–, образующихся при полной диссоциации, или количеству ступеней диссоциации) основания подразделяют на однокислотные (при полной диссоциации получается один ион ОН–; одна ступень диссоциации) и многокислотные (при полной диссоциации получается больше одного иона ОН–; более одной ступени диссоциации). Среди многокислотных оснований различают двухкислотные (например, Sn(OH)2), трехкислотные (Fe(OH)3) и четырехкислотные (Th(OH)4). Однокислотным является, например, основание КОН.
Выделяют группу гидроксидов, которые проявляют химическую двойственность. Они взаимодействую как с основаниями, так и с кислотами. Это амфотерные гидроксиды (см. таблицу 1).
Амфотерные гидроксиды
|
Амфотерный гидроксид (основная и кислотная форма) |
Кислотный остаток и его валентность |
Комплексный ион |
|
Zn(OH)2 / H2ZnO2 |
ZnO2 (II) |
[Zn(OH)4]2– |
|
Al(OH)3 / HAlO2 |
AlO2 (I) |
[Al(OH)4]–, [Al(OH)6]3– |
|
Be(OH)2 / H2BeO2 |
BeO2 (II) |
[Be(OH)4]2– |
|
Sn(OH)2 / H2SnO2 |
SnO2 (II) |
[Sn(OH)4]2– |
|
Pb(OH)2 / H2PbO2 |
PbO2 (II) |
[Pb(OH)4]2– |
|
Fe(OH)3 / HFeO2 |
FeO2 (I) |
[Fe(OH)4]–, [Fe(OH)6]3– |
|
Cr(OH)3 / HCrO2 |
CrO2 (I) |
[Cr(OH)4]–, [Cr(OH)6]3– |
Физические свойства. Основания - твердые вещества различных цветов и различной растворимости в воде.
Химические свойства оснований
1) Диссоциация:
КОН + nН2О ![]() К+mН2О
+ ОН–dН2О или сокращенно: КОН
К+mН2О
+ ОН–dН2О или сокращенно: КОН![]() К+ +
ОН–.
К+ +
ОН–.
Многокислотные основания диссоциируют по нескольким ступеням (в основном диссоциация протекает по первой ступени). Например, двухкислотное основание Fe(OH)2 диссоциирует по двум ступеням:
Fe(OH)2![]() FeOH+ +
OH– (1 ступень);
FeOH+ +
OH– (1 ступень);
FeOH+![]() Fe2+ +
OH– (2 ступень).
Fe2+ +
OH– (2 ступень).
2) Взаимодействие с индикаторами (щелочи окрашивают фиолетовый лакмус в синий цвет, метилоранж – в желтый, а фенолфталеин – в малиновый):
индикатор
+ ОН– (щелочь) ![]() окрашенное
соединение.
окрашенное
соединение.
3) Разложение с образованием оксида и воды (см. таблицу 2). Гидроксиды щелочных металлов устойчивы к нагреванию (плавятся без разложения). Гидроксиды щелочно-земельных и тяжелых металлов обычно легко разлагаются. Исключение составляет Ba(OH)2, у которого tразл достаточно высока (примерно 1000 °C).
Zn(OH)2 ![]() ZnO
+ H2O.
ZnO
+ H2O.
Таблица 2 - Температуры разложения некоторых гидроксидов металлов
|
Гидроксид |
tразл, °C |
Гидроксид |
tразл, °C |
Гидроксид |
tразл, °C |
|
LiOH |
925 |
Cd(OH)2 |
130 |
Au(OH)3 |
150 |
|
Be(OH)2 |
130 |
Pb(OH)2 |
145 |
Al(OH)3 |
>300 |
|
Ca(OH)2 |
580 |
Fe(OH)2 |
150 |
Fe(OH)3 |
500 |
|
Sr(OH)2 |
535 |
Zn(OH)2 |
125 |
Bi(OH)3 |
100 |
|
Ba(OH)2 |
1000 |
Ni(OH)2 |
230 |
In(OH)3 |
150 |
4) Взаимодействие щелочей с некоторыми металлами (например, Al и Zn):
В растворе: 2Al + 2NaOH + 6H2O 2Na[Al(OH)4] + 3H2
2Al + 2OH– + 6H2О 2[Al(OH)4]– + 3H2.
При
сплавлении: 2Al + 2NaOH + 2H2O ![]() 2NaAlО2 +
3H2
2NaAlО2 +
3H2
5) Взаимодействие щелочей с неметаллами:
6NaOH + 3Cl2 ![]() 5NaCl
+ NaClO3 + 3H2O.
5NaCl
+ NaClO3 + 3H2O.
6) Взаимодействие щелочей с кислотными и амфотерными оксидами:
2NaOH + СО2 Na2CO3 + H2O 2OH– + CO2 CO32– + H2O.
В растворе: 2NaOH + ZnO + H2O Na2[Zn(OH)4] 2OH– + ZnO + H2О [Zn(OH)4]2–.
При
сплавлении с амфотерным
оксидом: 2NaOH + ZnO ![]() Na2ZnO2 + H2O.
Na2ZnO2 + H2O.
7) Взаимодействие оснований с кислотами:
H2SO4 + Ca(OH)2 CaSO4 + 2H2O 2H+ + SO42– + Ca2+ +2OH– CaSO4 + 2H2O
H2SO4 + Zn(OH)2 ZnSO4 + 2H2O 2H+ + Zn(OH)2 Zn2+ + 2H2O.
8) Взаимодействие щелочей с амфотерными гидроксидами (см. таблицу 1):
В растворе: 2NaOH + Zn(OH)2 Na2[Zn(OH)4] 2OH– + Zn(OH)2 [Zn(OH)4]2–
При
сплавлении: 2NaOH + Zn(OH)2 ![]() Na2ZnO2 + 2H2O.
Na2ZnO2 + 2H2O.
9) Взаимодействие щелочей с солями. В реакцию вступают соли, которым соответствует нерастворимое в воде основание:
CuSО4 + 2NaOH Na2SO4 + Cu(OH)2 Cu2+ + 2OH– Cu(OH)2.
Получение. Нерастворимые в воде основания получают путем взаимодействия соответствующей соли со щелочью:
2NaOH + ZnSО4 Na2SO4 + Zn(OH)2 Zn2+ + 2OH– Zn(OH)2.
Щелочи получают:
1) Взаимодействием оксида металла с водой:
Na2O + H2O 2NaOH CaO + H2O Ca(OH)2.
2) Взаимодействием щелочных и щелочно-земельных металлов с водой:
2Na + H2O 2NaOH + H2 Ca + 2H2O Ca(OH)2 + H2.
3) Электролизом растворов солей:
2NaCl
+ 2H2O ![]() H2+
2NaOH + Cl2
H2+
2NaOH + Cl2
4) Обменным взаимодействием гидроксидов щелочно-земельных металлов с некоторыми солями. В ходе реакции должна обязательно получаться нерастворимая соль.
Ba(OH)2 + Na2CO3 2NaOH + BaCO3 Ba2+ + CO32– BaCO3.
6. Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO4 – сульфат кальция и т. д.
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na+Cl– – хлорид натрия
Ca2+SO42– – сульфат кальция и т.д.
Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na2CO3, KNO3 и т.д. 2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO3, NaH2PO4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO3, KAl(SO4)2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO4 , Zn(OH)Cl и т.д.
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента.Например, соли серной кислоты называются сульфатами: СаSO4 – сульфат кальция, Mg SO4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl3)2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH2PO4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO3 = CaO + CO2↑
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H2 SO4 → Na2SO4 + 2HCl↑.
3. Взаимодействуют с основаниями, образуя новую соль и новое основание:
Ba(OH)2 + Mg SO4 → BaSO4↓ + Mg(OH)2.
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO3 → AgCl + NaNO3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO4 → FeSO4 + Cu↓.
7. Современное определение физической химии – это наука, объясняющая химические явления и устанавливающая их общие закономерности на основе принципов физики и с использованием физических экспериментальных методов.
Важнейшая проблема современной физической химии – установление связи между строением вещества и его реакционной способностью. Первый учебник по физической химии был издан Нернстом в 1893 году, он назывался “Теоретическая химия на основе правила Авогадро и термодинамики”.
При изучении физико-химических явлений применяют следующие методы:
Квантово-механический метод, использующий понятие дискретности энергии, а также другие ее свойства, относящиеся к элементарным частицам;
Термодинамический (феноменологический) метод, основанный на нескольких законах, обобщающих опытные данные. Он позволяет выяснить свойства системы, не используя сведения о строении молекул или механизме процессов;
Статистический метод, объясняющий свойства веществ, состоящих из большого числа частиц (макроскопические свойства), исходя из свойств отдельных частиц (микроскопические свойства) и их распределения в соответствии с теорией вероятности.
Основными разделами физической химии являются:
1. строение вещества;
2. химическая термодинамика (сюда включаются три закона термодинамики, учение о химическом и фазовом равновесии, учение о растворах);
3. электрохимия;
4. химическая кинетика и катализ
Термин термодинамика был введен в середине XIX века и происходит от двух греческих слов “термо” – температура и “динамика” – работа. Химическая термодинамикаизучает законы взаимного превращения различных видов энергии, состояние равновесия, а также возможность, направление и предел протекания самопроизвольных процессов. Вопрос о скорости протекания химических процессов термодинамика не рассматривает. Химическая термодинамика основана на трех законах (постулатах), иначе называемых началами термодинамики. Эти законы не доказываются, а являются обобщением множества опытных данных, накопленных человечеством. На основе этих законов получены многочисленные следствия, которые лежат в основе строгого описания окружающего нас мира.
Термодинамическая система – это совокупность материальных объектов, выбранных нами произвольно для изучения, которая отделена от всего окружающего (называемого внешней средой) некоторой границей (условной или реальной).
Изолированная система – это система, которая не может обмениваться с окружающей средой ни веществом, ни энергией и имеет постоянный объем.
Закрытая система – это система, которая не может обмениваться с окружающей средой веществом (т.е. имеет постоянную массу), но может обмениваться энергией (в форме теплоты или работы).
Открытая система – это система, которая может обмениваться с окружающей средой и веществом, и энергией.
Кроме того, системы могут быть гомогенными (однородными), которые состоят из одной фазы, и гетерогенными(неоднородными), состоящими из двух или более фаз.
Термодинамические параметры состояния системы–(температура, объем, давление и т.д.) – это определенные измеряемые свойства системы, характеризующие ее состояние.
Состояние системы–это совокупность термодинамических параметров системы.
Параметры состояния связаны между собой (в явном или неявном виде) так называемым уравнением состояния. Например, для идеального газа уравнением состояния является уравнение Менделеева-Клапейрона, которое для 1 моль газа имеет вид: pV = RT,
Различают: экстенсивные и интенсивные свойства
1. Экстенсивные свойства, зависят от массы системы (V, m, U, H и т. д.) и обладают аддитивностью: свойство системы равно сумме свойств ее частей.
2. Интенсивные свойства, не зависят от массы системы (T, p, m, r и т. д.). Эти свойства не суммируются, а выравниваются.
Важными в термодинамике являются понятия функции состояния и функции процесса.
Функция состояния – это такое термодинамическое свойство системы, величина которого целиком определяется данным состоянием системы, а ее изменение в каком-либо процессе (т.е. при переходе системы из одного состояния в другое) не зависит от пути перехода, а определяется только конечным и начальным состоянием.
Примеры функций состояния: внутренняя энергия U, энтальпия Н = U + pV, энтропия S, энергия Гельмгольца F= U - TS, энергия Гиббса G = H - TS.
Функция состояния Z обладает следующими свойствами:
1. Пусть Z = Z(х,у), тогда dZ – бесконечно малое изменение функции Z – является полным дифференциалом, что можно записать математически:
![]()
2. ![]() .
Т.е. определенный интеграл от полного
дифференциала dZ не зависит от пути
интегрирования.
.
Т.е. определенный интеграл от полного
дифференциала dZ не зависит от пути
интегрирования.
3. ![]() .
Интеграл по замкнутому контуру от dZ
равен нулю.
.
Интеграл по замкнутому контуру от dZ
равен нулю.
Функции процесса (F) зависят от пути перехода из одного состояния в другое. Они не имеют полного дифференциала. Их бесконечно малую величину (количество) обозначают dF, причем
![]() и
и ![]() .
.
Функциями процесса являются например работа (А) и теплота (Q).
Термодинамический процесс–это изменение состояния системы, сопровождающееся изменением хотя бы одного из параметров состояния (свойств системы).
Изменение состояния системы может происходить при различных условиях, поэтому различают:
1) Равновесные и неравновесные процессы.
Равновесные процессы- это процессы, проходящие через непрерывный ряд равновесных состояний.
Равновесное состояние системы – состояние, не изменяющееся во времени и не требующее для своего поддержания воздействия каких-либо внешних факторов.
Неравновесные процессы — это процессы, после протекания которых систему нельзя вернуть в исходное состояние без того, чтобы в ней не осталось каких-либо изменений..
2). Обратимые и необратимые процессы.
Обратимые процессы –это процессы при протекании которых система возвращается в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения. В противном случае процессы будут необратимыми.
В дальнейшем часто можно считать понятия обратимого и равновесного процесса совпадающими
3). Самопроизвольные и несамопроизвольные процессы.
Самопроизвольные – процессы, происходящие сами собой не требующие затраты энергии извне и приближающие систему к равновесию.
Несамопроизвольные – процессы, требующие затраты энергии извне.
Отметим некоторые частные виды процессов, с которыми в дальнейшем придётся иметь дело:
а) изотермический (T = const);
б) изобарный (p = const);
в) изохорный (V = const);
г) адиабатический (нет обмена теплотой между системой и окружающей средой);
д) изобарно-изотермический (p = const, T = const);
е) изохорно-изотермический (V = const, T = const).
Химическая реакция – это разновидность процесса, при котором наблюдается изменение химического состава системы.
Рассмотрим ещё некоторые понятия.
Энергия – мера способности системы совершать работу.
Внутренней энергией системы называется сумма всех видов энергии, за исключением кинетической энергии системы в целом и ее потенциальной энергии положения.
Полная энергия системы равна сумме ее внутренней энергии, кинетической и потенциальной энергии системы как целого.
За энергию системы в термодинамике принимается ее внутренняя энергия. Внутренняя энергия обозначается символом U. Внутренняя энергия является. экстенсивным свойством системы. Можно определить только изменение внутренней энергии в результате того или иного процесса (DU).В равновесном состоянии система обладает определённым запасом энергии, поэтому внутренняя энергия является функцией состояния.
Работа и теплота – две возможные формы передачи энергии от одной системы к другой.
В случае работы энергия передается путем согласованного, упорядоченного, движения частиц.
Работа обозначается символом A, при этом работа положительна (А > 0), если она совершается системой против внешних сил, и отрицательна (А < 0), если она выполняется над системой
В случае теплоты – энергия передается путем хаотического движения частиц тела.
Теплота обозначается символом Q, при этом она положительна (Q > 0), если теплота поступает в систему (такой процесс называется эндотермическим), и отрицательна (Q< 0), если теплота отводится из системы (такой процесс называется экзотермическим).
В равновесном состоянии система не обладает ни запасом теплоты, ни запасом работы, поэтому Q и A являются функциями процесса. Передача теплоты или совершение работы осуществляются лишь при взаимодействии системы с внешней средой или другой системой.
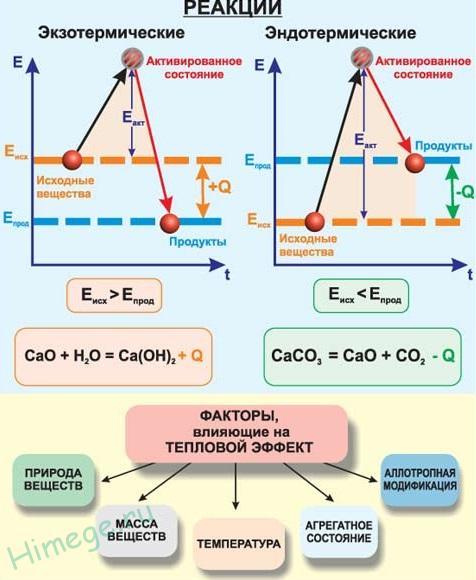
8. При протекании любых химических реакций происходит разрыв химических связей между атомами в молекулах одних веществ и образование химических связей между атомами в молекулах других веществ. Разрыв химических связей связан с затратами энергии, а образование новых химических связей приводит к выделению энергии. Суммы энергий всех разорванных и всех образованных связей не являются равными, поэтому все реакции проходят либо с выделением, либо с поглощением энергии. Энергия может выделяться или поглощаться в виде звуковых волн, света, работы расширения или сжатия и т.п. В большинстве случаев энергия химической реакции выделяется или поглощается в виде тепла. Выделение или поглощение теплоты при протекании химической реакции называют тепловым эффектом реакции и обозначают буквой Q.
Реакции, при протекании которых теплота выделяется и передается окружающей среде, называютэкзотермическими, а те, при протекании которых теплота поглощается из окружающей среды, называют эндотермическими. Экзотермическим реакциям отвечает положительный тепловой эффект +Q, а эндотермическим – отрицательный тепловой эффект -Q .
Уравнения химических реакций, в которых приведен тепловой эффект реакции, называюттермохимическими. В термохимических уравнениях указывают агрегатное состояние веществ (кристаллическое, жидкое, газообразное и т. д.) и могут стоять дробные коэффициенты. Тепловой эффект реакции зависит от температуры и давления, поэтому, как правило, его приводят для стандартных условий, т. е. температуры 298 К и давления 101,3 кПа.
Тепловой эффект химической реакции рассчитывают по термохимическому уравнению. Представленное ниже термохимическое уравнение реакции сгорания водорода в кислороде: H2(г) + 1/2 O2(г) = H2О(ж) + 286 кДж показывает, что на 1 моль сгоревшего водорода или на 1 моль образовавшейся воды выделяется 286 кДж теплоты (Q = 286 кДж, Δ Н= -286 кДж). Эта реакция является экзотермической и характеризуется значительным тепловым эффектом. Недаром водород считается эффективным топливом будущего.
При образовании любого соединения выделяется (поглощается) столько же энергии, сколько поглощается (выделяется) при его распаде на исходные вещества. Поэтому реакция разложения воды электрическим током требует затрат энергии и является эндотермической: H2О(ж) = H2(г) + 1/2 O2(г) – 286 кДж (ΔH1 = + 286 кДж). Это является следствием закона сохранения энергии.
Этот закон гласит: тепловой эффект химической реакции зависит только от начального и конечного состояний веществ и не зависит от промежуточных стадий процесса.
Например, тепловой эффект реакции окисления углерода (графит) в оксид углерода (IV) не зависит от того, проводится ли это окисление в одну стадию (при непосредственном сжигании углерода) до углекислого газа:
С(тв) + О2 (г) = СО2 (г) , ΔH1 реакция 1,
или реакция протекает через промежуточную стадию образования оксида углерода (II):
С(тв) + ½О2 (г) = СО (г) , ΔH2 реакция 2
с последующим дожиганием угарного газа в углекислый газ:
СО (г) + ½О2 (г) = СО2 (г) , ΔH3 реакция 3.
При обоих способах проведения процесса система переходит из одного и того же начального состояния (графит) в одно и то же конечное состояние оксид углерода (IV). В соответствии с законом Гесса тепловой эффект реакции 1 равен сумме тепловых эффектов реакций 2 и 3:
ΔH1= ΔH2 + ΔH3.
Используя закон Гесса можно вычислить тепловой эффект промежуточной стадии реакции, если известны общий тепловой эффект реакции и тепловые эффекты других ее промежуточных стадий.
Пример решения задачи на тепловой эффект. Реакция окисления глюкозы в организме может протекать так:
С6Н12О6 (тв) + 6О2 (г) = 6СО2 (г) + 6Н2О (ж) + 2803 кДж.
Какое количество теплоты выделится при окислении 800 г глюкозы?
Решение.
М (С6Н12О6) = 180 г/моль.
ν(С6Н12О6) =m/M = 800г/180 г/моль = 4,44 моль.
Q1 = ν(С6Н12О6) · Q = 4,44 · 2803 = 12458 кДж.
Ответ. В результате окисления указанного количества глюкозы выделяется 12 458 кДж теплоты.
9. I. Первый закон термодинамики
Первый закон термодинамики (первое начало термодинамики): энергия не возникает из ничего и не исчезает бесследно, а переходит из одного вида энергии в другой
илиприращение внутренней энергии системы в некотором процессе равно теплоте, полученной системой, плюс работа, совершенная над системой.∆U=Q+A ∆U - внутренняя энергия, Q – теплота , A - работа
Термохимия – это раздел термодинамики, изучающий теплоты протекания химических реакций.
Закон Гесса:теплота химической реакции, протекающей при постоянном давлении или объёме, не зависит от пути процесса, а только от начального и конечного состояний системы.
Напримерсуммарная теплота биологического окисления продуктов питания в организме, равна теплоте их прямого сгорания.
Энтальпия-это функция состояния, приращение которой равно тепловому эффекту процесса, протекающего при постоянном давлении.
1) По стандартным энтальпиям (теплотам) образования веществ
Стандартная энтальпия (теплота) образования вещества – это тепловой эффект реакции образования 1 моль химического соединения из простых веществ в стандартных условиях: Т=289 К, Р=1 атм=101325 Па.
Теплоты образования простых веществ равны нулю.
νi , νj – стехиометрические коэффициенты перед соответствующими веществами в уравнении реакции.
2) По стандартным энтальпиям (теплотам) сгорания веществ
Стандартная энтальпия (теплота) сгорания вещества – это тепловой эффект реакции полного сгорания 1 моль химического соединения в стандартных условиях.
Теплоты сгорания высших оксидов (в том числе СО2 и Н2О) приняты равными нулю.
Второй закон термодинамики устанавливает возможность, направление и глубину протекания самопроизвольного процесса.
Самопроизвольный процесс - процесс, протекающий без каких-либо воздействий извне, и приближающий систему к состоянию равновесия.
Имеется и другой критерий самопроизвольного протекания процесса – энтропия (S).
Энтропия - мера энергетического беспорядка в системе, мера хаоса, мера той энергии, которая рассеивается в виде тепла и не превращается в работу.
10. Второй закон определяет, какие из процессов в рассматриваемой системе при заданных температуре, давлении, концентрациях могут протекать самопроизвольно,то есть без затраты работы извне; каково количество работы, которая может быть получена при этом, и каков предел возможного самопроизвольного течения процессов.
Несамопроизвольные процессы не могут осуществляться без воздействия извне, само воздействие извне может быть в виде передачи системе энергии из окружающей среды (переход тепла от холодного тела к горячему - процессы в холодильнике).
В отличие от первого закона термодинамики, второй закон обладает более ограниченной областью применения, он носит статистическийхарактер, то есть, применим к системам из большого числа частиц, поведение которых может быть выражено законами статики.
Чем больше тепла выделяется при экзотермических реакциях, тем большим сродством друг к другу обладают реагирующие вещества, тем прочнее связи в полученных продуктах. В обратном направлении процесс может пойти лишь при сообщении системе тепла извне.
Для любой термодинамической системы при данных условиях её существования всегда имеется некоторый общий критерий, которым характеризуется возможность, направление и предел самопроизвольного протекания процессов. Для изолированных систем критерием является энтропия (S).Термин был введен Рудольф Клаузиусом (1822-1888).
Любая система стремится к уменьшению величины ∆H и увеличению величины ∆S. Второй закон термодинамики устанавливает, чтов изолированных системах самопроизвольно могут совершаться только такие процессы, при которых энтропия системы возрастает, и процесс может идти самопроизвольно до такого состояния, при котором энтропия обладает максимальным для данных условий значением.
Изменение энтропии в процессе зависит от начального и конечного состояний и не зависит от пути перехода
∆Sх.р.= ∑Sпрод. - ∑Sисх.в-в.
Энтропия- термодинамическая функция, которая характеризует меру упорядоченности системы или меру беспорядка.
Изменение
энтропии ∆S наиболее
просто определяется для обратимых
изотермических процессов, оно равняется
тепловому эффекту процесса, делённому
на абсолютную температуру ![]() Например,
при 0°С, то есть при 273 К, теплота плавления
льда ∆Hпл =
5993,7 Дж/моль;
возрастание энтропии при плавлении
льда при этой температуре
Например,
при 0°С, то есть при 273 К, теплота плавления
льда ∆Hпл =
5993,7 Дж/моль;
возрастание энтропии при плавлении
льда при этой температуре ![]() =
21,95 Дж/моль-К.
Энтропию относят к 1 молю вещества в
стандартных условиях S°298 ;
известно абсолютное значение энтропии
для веществ; измеряют ее в энтропийных
единицах (э.е.): 1 Дж/мoль∙К = 1 э.е.
=
21,95 Дж/моль-К.
Энтропию относят к 1 молю вещества в
стандартных условиях S°298 ;
известно абсолютное значение энтропии
для веществ; измеряют ее в энтропийных
единицах (э.е.): 1 Дж/мoль∙К = 1 э.е.
Отсюда следует, что в любых изолированных системах(а в них могут совершаться только адиабатные процессы) энтропия системы сохраняет постоянное значение. Следовательно, в изолированных системахвсякий самопроизвольно протекающий процесс сопровождается возрастанием энтропии. В случае закрытых систем энтропия в ходе процесса может, как увеличиваться, так и уменьшаться. Процессы для которых: 1) ∆S > 0 - расширение газов, фазовые превращения из твердого к жидкому и газообразному состоянию, растворение кристаллических веществ; 2) ∆S < 0 – сжатие газов, конденсация и кристаллизация веществ.
Установление статистической природы второго закона дало возможность Л. Больцману в 1896 г. определить статистический смысл энтропии
S = kБ.lnW,
где kБ - постоянная Больцмана - kБ = R/NA; W- термодинамическая вероятность данного состояния системы. Термодинамическая вероятность - это число микросостояний, через которые может быть реализовано данное микросостояние. Энтропия является мерой вероятности состояния системы.
Статистическая термодинамика показывает, что энтропия может рассматриваться как сумма составляющих, относящихся к различным формам движения частиц. Различают следующие составляющие энтропии: энтропия поступательного движения молекул Sпост.; энтропия вращательного движения молекул Sвращ. ; энтропия вращательного движения атомов и атомных групп, содержащихся в молекуле, Sвн.вращ. (энтропия внутреннего вращения); энтропия колебательного движения атомов и атомных групп, содержащихся в молекуле,Sкол;; и энтропия движения электронов Sэл
S = Sпост + Sвращ + Sвн.вращ + Sкол + Sэл
Энтропия зависит от всех видов движения частиц, содержащихся в молекуле, и возрастает при всех процессах, вызываемых движением частиц: испарение, плавление, растворение, диффузия, расширение газа; возрастает при ослаблении связей между атомами в молекулах и при разрыве связей, то есть при диссоциации молекул. Наоборот, при упрочнении связей энтропия уменьшается, то есть при кристаллизации, конденсации, сжижении газов.
Энтропия увеличивается с повышением температуры и уменьшается с повышением давления. В ряду однотипных соединений абсолютная энтропия растет по мере усложнения атомов, входящих в состав молекул, а также по мере усложнения состава молекул.
|
Вещество |
Sо298, Дж/моль∙К |
Вещество |
Sо298, Дж/моль∙К |
|
HF |
173,5 |
CuO |
43,5 |
|
HCl |
186,4 |
Cu2O |
100,7 |
|
HBr |
198,1 |
CO |
197,7 |
|
|
|
CO2 |
213,6 |
Чем больше твердость вещества, тем меньше его энтропия. Например: графит - Sо298 = 5,74 Дж/моль∙К, алмаз - Sо298 = 2,37 Дж/моль∙К. Энтропия в аморфном и стеклообразном состоянии больше, чем в кристаллическом. Энтропия возрастает с увеличением дисперсности частиц вещества.
11. Все химические реакции обычно сопровождаются изменением как энтропии, так и энтальпии. Связь между энтальпией и энтропией системы устанавливает термодинамическая функция состояния, которая называется свободной энергией Гиббса или изобарно-изотермическим потенциалом (G). Она характеризует направление и предел самопроизвольного протекания процессов в изобарно-изотермических условиях (р = const и Т = const). С энтальпией и энтропией системы свободная энергия Гиббсасвязана соотношением
G = H – TS. (9)
Абсолютное значение измерить невозможно, поэтому используется изменение функции в процессе протекания того или иного процесса:
DG = DH – TDS. (10)
Свободная энергия Гиббса измеряется в кДж/моль и кДж.Физический смысл свободной энергии Гиббса: свободная энергия системы, которая может быть превращена в работу. Для простых веществ свободная энергия Гиббса принимается равной нулю.
Знак изменения свободной энергии Гиббса DG и ее величина при Р = const определяют термодинамическую устойчивость системы:
· если в химическом процессе происходит снижение свободной энергии Гиббса, т.е. DG < 0, процесс может протекать самопроизвольно, или говорят: процесс термодинамически возможен;
· если продукты реакции имеют больший термодинамический потенциал, чем исходные вещества, т.е. DG > 0, процесс протекать самопроизвольно не может, или говорят: процесс термодинамически невозможен;
· если DG = 0, то реакция может протекать как в прямом, так и в обратном направлении, т.е. реакция обратима.
Следовательно, самопроизвольные процессы при Р=const идут с уменьшением свободной энергии Гиббса. Этот вывод справедлив как для изолированных, так и для открытых систем.
Изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ, устойчивых в данных условиях, называется энергией Гиббса образования вещества DGобр., измеряется в кДж/моль.
Если вещество находится в стандартных условиях, то энергия Гиббса образования называется стандартной энергией Гиббса образования вещества (DG0обр.298). Стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю. Значения DG0обр.298 веществ приводятся в справочниках.
Изменение энергии Гиббса, как и изменение энтальпии и энтропии, не зависит от пути процесса, поэтому изменение энергииГиббса химической реакции DG равно разности между суммой энергий Гиббса образования продуктов реакции и суммой энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов:
DG0298 = S(ni.DGi0298)пр. - S(ni.D Gi0298)исх.. (11)
