
Материал к сдаче ДЗ-ХимРавн
.docУважаемые группы ХТ-307-309!
Для Вас представлены без комментариев необходимые выводы,
которые следует выучить и ПОНИМАТЬ их роль!!!
ХИМИЧЕСКАЯ РЕАКЦИЯ.
МАССИВ РЕАГЕНТОВ И ПРОДУКТОВ.
МАССИВЫ МОЛЬНЫХ ХАРАКТЕРИСТИК.
ПРОБЕГ ХИМИЧЕСКОЙ РЕАКЦИИ. ХИМИЧЕСКОЕ СРОДСТВО.
Химическая реакция. Пробег реакции.
Способы записи массивов веществ и коэффициентов.
![]()
![]()
![]()
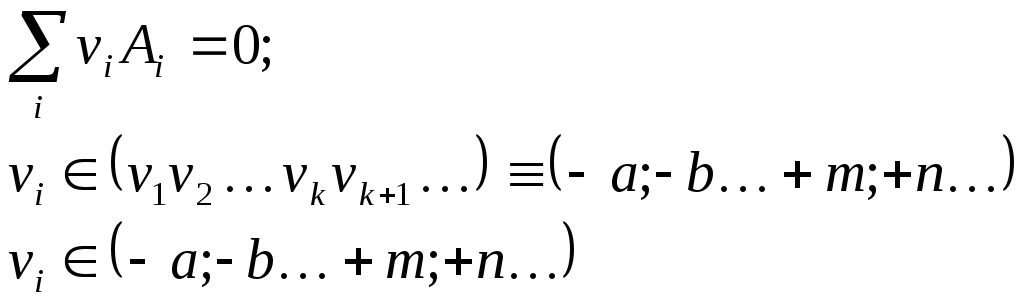
Массивы мольных величин
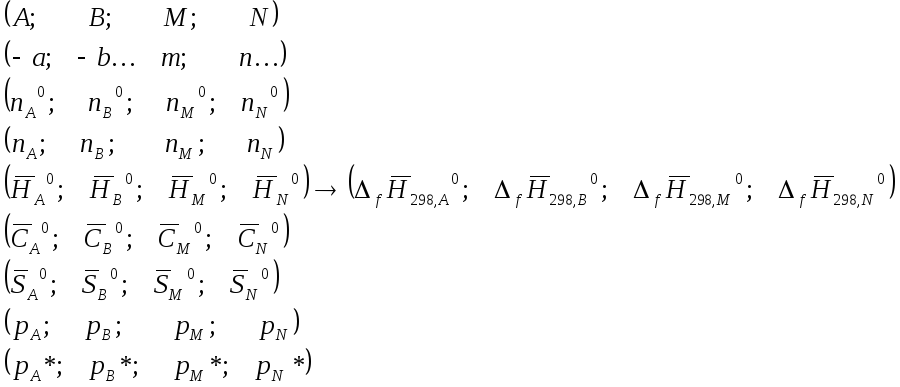
Материальный баланс реакции за пробег. Химическая переменная.
Оператор химического пробега системы.
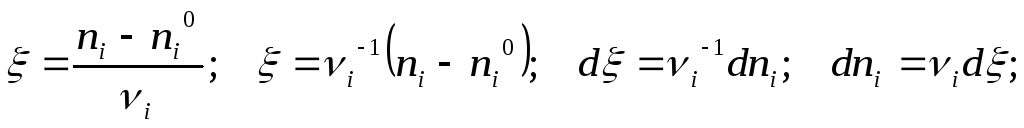
ТЕПЛОВОЙ ЭФФЕКТ ХИМИЧЕСКОЙ РЕАКЦИИ.
ЗАВИСИМОСТЬ ОТ ТЕМПЕРАТУРЫ (закон Кирхгоффа).
1. Мольная теплоёмкость вещества в практических расчётах химических равновесий обычно представлена в виде эмпирических степенных функций – усечённых рядов, которые можно объединить в виде:
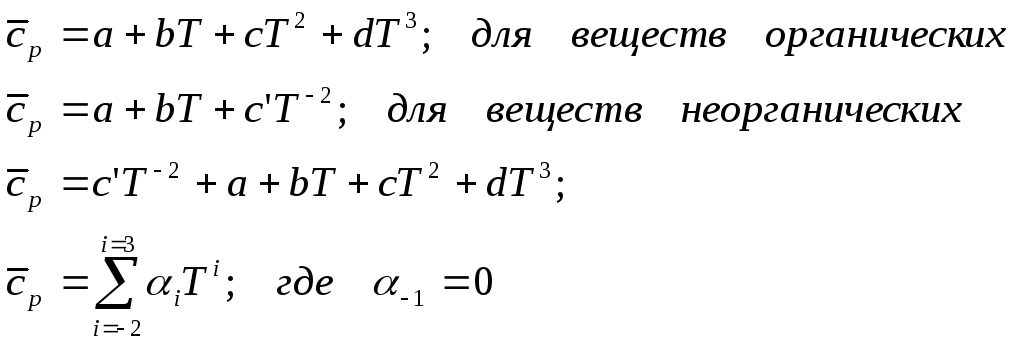
В последние годы их стали упрощённо представлять сокращёнными формулами, отбрасывая, скажем слагаемое с большими степенями температуры. На самом деле, чем больше слагаемых, тем точнее должен быть ряд. По этой причине мы ничего не выбрасываем…
Пробег химической реакции приводит к изменению состояния. Всякое изменение состояния, естественно вызывает и изменение функций состояния всей химической системы – реагирующей системы. Это изменение отражает оператор сдвига вдоль гоординаты реакции r. Он представляет собою действие, построенное в виде массива коэффициентов, каждый из которых снабжён действием умножения на . . . . А вот на что? И как действует такой комбинированный линейный оператор? Ответ прост.
Он действует так, чтобы в итоге получилось «СКАЛЯРНОЕ ПРОИЗВЕДЕНИЕ МАССИВОВ - ВЕКТОРОВ», в котором
0) БАЗИСНЫЙ МАССИВ – по сути дела РЕПЕРНЫЙ МАССИВ образован просто в виде последовательности реагентов и продуктов в нашей реакции? К примеру:
(A, B, . . . M, N)
1) Затем по ИЮПАК построен массив стехиометрических коэффициентов
(-a, -b, . . . m, n)
2) Следуя этому порядку, далее строим любые необходимые массивы МОЛЬНЫХ ВЕЛИЧИН, харктеризующих РЕАКТАНТЫ (реагенты + продукты) по порядку.
Таковы массивы
3) НАЧАЛЬНЫХ МОЛЬНЫХ КОЛИЧЕСТВ,
(nA0, nB0, . . . nM0, nN0)
4) ТЕКУЩИХ МОЛЬНЫХ КОЛИЧЕСТВ в любом промежуточном состоянии,
(nA, nB, . . . nM, nN )
5) Стандартных рядов теплоёмкостей. Они являются массивами – разложениями по степеням температуры, и поэтому придётся создать ещё одно измерение, выписывая коэффициенты перед простейшими степенными функциями уже по вертикали. Получится таблица – прямоугольная матрица в виде:
[СA0(T), СB0(T), . . . СM0(T), СN0(T)]
|
|
i |
-a |
-b |
+m |
+n |
|
|
|
|
|
СA0 |
СB0 |
СM0 |
СN0 |
|
|
|
T0 |
a |
|
|
|
|
|
|
|
T1 |
b |
|
|
|
|
|
|
|
T2 |
c |
|
|
|
|
|
|
|
T3 |
d |
|
|
|
|
|
|
|
T-2 |
c’ |
|
|
|
|
|
|
2. Мольная теплоёмкость и энтальпия. Пробег реакции и закон Кирхкоффа.
2.1. Дифференциальная форма:
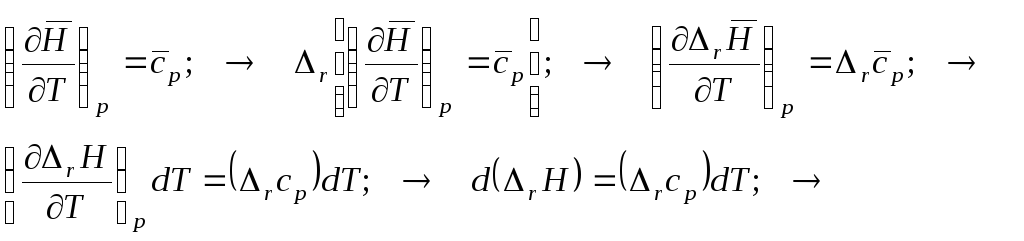
2.2. Кратко выглядит результат в виде определённого интеграла
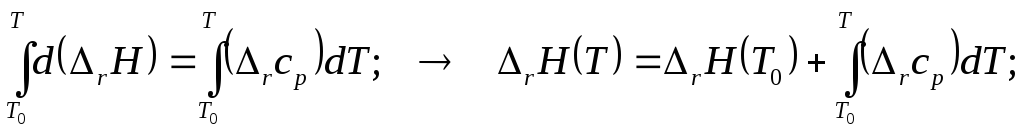
2.3. Неопределённое интегрирование
приводит к следующим общим выкладкам
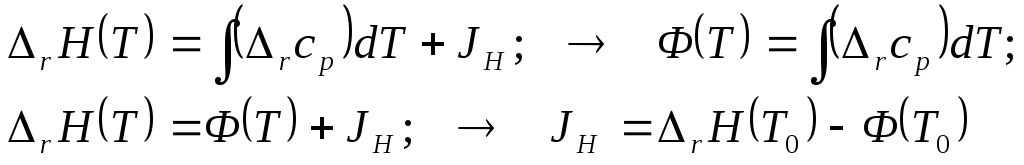
2.4. Можно представить результаты в компактной общей стандартной форме
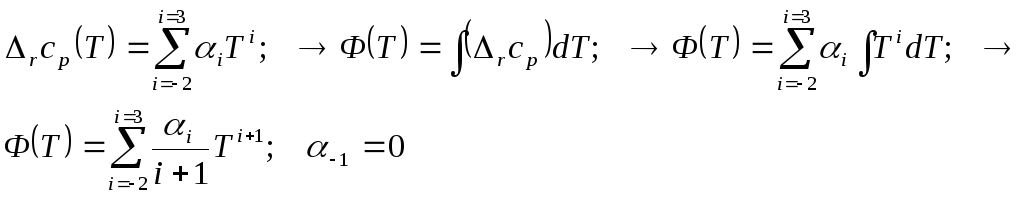
2.5. В этих формулах коэффициенты взяты из рядов теплоёмкостей:
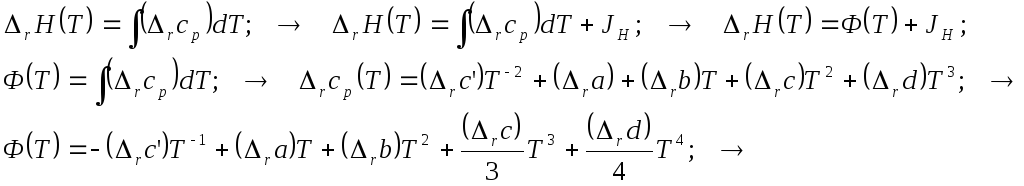
ХИМИЧЕСКИЙ ПОТЕНЦИАЛ ИДЕАЛЬНОГО ГАЗА.
Вывод 1 (простейший, довольно частный). Газ один - вне смеси.
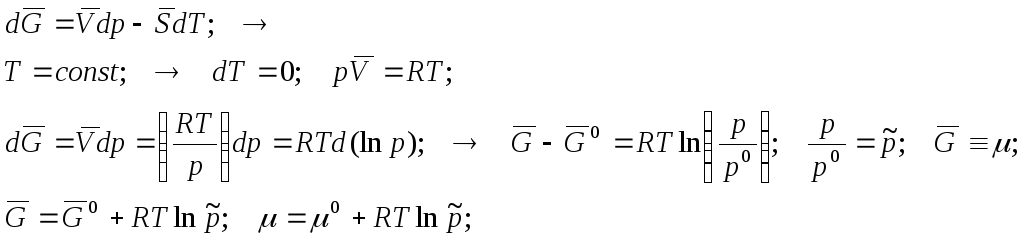
Вывод 2 (более общий). Газ в смеси других газов.
Вывод построена основе фундаментального
уравнения Гиббса для открытой системы,
затем получается 1-е уравнение
Дюгема-Гиббса , в котором энергия Гиббса
многокомпонентной системы оказывается
простой суммой мольных энергий Гиббса
компонентов, поскольку
![]() ,
далее получается уравнение Гиббса-Дюгема,
в котором характеристики смеси связываются
непосредственно со внешними параметрами
и уже на этой основе непосредственно
индивидуальный компонент газовой смеси
считается независимым, как это должно
быть в случае газа идеального, и в итоге
получается наиболее обоснованное
выражение химического потенциала
ИДЕАЛЬНОГО ГАЗА в ИДЕАЛЬНОЙ СМЕСИ.
Совершенно ясно, что для человека
некритического этот вывод покажется
более длинным, но на самом деле в нём
охвачены все аспекты поведения компонента.
Этот второй вывод имеет намного более
познавательную ценность по сравнению
с первым – примитивным.
,
далее получается уравнение Гиббса-Дюгема,
в котором характеристики смеси связываются
непосредственно со внешними параметрами
и уже на этой основе непосредственно
индивидуальный компонент газовой смеси
считается независимым, как это должно
быть в случае газа идеального, и в итоге
получается наиболее обоснованное
выражение химического потенциала
ИДЕАЛЬНОГО ГАЗА в ИДЕАЛЬНОЙ СМЕСИ.
Совершенно ясно, что для человека
некритического этот вывод покажется
более длинным, но на самом деле в нём
охвачены все аспекты поведения компонента.
Этот второй вывод имеет намного более
познавательную ценность по сравнению
с первым – примитивным.
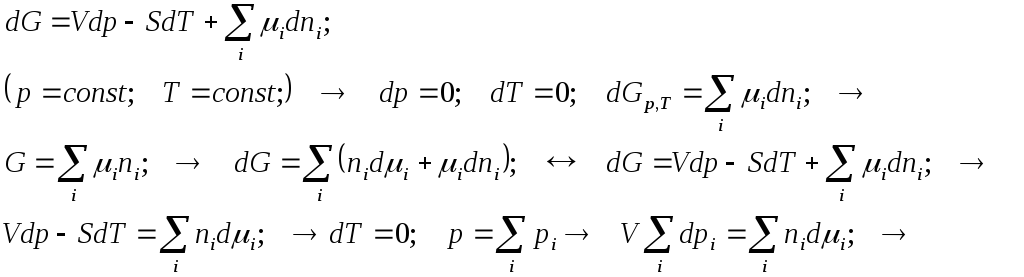
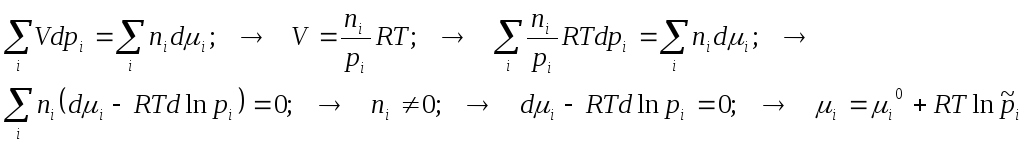
Энергия Гиббса в пробеге реакции. Её изменение определяется на основе ФУНДАМЕНТАЛЬНОГО УРАВНЕНИЯ ГИИБСА ДЛЯ ОТКРЫТОЙ СИСТЕМЫ.
Вы можете удивиться тому, что систему, с которой никакого обмена массой нет, вдруг становится открытой. Но в этом нет ничего странного. С точки зрения термодинамики результат химической реакции вполне допустимо рассматривать как следствие собственно не химического превращения, а просто вывода из системы реагентов и последующего ввода продуктов в эквивалентных количествах. Результат-то один и тот же…
![]()
![]()
![]()
Изотерма химической реакции
Минимум энергии Гиббса достигается при химическом равновесии.
Уравнение Гиббса-Гельмгольца. Форма 1:
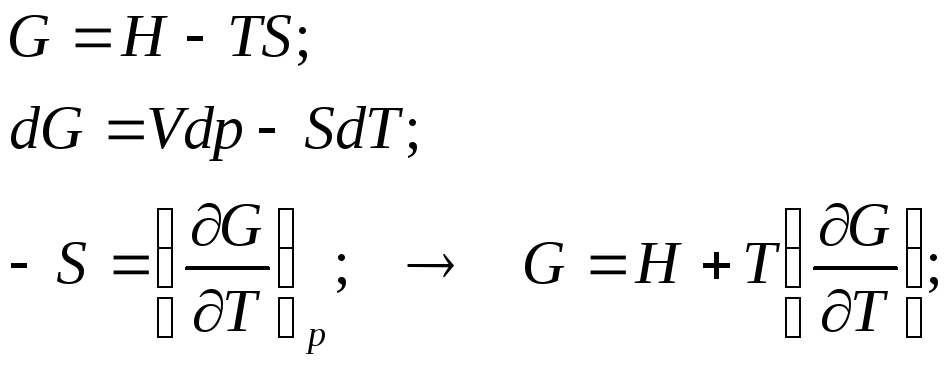
![]()
Уравнение Гиббса-Гельмгольца. Форма 2 (в виде приведённого потенциала):
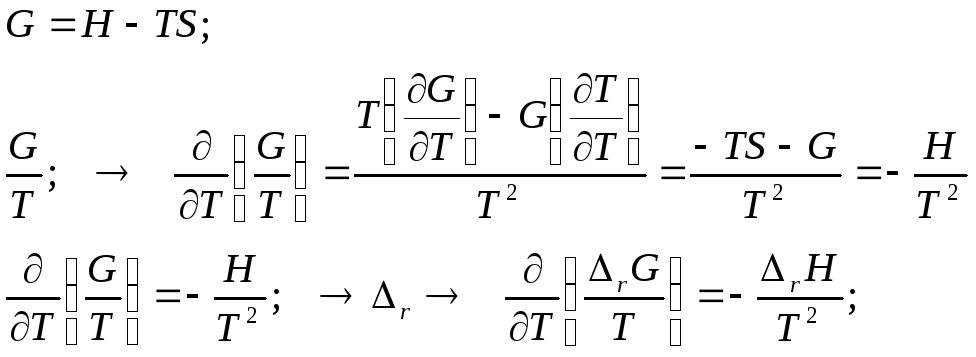
Изобара химической реакции (изобара Вант-Гоффа).
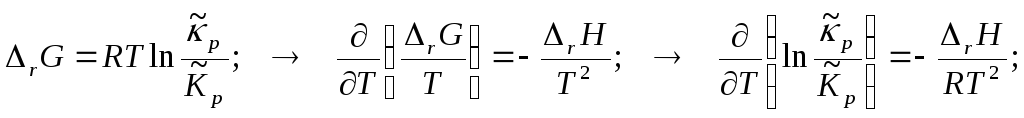
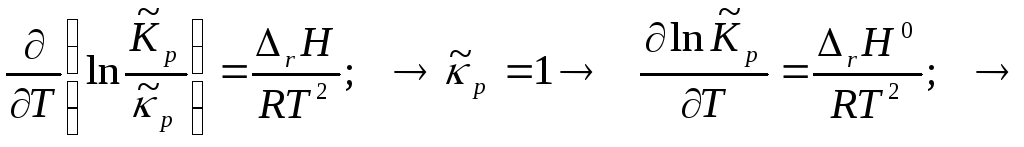
Интегрирование изобары Вант-Гоффа.
![]()
![]()
Вычисление константы интегрирования:
![]()
Вид подынтегральной функции:
Приближение 1. (хорошее на небольшом
интервале температур):
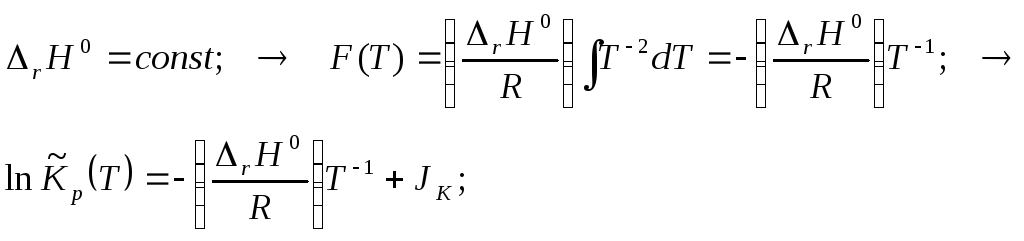
Приближение 2. (Это «точный» расчёт. Точность ограничен лишь точностью тепловых измерений на выделенном интервале температур):
![]()
Если
![]() ,
то
,
то
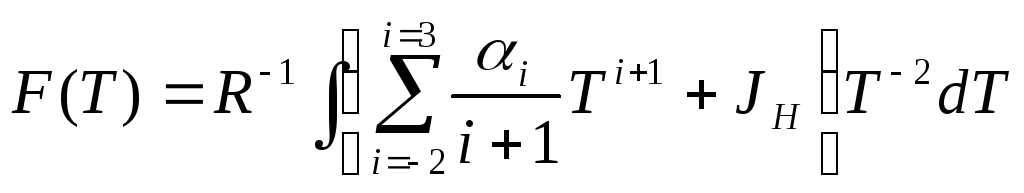
![]()
Учитывая все комментарии, получаем
![]()
Соответствующие подстановки приводят к общему выражению
![]()
Удобно общее выражение представить так, чтобы появилась не просто запись, а возникла некоторая форма классификации. Для этого можно воспользоваться таблицей или просто упорядоченными массивами. Степени температуры образуют базисный массив, а численные коэффициенты перед ними образуют ВЕКТОР. Функция оказалась представленной в очень удобно и, главное, контролируемой форме вектора. Её можно прочитать и в качестве скалярного произведения этих двух массивов. Это, как обычно для скалярных произведений (по определению!), есть сумма всех парных произведений элементов с одинаковыми номерами:
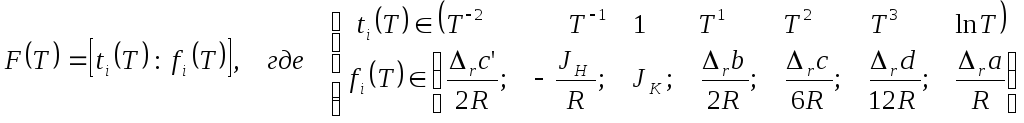
Эта табличная – векторная - форма представления функций массивами очень удобна, поскольку позволяет единообразно контролировать ход всего расчёта ХИМИЧЕСКОГО РАВНОВЕСИЯ в системе.
Так же следует представить и разность теплоёмкостей, и тепловой эффект за пробег реакции.
3) Вычисление равновесных выходов реактантов (реагентов и продуктов)
с помощью равновесного значения координаты реакции, которое определяется при фиксированной температуре через константу равновесия…
Эта информация имеется в лекциях…
Мы её повторим.
Материальный баланс реакции за пробег. Химическая переменная.
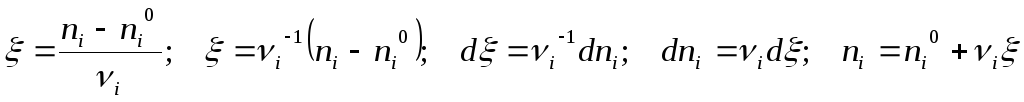
Достигнув вычисления константы равновесия для реакции за пробег, записанный в виде
![]() ,
,
обратимся к информации о начальном и текущем состояниях реакционной системы.
Текущее состояние в конце реакции превратится в химическое равновесие.
Через координату реакции выразим все текущие мольные количества веществ – участников – реактантов – реагентов и продуктов реагирующей смеси:
![]()
Мольная доля каждого это величина
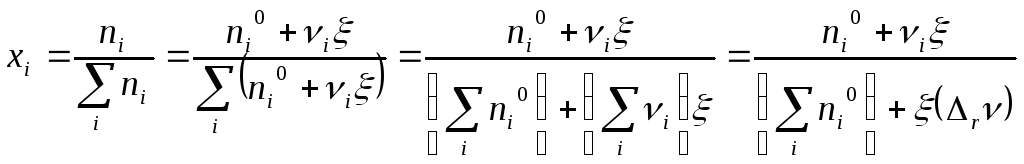
Парциальное давление каждого газообразного участника реакции это доля от общего давления P, равная
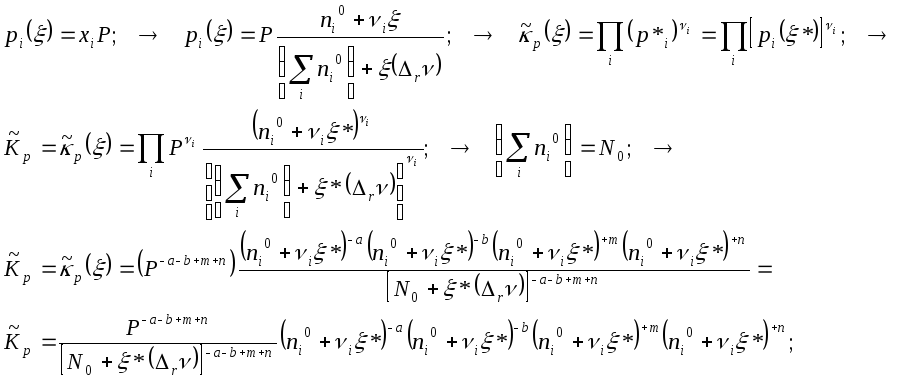
Это уравнение в конкретных простых случаях сильно упрощается, но в случаях сложных тоже не представляет принципиальной проблемы его решение. Это удобно делать численными методами иди посредством графического метода. … Строите график всей функции, определяете координаты её нулевых значений, и среди полученных величин выбираете единственный, подходящий по физическому смыслу.
…Отыскивая единственный физически-значимый корень, находим * и далее определяем мольные доли и парциальные давления… Прочие корни не имеют смысла.
Сравнивая три функции
![]() отбираем все элементарные функции
температуры и создаём единый - наиболее
полный - базисный массив температурных
функций и все эти три функции представляем
векторами в этом «обобщённом» базисе.
Получаем наиболее универсальную и
предельно удобную систему для табличного
представления всех основных результатов
вычислений.
отбираем все элементарные функции
температуры и создаём единый - наиболее
полный - базисный массив температурных
функций и все эти три функции представляем
векторами в этом «обобщённом» базисе.
Получаем наиболее универсальную и
предельно удобную систему для табличного
представления всех основных результатов
вычислений.
В этом вопросе Вам поможет пособие по домашнему заданию.
Неравенство Клаузиуса
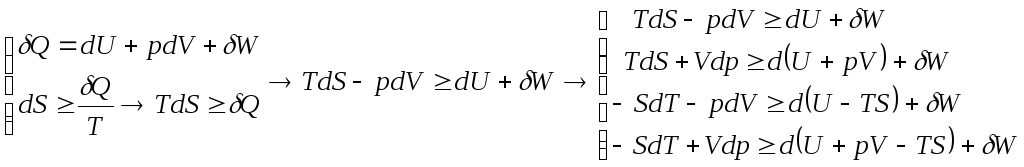
Характеристические функции:
U-Внутренняя энергия, H=U+pV-Энтальпия,
A=U-TS-Свободная энергия, G=H-TS-Энергия Гиббса
Окончательно получаем 4 равносильные формы неравенства Клаузиуса:
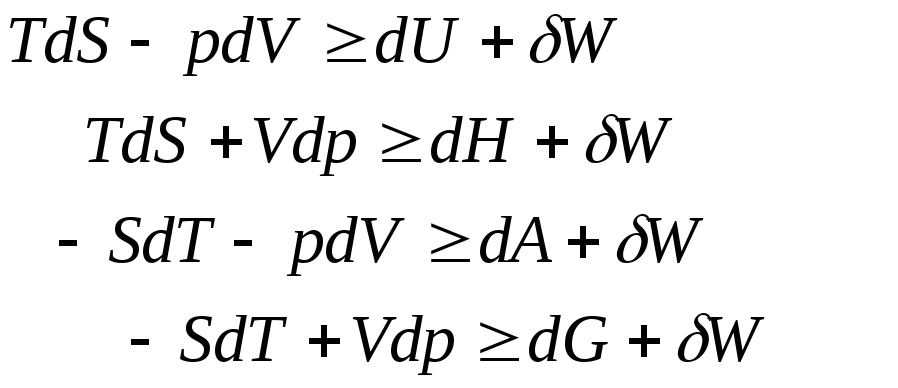
Их можно записать и так:
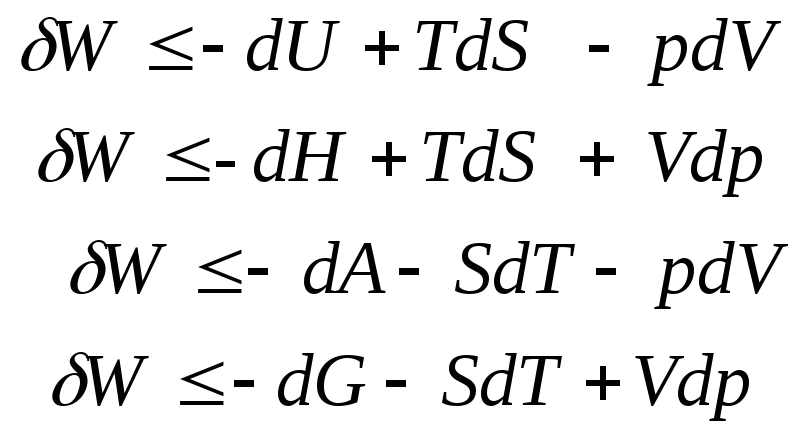
Каждое из них содержит два дифференциала аргументов, один из которых ТЕРМИЧЕСКИЙ, а второй –МЕХАНИЧЕСКИЙ.
Таким образом МАКСИМАЛЬНАЯ ПОЛЕЗНАЯ РАБОТА связывается с дифференциалом одной из четырёх функций состояния и с одной из четырёх возможных пар комбинаций термодинамических переменных, избираемых из числа (T, S, p, V), т.е.
U(T, V); H(T, p); A(S, V); G(S, p).
В отсутствие полезной работы процесс имеет свободный характер. Отсутствие полезной работы возможно лишь при полном отсутствии любых форм управления превращением, т.е. любых способов организации системы.
Если же характеристики системы извне изменяются бесконечно мало, то это лишь отклик на бесконечно малое изменение внешних термических и механических параметров со стороны среды. На малые возмущения и отклик бесконечно мал.
В присутствие полезной работы процесс протекает организованно, управляемо, и максимальная организованность сопровождается получением максимальной полезной работы. Это возможно лишь при идеальной организации превращения, при его обратимом проведении.
Этим утверждениям очень легко придать строгую математическую формулировку.
