
Влияние температуры на скорость химических реакций
Повышение температуры ускоряет большинство химических реакций. Приближенно влияние температуры на скорость реакции описывает эмпирическое правило Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость для большинства реакций увеличивается в 24 раза.
V2=V1![]() ,
(4)
,
(4)
где V1,V2– скорости реакции при температурахТ1иТ2; - температурный коэффициент Вант-Гоффа, который показывает во сколько раз увеличивается скорость реакции при повышении температуры на каждые 100(в интервале температур от комнатных до 400С).
Точнее значение можно вычислить по формуле:
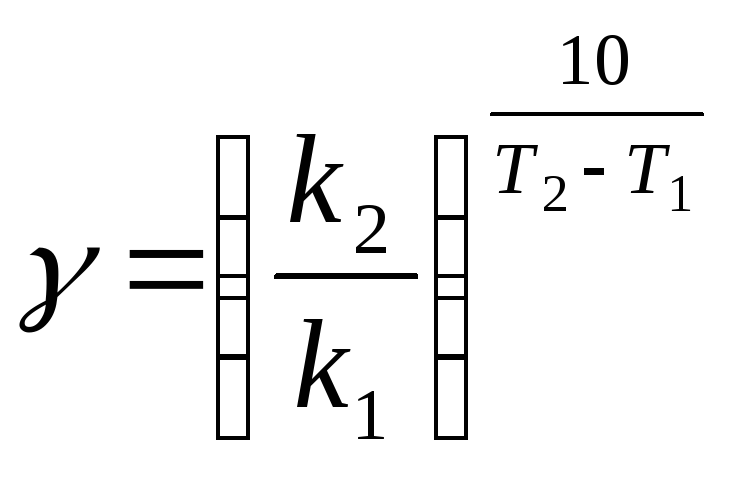 ,
(5)
,
(5)
где k1, k2– константы скорости реакции при температурахТ1иТ2.
Небольшое значение температурного коэффициента обусловливает большое возрастание скорости реакции при незначительном повышении температуры. Например, если γ = 2,9, то при возрастании температуры на 1000 скорость реакции увеличится в 2,910 раза, т.е. приблизительно в 42 000 раз.
Такое большое увеличение скорости реакции можно было бы объяснить возрастанием числа соударений между молекулами. Однако кинетическая теория показывает, что увеличение скорости, вызванное увеличением числа столкновений с ростом температуры, совсем незначительное и не может обеспечить наблюдающегося резкого возрастания скорости. Всё это приводит к выводу, что не каждое соударение молекул эффективно, и химическое взаимодействие имеет место, только если сталкивающиеся молекулыобладают определенным избытком энергии по сравнению со средней энергией данныхмолекул.Эта избыточная энергия называетсяэнергией активации (EА), а молекулы, обладающие этой избыточной энергией, - активными. Величина энергии активации зависит от природы реагирующих веществ. Для большинства химических реакций значенияЕАлежат в пределах 40400 кДж/моль. В узком интервале температур энергия активации практически не зависит от температуры и может быть вычислена по уравнению Аррениуса:
k = Аe(-Е/RT) ( 6 )
где k
– константа скорости реакции; А
– постоянная, характеризующая каждую
конкретную реакцию (константа Аррениуса);
Е
– энергия активации; R
– газовая постоянная (8,314
![]() );Т –
температура, К (Кельвин).
);Т –
температура, К (Кельвин).
Обратите внимание: уравнение (6) связывает температуру не со скоростью реакции, а с константой скорости.
Уравнение (6) для температур Т1 и Т2 может быть записано после преобразований в удобной для вычислений форме (7а или 7б):
Е =
![]() ∙ln
∙ln![]() (7а) Е =
(7а) Е =
![]() ∙lg
∙lg![]() (7б)
(7б)
где k1 и k2 – константы скорости реакции при температурах Т1 и Т2, К
При повышении температуры энергия вещества возрастает и перераспределяется между молекулами таким образом, что значительно возрастает число активных молекул.
Источником энергии активирования может быть энергия в различных формах: тепловая, лучистая, электрическая, энергия радиоактивных частиц и т.д. Если энергия активации очень мала (меньше 40 кДж/моль), это означает, что значительная часть столкновений между частицами реагирующих веществ приводит к реакции. При этом скорость такой реакции будет большой. Напротив, если энергия активации очень велика (больше 120 кДж/моль), то это означает, что очень малая часть столкновений взаимодействующих частиц приводит к химической реакции. Скорость реакции очень мала.
Примером реакции, имеющей высокую энергию активации, является реакция синтеза аммиака:
 N2
+ 3Н2
2NН3
N2
+ 3Н2
2NН3

Эта реакция при обычных температурах протекает столь медленно, что заметить её протекание практически невозможно.
Большую роль в снижении энергии активации играют катализаторы.
