
- •Лекция 1 Тема: основные химические понятия и законы. Цель: Ознакомить студентов с оснровными законами и понятиями, лежащими в основе химии.
- •Химия как наука и ее задачи.
- •Важнейшие законы, лежащие в основе химии.
- •Основные понятия химии
- •Закон Авогадро.
- •Уравнение состояния газа. Уравнение Менделеева-Клапейрона.
- •Лекция 2
- •2.Образование атомной кристаллической решетки
- •Лекция 3. Тема: Классификация неорганических соединений. Цель: Ознакомить студентов с разнообразием, строением и свойствами неорганических соединений
- •Кислота основание основание кислота
- •Лекция 4
- •Лекция 5
- •Лекция 6
- •2.Энергия активации. Энтропия активации
- •3.Факторы, влияющие на скорость гомо- и гетерогенных химических реакций. Катализ.
- •Лекция 7
- •2.Изменение энтропии в химическом процессе. Энергия Гиббса
- •Лекция 8
- •2. Коллигативные свойства растворов
- •3.Сильные и слабые электролиты
- •4. Растворы электролитов
- •5. Процесс диссоциации
- •6. Константа диссоциации. Смещение ионного равновесия
- •7. Особенности воды как электролита. Ионное произведение воды . РН раствора. Буферные растворы
- •8. Гидролиз солей. Расчёт концентрации ионов водорода в растворах
- •Лекция 9
- •2.Окислители и восстановители
- •1)Окислители
- •2)Восстановители
- •3)Окислительно-восстановительная двойственность
- •3.Составление уравнений окислительно-восстановительных реакций
- •1.Метод электронного баланса.
- •2.Метод полуреакций, или ионно-электронный метод.
- •Электрохимические процессы
- •2.Направление протекания овр
- •3.Электролиз
- •4.Законы электролиза
- •5.Применение электролиза
- •Лекция 10
- •2.Атомно-молекулярное учение. Основные химические понятия и определения
- •3.Строение атома
- •4. Квантовые числа. Правила заполнения электронных орбиталей
- •Периодический закон и периодическая система элементов д. И. Менделеева.
- •2.Свойства атомов
- •Лекция 11
- •2.Типы химической связи
- •3.Гибридизация атомных орбиталей
- •4.Метод валентных связей
- •Лекция 12
- •Комплексные соединения, их строение и номенклатура. Химическая связь в комплексных соединениях.
- •Устойчивость комплексных ионов. Константа нестойкости. Комплексные химические соединения.
- •Лекция 13
- •2. Водород
- •3. Вода
- •4. Пероксид водорода
- •5. Элементы viiа группы
- •6. Элементы viа группы
- •Общая характеристика элементов vа, ivа групп
- •1. Элементы vа группы.
- •2.Элементы ivа группы.
- •Характеристика металлов
- •1. Строение металлов.
- •2. Физические свойства металлов.
- •3. Химические свойства металлов.
- •Уменьшение химической активности нейтральных атомов
- •Уменьшение способности ионов к присоединению электронов
- •Характеристика элементов второй группы периодической системы
- •Стеарат натрия стеарат кальция
- •Сода осаждает кальций и магний тоже в виде карбонатов:
- •Характеристика элементов третей группы периодической системы
Лекция 5
Тема: ДИСПЕРСНЫЕ СИСТЕМЫ И РАСТВОРЫ.
Цель: Ознакомить студентов с понятием дисперсные системы, рассмотреть их свойства и способы получения.
Общая характеристика и классификация дисперсных систем.
2. Методы получения коллоидных растворов.
3.Электрические свойства коллоидных растворов.
Строение мицелл
Дисперсные системы (коллоиды, коллоидные растворы или золи) являются объектами изучения коллоидной химии.
Они состоят из прерывной фазы – дисперсной фазы и непрерывной фазы – дисперсионной среды. Занимают промежуточное место между истинными р-рами и суспензиями; коллоидные частицы имеют диаметр ≈ от 1 до 500 нм. Наиболее характерные свойства: молекулярно-кинетические, оптические, электрические.
Молекулярно-кинетические:
диффузия (необратимый самопроизвольный процесс выравнивания концентрации) и броуновское движение (самопроизвольное беспорядочное движение мелких частиц дисперсной фазы, находящихся во взвешенном состоянии в жидкости или газе; для коллоидных растворов это следствие теплового движения молекул д.с.).
Оптические:
дисперсные системы отражают проходимость света если размеры частиц дисперсионной фазы больше длины волны проходящего света – в грубодисперсных системах; поглощение света хар-но дляистинных и колл р-ров с высокой степенью дисперсности; рассеяние – при соизмеримых с дл.волны размерах ч-ц – у колл р-ров.
Электрические:
связаны с наличием заряда на поверхности колл ч-ц – электрофорез, электроосмос, коагуляция, устойчивость и т.д.
коллоидные растворы сост. из дисперсной фазы (растворенное вещество - концентрация меньше) и дисперсионной среды (растворитель – к-ция больше).
классификация дисперсных систем
1 – классификация по степени дисперсности (р-р колл ч-ц):
- грубодисперсные системы: р-мер ч-ц дисп фазы > 10-5см – это суспензии /жидкость-тв ч-цы/, эмульсии /ж-ж/, аэрозоли /ж-газ/
- истинные колл р-ры: р-мер ч-ц 10-5 – 10-7см – колл ч-цы не осаждаются, их нельзя отделить от дисп среды обыч. методами – фильтров. и центриф.
- истинные р-ры: р-р частиц раств-го в-ва в р-рителе 10-8 – 10-9см
- р-ы высокомолекулярных соединений: промежут положение м-у высокодисперсными системами и истинно коллоидными р-рами; р-мер ч-ц в 3-5 раз больше, чем у низкомолекулярных соединений.
2 – Кл-я по агрегатному состоянию в-ва
дисперсионной среды
д.
среда-вода
– Кл-я по агрегатному состоянию в-ва
дисперсионной среды
д.
среда-вода
1 )
жидкая дисперсионная среда:
а)
дисперсная фаза – твердая – лиозоли
органозоли -
)
жидкая дисперсионная среда:
а)
дисперсная фаза – твердая – лиозоли
органозоли -
б) ж/ж д.ф. - жидкость→ эмульсии: молоко; в) г/ж д.ф. – газ – мин.воды. д.ср.-орг.в-во
2) газообразная д.с.: а) ж/г д.ф. –жидкость – аэрозоли; б) т/г д.ф. – тв.в-во – аэрозоли; в) г/г д.ф.- газ.
3) д.с. – твердое в-во: а) т/т д.ф. – тв.в-во – минералы, сплавы; б) ж/т и в) г/т - пористые или капиллярно-пористые тв.тела: грунты, стекла, пемза.
Методы получения коллоидных растворов.
2 основные гр. методов получ.колл р-ров: диспергационные и конденсационные.
Диспергационные основаны на измельчении всех частиц дисперсной фазы до размеров коллоидной степени дисперсионности - 10-5 – 10-7см. Диспергирование: механ., электр., колл мельницы, ультразвук, вакуумное напыление – все обыч.вар-ты дробления в-ва.
Конденсационные основаны на переходе молекулярных или ионных р-ров в колл - укрупнение частиц до р-меров 10-5 – 10-7см. Конденсация: метод замены р-рителя; с пом. реакций гидролиза, ок-восст, осаждения и т.д.
М-д пептизации – промежуточный м-у 2 первыми. Пептизация – переход в колл р-р осадков, образ. при коагуляции.
Электрические свойства коллоидных растворов.
Строение мицелл
В состав любой коллоидной частиц входит ядро. Согласно правилу Фаянса – Пескова, на ядре адсорбируются потенциал-определяющие ионы (ПОИ). За счет ПОИ коллоидные частицы в растворах могут приобретать + или – заряды. А в-во дисперсной среды несет противоположный заряд.
Если наложить постоянное электрическое поле, то происходит процесс передвижения колл. частиц и в-ва дисперсной среды к определенным противоположно заряженным электродам. По этому принципу происходят процессы электроосмоса и электрофореза.
Электрофорез – это процесс движения коллоидной частицы в постоянном электрическом поле.
Электроосмос – это процесс передвижения жидкости или вещества дисперсной среды под влиянием электрического поля. Процесс электрофореза используется при обезвоживании сырых шерстяных продуктов. Эти два явления были открыты в 1808 году Рейсом. Позднее были открыты еще два электрокинетических явления, противоположные электрофорезу и электроосмосу.
Эффект Дорка (потенциал оседания) – возникновении разности потенциалов при оседании коллоидных частиц в растворе.
Эффект Квинке (или потенциал течения) – возникновение разности потенциалов при протекании жидкости через плоскую диафрагму.
Известно 4 вида электрокинетических явлений. Причиной возникновения этих явлений считается возникновение Двойного электрического слоя ДЭС на границе раздела фаз.
Теория строения ДЭС по Гельмгольцу:
+ - На поверхности твердой частицы располагаются (ПОИ) (+), но в растворе
+ - будут еще располагаться (-), возникнет ДЭС, напоминающий обкладку
+ - конденсатора.
Строение ДЭС по Гуи – Чеплину: ө
+ ө
+ ө ө
+ ө
В теории Гуи Чеплина не учитываются размеры зарядов, и сейчас общепризнанна теория ДЭС по Штерну.

 +
ө ө
+
ө ө
+ ө ө
+ ө ө
 +
ө ө
+
ө ө
Адсорбционный слой Диффузный слой
На поверхности частицы – ДЭС, в диффузном слое также противоионы.
Строение коллоидной частицы.
Гидрофобные (лиофобные) коллоидные растворы – когда вещество дисперсной фазы инертно по отношению к дисперсной среде, а у гидрофильных коллоидных растворов может наблюдаться взаимодействие вещества дисперсной фазы с дисперсной средой.
Самодиспергирование возможно у гидрофильных коллоидных растворов в следствие повышения поверхностного натяжения растворов.
AgNO3+KI→AgI↓+KNO3
Для получения хороших золей берут средние концентрации веществ. Далее определяется стабилизатор (то вещество, которое берется в избытке), длопустим в данном случае - AgNO3 : n AgNO3→nAg++NO3-
Cогласно правилу Фаянса – Пескова
{ [m AgI]n Ag+ (n-x)NO3- }x+xNO3-
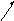

ядро ПОИ ПРИ(противоионы) ПРИ(диффузный рыхлый слой)
Коллоидная частица (в данном случае несет отрицательный) заряд, мицелла в целом электронейтральная. Идет перемещение коллоидных частиц по границам скольжения электролита. При добавлении (электролита) – коагуляция – происх. сжатие 2-ого электрического слоя (часть противоионов загоняется в плотный слой следовательно другое строение мицеллы.
{ [m AgI]n Ag+ nNO3- }0 – золь не устойчив.
Добавляют избыток Эл-та стабилизатора (KI).
AgNO3+KI→AgI↓+KNO3
nKI→nK++nI- : { [m AgI] nI- (n-x)K+ }x-xK+- - частица несет (-) заряд.
Литература:
Ахметов, Н.С. Общая и неорганическая химия / Н.С.Ахметов. – 3-е изд. – М.: Высшая школа, 2000. – 743с.
Т.Браун. Химия – в центре наук / Браун.Т, Лемей Г.Ю. – М.: Мир, 1983. – тт. 1–2.
Карапетьянц М.Х. Общая и неорганическая химия / М.Х. Карапетьянц, С.И.Дракин. – М.: Высшая школа, 2002.
Коровин Н.В. Общая химия / Н.В.Коровин. – М.: Высшая школа, 2006. – 557 с.
Кузьменко Н.Е. Краткий курс химии / Н.Е. Кузьменко, В.В Еремин, В.А. Попков. – М.: Высшая школа , 2002. – 415 с.
