
- •Лекция 1 Тема: основные химические понятия и законы. Цель: Ознакомить студентов с оснровными законами и понятиями, лежащими в основе химии.
- •Химия как наука и ее задачи.
- •Важнейшие законы, лежащие в основе химии.
- •Основные понятия химии
- •Закон Авогадро.
- •Уравнение состояния газа. Уравнение Менделеева-Клапейрона.
- •Лекция 2
- •2.Образование атомной кристаллической решетки
- •Лекция 3. Тема: Классификация неорганических соединений. Цель: Ознакомить студентов с разнообразием, строением и свойствами неорганических соединений
- •Кислота основание основание кислота
- •Лекция 4
- •Лекция 5
- •Лекция 6
- •2.Энергия активации. Энтропия активации
- •3.Факторы, влияющие на скорость гомо- и гетерогенных химических реакций. Катализ.
- •Лекция 7
- •2.Изменение энтропии в химическом процессе. Энергия Гиббса
- •Лекция 8
- •2. Коллигативные свойства растворов
- •3.Сильные и слабые электролиты
- •4. Растворы электролитов
- •5. Процесс диссоциации
- •6. Константа диссоциации. Смещение ионного равновесия
- •7. Особенности воды как электролита. Ионное произведение воды . РН раствора. Буферные растворы
- •8. Гидролиз солей. Расчёт концентрации ионов водорода в растворах
- •Лекция 9
- •2.Окислители и восстановители
- •1)Окислители
- •2)Восстановители
- •3)Окислительно-восстановительная двойственность
- •3.Составление уравнений окислительно-восстановительных реакций
- •1.Метод электронного баланса.
- •2.Метод полуреакций, или ионно-электронный метод.
- •Электрохимические процессы
- •2.Направление протекания овр
- •3.Электролиз
- •4.Законы электролиза
- •5.Применение электролиза
- •Лекция 10
- •2.Атомно-молекулярное учение. Основные химические понятия и определения
- •3.Строение атома
- •4. Квантовые числа. Правила заполнения электронных орбиталей
- •Периодический закон и периодическая система элементов д. И. Менделеева.
- •2.Свойства атомов
- •Лекция 11
- •2.Типы химической связи
- •3.Гибридизация атомных орбиталей
- •4.Метод валентных связей
- •Лекция 12
- •Комплексные соединения, их строение и номенклатура. Химическая связь в комплексных соединениях.
- •Устойчивость комплексных ионов. Константа нестойкости. Комплексные химические соединения.
- •Лекция 13
- •2. Водород
- •3. Вода
- •4. Пероксид водорода
- •5. Элементы viiа группы
- •6. Элементы viа группы
- •Общая характеристика элементов vа, ivа групп
- •1. Элементы vа группы.
- •2.Элементы ivа группы.
- •Характеристика металлов
- •1. Строение металлов.
- •2. Физические свойства металлов.
- •3. Химические свойства металлов.
- •Уменьшение химической активности нейтральных атомов
- •Уменьшение способности ионов к присоединению электронов
- •Характеристика элементов второй группы периодической системы
- •Стеарат натрия стеарат кальция
- •Сода осаждает кальций и магний тоже в виде карбонатов:
- •Характеристика элементов третей группы периодической системы
3.Строение атома
1) Теория Нильса Бора (1913 г.)
2) Дуализм микрообъектов (В.Луи-де-Бройля)(1924 г.)
3) Принцип неопределенности (Гейзенберга)
4) Уравнение Шредингера (1926г.)
1) Примерно в начале ХХв. Исследования ряда явлений (излучение раскаленных тел, фотоэффект, и др.) привели к выводу, что энергия распространяется и передается, поглощается и испускается не непрерывно, а дискретно, отдельными порциями- квантами. Энергия системы микрочастиц также может принимать только определенные значения, которые являются кратными числами квантов . Т.о. энергия этих систем может изменятся лишь скачкообразно – она квантуется.
Предположение о квантовании энергии впервые было высказано Максом Планком.
Энергия кванта ΔЕ зависит от частоты излучения. Энергия прямо пропорциональна скорость света и длине волны.
![]()
![]()
![]()
h
- универсальная Планка = 6,625∙10-34
![]()
c -скорость света =3∙1010 м/с
Частота колебаний и длина волны связаны соотношениями
![]()
Согласно соотношению
![]() ,чем
меньше длина волны(т.е. чем больше частота
колебаний),тем больше энергия кванта и
,наоборот ,чем больше длина волны(т.е.
меньше частота колебаний), тем меньше
энергия кванта ,т.о. ультрафиолетовые
и рентгеновские лучи обладают большей
энергией ,чем радиоволны или тепловые
(инфракрасные)лучи.
,чем
меньше длина волны(т.е. чем больше частота
колебаний),тем больше энергия кванта и
,наоборот ,чем больше длина волны(т.е.
меньше частота колебаний), тем меньше
энергия кванта ,т.о. ультрафиолетовые
и рентгеновские лучи обладают большей
энергией ,чем радиоволны или тепловые
(инфракрасные)лучи.
В 1913г. Н.Бор создает теорию электронного строения атома Н2 основываясь на двух предположениях:
1)Момент количества движения электронов в атоме Н2 равен целому кратному постоянной Планка(целому числу квантов действия).
![]()
Кинетическая энергия электронов по бору равняется произведению заряда электрона на квадрат расстояния между ними (Кулоновский закон)
![]()
![]()
Из данного уравнения Бор вычислял радиус электронов для атома Н2
Отношения стационарных (дозволенных ) орбит
R = 0,053 нм; его υ = 2200 км/с
отношения стационарных (дозволенных) орбит 12:22:32: и т.д.
2)При переходе
электронов с одной орбиты на другую
(обладающей разной энергией) поглощается
или выделяется квант энергии
![]() .
.
Т.о. Бору удалось соединить теорию Планка (квантовую) с физической теорией Ньютона. Рассчитанные величины были определены экспериментально ,что подтверждает теоретические закономерности Бора.
2) 1922г.
Эйнштейн выводит уравнение на основе
уравнения Планка. Указанное уравнение
Е=mc2
позволяет
определить энергию фотонов и частиц
рентгеновского излучения. В выражение
уравнения входит масса вещества, это
значит, что поток световых лучей,
электронов, протонов, рентгеновских
лучей характеризуется как частицы
(корпускулы). Для описания электромагнитного
излучения привлекают как волновые,
таки корпускулярные представления: с
одной стороны, монохроматическое
излучение распространяется как волна
и характеризуется длиной волны λ (или
частотой колебания ν); с другой стороны,
оно состоит из микрочастиц -фотонов,
переносящих кванты энергии .Явление
дифракции и интерференции электромагнитного
излучения доказывает его волновую
природу. В то же время электромагнитное
излучение обладает энергией ,массой,
производит давление и т.д. В1924г. Луи де
Бройль предложил распространить
корпускулярно-волновые представления
на все микрочастицы, т.е. движение любой
микрочастицы рассматривать как волновой
процесс. Луи де Бройль эмпирически
предположил, что энергия излучения
кванта и энергия вычисления по его массе
равны
![]() .
Математически вычислил длину волны,
согласно кот. Частице, имеющей массу и
движущейся со скоростью, соответствует
волна длиной:
.
Математически вычислил длину волны,
согласно кот. Частице, имеющей массу и
движущейся со скоростью, соответствует
волна длиной:
![]() Уравнение де
- Бройлевской волны.
Уравнение де
- Бройлевской волны.
Вывод : Двойственная природа присуща всем микрочастицам и их движение связано с распространением волны.
3) Объяснение причины дуализма были найдены Вернером Гейзенбергом ,который сформулировал принцип неопределенности: невозможно одновременно определить и скорость(или импульс p=mv)и положение микрочастицы(ее координаты).Чем точнее определены координаты частицы тем менее определенным становится величина ее скорости. Δ-измерение.
![]()
Δx – неопределенность положение измерение координаты.
Δp – неопределенность скорости (импульса).
Например: если положение электрона определено с точностью до 10-10см., то неопределенность вскорости составит 58000 см/сек (при скорости электрона2000 км/сек).
4) Поскольку движение электрона имеет волновой характер, квантовая механика описывает его движение в атоме при помощи волновой функции Ψ.
В1926г. - на основе гипотезы де - Бройля Шредингер использовал волновое уравнение классической механики в качестве модели для описания поведения электронов в атоме. По Шредингеру атомная система замкнута и потому поведение электрона, его движение подобно стоячей волне .Однако, в отличии от стоячей волны атомная система является3-х мерной и Шредингер вводит координаты x,y,z.Тогда и уравнение стоячей волны принимает следующий вид - дифференциальное уравнение частных произведений второго порядка.
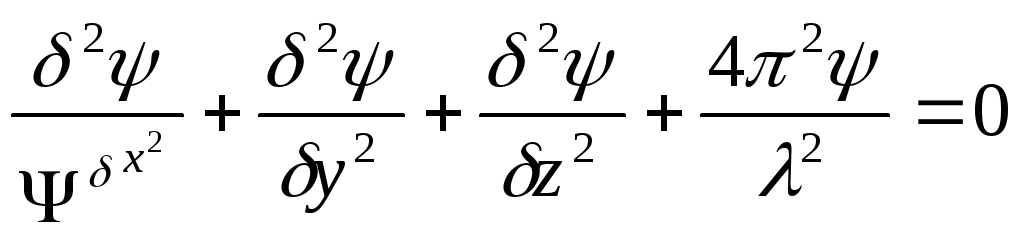
Уравнение Шредингера для атомных систем можно решить если функция Ψ будет непрерывной, конечной, однозначной и обращаться в «0» на бесконечности. Уравнение Шредингера решается, если энергия системы не зависит от времени. Сама волновая функция Ψ не имеет физического смысла, Ψ2 однако означает вероятность пребывания электрона в данном пространстве атомной системы. Т.о. уравнение Шредингера позволяет определить в атомной системе энергию электрона и максимальную электронную плотность.
Атомы элементов имеют очень сложное строение. В недрах атома найдено до нескольких сот различных частиц, получивших название элементарных или субатомных. Некоторые из них стабильны, другие существуют миллионные доли секунды. Для химии фундаментальное значение имеют три: протон (р), заряд = -1,нейтрон (n), заряд = 0, электрон (е), заряд 1,602*10-19 (элементарный электрический заряд). Условно заряд электрона принимаем = -1, масса электрона = 9,11*10-31.
Атомы состоят из положительно заряженного ядра и движущихся около него электронов. Число электронов в атомах равно положительному заряду ядра, выраженному в единицах элементарного заряда. Атом электронейтрален. При удалении от атома одного или нескольких электронов образуется положительный ион, при присоединении к атому электрона – отрицательный ион.
Так как массы протона и нейтрона почти одинаковы, и при этом намного больше массы электрона, то почти вся масса атома сосредоточена в его ядре.
Атомы между собой различаются зарядами ядер, массой и размерами.
Заряд ядра определяется числом находящихся в нем протонов. Число протонов равно порядковому номеру Z элемента в системе. Число нейтронов N. Сумма Z + N = A - массовое число ядра.
Нуклонный (р и n) состав атомных ядер сокращенно записывают так:
A Z Э N.
Совокупность атомов с одинаковым зарядом ядра называется химическим элементом.
Протоны в ядре атома определяют химическую природу элемента. Изменение числа протонов приводит к образованию атома другого элемента. Изменение числа нейтронов в ядре изменяет массу ядра, но не изменяет химическую природу элемента. Отсюда различают изотопы и изобары.
Изотопы – разновидности одного и того же элемента, ядра атомов которых различаются между собой по массе, но не различаются по своему заряду.
Z1= Z2, N1= N2, А1=А2
Изобары - простые вещества, ядра атомов которых имеют одинаковую массу (А1=А2), но различаются по заряду. Изобары - различные элементы.
Z1=Z2,N1=N2
За единицу атомной массы принята 1/12 массы атома изотопа углерода 612С, называемаяатомной единицей массы(а.е.м.).Масса атома или молекулы, отнесенная к этой единице, называется относительной атомной или молекулярной массой и обозначается соответственно Аrи Мr. Величины эти безразмерны, их следует отличать от понятий массы атома или молекулы, выражаемых в а.е.м. Эти различия только смысловые, числовые же характеристики одни и те же.
За единицу количества вещества принят моль– количество вещества, содержащее столько же структурных единиц (атомов, молекул, ионов и др.), сколько атомов содержится в 0,012 кг изотопа углерода612С. Число частиц, содержащееся в одном моль вещества, называют числом Авагадро и обозначаютNА=6,022*1023моль-1.NА не зависит от природы вещества и внешних условий. Это универсальная постоянная.
1 моль любых частиц равен 6,022*1023этих частиц. В 1г содержится 6,022*1023а.е.м.
Постоянная Авагадро показывает число единиц в одном любого вещества. Поэтому можно сказать, что моль– это количество вещества, которая содержит 6,022*1023структурных единиц (атомов, молекул, ионов) данного вещества.
Понятие моль применимо к любым веществам. 1 моль атомарного Н заключает в себе 6,022*1023атомов Н; 1 моль молекулярного Н2– это 6,022*1023молекул Н2.
Для веществ в кристаллическом состоянии структурная единица соответствует простей шей условной формуле вещества. Например, 1 моль NaClсодержит 6,022*1023 условных частицNaCl, т.е. 6,022*1023атомовClи столько же атомовNa.
Если известно число структурных единиц вещества В – N(В), то количество этого веществаn(В) определяется по формуле:
n(В) =N(В)/NА
Отношение массы вещества к его количеству называется молярной массой этого вещества:
М(В) = m(B)/n(В), кг/кмоль г/моль
где m– масса вещества.
Молярная масса численно равна относительной атомной или молекулярной массе этого вещества.
Свойства электронов и других микрообъектов не могут быть описаны на основе представлений классической механики. Микрочастицы подчиняются законам квантовой механики. Ее основные положения:
Энергия испускается и поглощается телами отдельными порциями – квантами. Следовательно, энергия микрочастиц изменяется скачкообразно.
Электроны и другие микрочастицы имеют двойственную природу: с одной стороны, они проявляют свойства частиц( имеют массу и заряд), с другой стороны при движении они обладают свойствами электромагнитной волны.
3) Квантовая механика отрицает наличие определенных орбит у микрочастиц. Для движущихся электронов невозможно определить точное местоположение. Они находятся в пространстве в близи атомного ядра.
Пространство в близи ядра, в котором достаточно велика вероятность нахождения электрона (90%), называется орбиталью. Это пространство ограничивается поверхностью, т.е. представляет собой объемную геометрическую фигуру.
