
Молекулярная биология клетки. Том 1
.pdf
491
Таблица 7-4. Различия между «универсальным» кодом и митохондриальными генетическими кодами*
Кодон |
«Универсальный» код |
|
Митохондриальные коды |
|
|
|
|
|
|
|
|
|
|
Млекопитающие |
Дрозофила |
Дрожжи |
Растения |
|
|
|
|
|
|
UGA |
STOP |
Тrp |
Тrр |
Тrр |
STOP |
|
|||||
AUA |
Ilе |
Met |
Met |
Met |
Ile |
CUA |
Leu |
Leu |
Leu |
Thr |
Leu |
AGA |
Arg |
STOP |
Ser |
Arg |
Arg |
|
|||||
AGG |
|
|
|
|
|
* Курсивом и цветом выделены значения кодонов, отличающиеся от «универсального» кода.
блюдаются менее строго, и многие молекулы тРНК способны узнавать любой из четырех нуклеотидов в третьей (неоднозначной) позиции (разд. 5.1.6). Такое считывание «двух из трех» дает возможность одной тРНК связываться с любым из четырех различных кодонов и позволяет обходиться меньшим числом тРНК при синтезе белка;
3) сопоставление нуклеотидных последовательностей митохондриальных генов с аминокислотными последовательностями белков выявило, возможно, самую поразительную особенность: генетический код в митохондриях видоизменен, и значения четырех из 64 кодонов отличны от значений этих кодонов в других геномах (табл. 7-4).
Почти полная идентичность генетического кода у всех организмов служит убедительным доводом в пользу того, что все клетки произошли от общего предшественника. Как же в этом случае объяснить некоторые отличия генетического кода митохондрий? Приблизиться к пониманию этого помогли недавно полученные данные о различии генетического кода в митохондриях разных организмов. Например, триплет UGA, служащий в универсальном коде стоп-кодоном, в митохондриях млекопитающих, грибов и простейших кодирует триптофан, но в митохондриях растений используется как стоп-кодон. Аналогичным образом триплет AGG, обычно кодирующий аргинин, в митохондриях млекопитающих обозначает сигнал "stop", а у дрозофилы кодирует серин (табл. 7-4). Подобные отклонения указывают на то, что в генетическом коде митохондрий могут происходить случайные перемены. Вероятно, возможность появления и закрепления в потомстве случайных изменений в значении кодона связана с необычайно малым числом белков, кодируемых митохондриальным геномом; в большом геноме подобные изменения привели бы к нарушению функции многих белков и, как следствие, к гибели клетки.
7.5.6. Митохондрии животных имеют самую простую из известных генетических систем [52]
Сравнение последовательностей ДНК у разных организмов показывает, что в митохондриальном геноме скорость замены нуклеотидов в процессе эволюции в 10 раз выше, чем в ядре, что, вероятно, объясняется снижением точности либо репликации, либо репарации митохондриальной ДНК, либо того и другого вместе. Поскольку в митохондриях животной клетки все РНК и белки образуются в результате репликации и экспрессии последовательности ДНК, состоящей всего лишь из 16500 нуклеотидов, вероятность ошибки на каждый считываемый нуклеотид
492
в ходе репликации и репарации ДНК, транскрипции с помощью РНК-полимеразы и трансляции при синтезе белка на митохондриальной рибосоме может быть относительно высокой без вреда для органеллы. По-видимому, этим и объясняется, почему механизмы таких процессов относительно просты по сравнению с теми, которые используются клеткой для тех же целей вне органелл. Например, можно предположить (хотя это еще достоверно не установлено), что наличие всего только 22 тРНК и необычно малые размеры рРНК (менее 2/3 от их величины у Е. coli) снижают точность белкового синтеза в митохондриях.
Благодаря относительно быстрой эволюции митохондриальных генов сравнение последовательностей в их ДНК может быть особенно полезным для датирования таких недавних событий, как этапы эволюции приматов (см. разд. 1.2.2).
7-35
7.5.7. Почему у растений такой большой митохондриальный геном? [52]
У растений геном митохондрий значительно больше, чем в животных клетках, и содержание митохондриальной ДНК варьирует в широких пределах - примерно от 150000 до 2,5 млн. пар нуклеотидов. И тем не менее митохондриальный геном у растений, видимо, кодирует немногим больше белков, чем у животных. К этому можно еще добавить, что, например, внутри одного из семейств растений (тыквенных) размеры митохондриального генома различаются в семь раз; а линейный митохондриальный геном зеленой водоросли Chlamydomonas имеет такие же размеры, как и в животных клетках, и составляет 16000 пар нуклеотидов.
О последовательностях нуклеотидов в митохондриальной ДНК высших растений сведений очень мало, но секвенирован почти полностью большой (78 000 п. н.) митохондриальный геном дрожжей Saccharomyces cerevisiae, и оказалось, что только около трети его кодирует белки. Эти данные говорят о том, что, возможно, большая часть «избыточной» ДНК в митохондриях дрожжей (а может быть, и высших растений) не имеет существенного значения для организма.
7.5.8. Некоторые гены органелл содержат интроны [53]
В обеих детально изученных митохондриальных системах - человеческой и дрожжевой - важную роль играет процессинг РНКпредшественников. В клетках человека обе цепи митохондриальной ДНК транскрибируются с одинаковой скоростью от единственного промотора на каждой цепи, и при этом образуются две различные гигантские молекулы РНК, каждая из которых представляет собой полную копию одной цепи ДНК. Таким образом, транскрипция совершенно симметрична. Молекула РНК, транскрибированная с одной из цепей ДНК, которую называют тяжелой цепью (Н-цепью) из-за ее высокой плотности, выявляемой в градиенте CsCl, расщепляется нуклеазами, и в результате получаются две молекулы рРНК, большая часть митохондриальных тРНК и около десятка РНК, содержащих концевой поли(А). В отличие от этого процессинг РНК, транскрибированной с легкой цепи (L-цепи), приводит к образованию только восьми тРНК и одной малой РНК, содержащей поли(А). Остальные 90% нуклеотидов этого транскрипта, видимо, не несут полезной информации (будучи комплементарными кодирующей последовательности, синтезированной на другой цепи) и расщепляются. Как полагают, РНК, содержащие концевой поли(А), представляют
493
собой митохондриальные мРНК; у них отсутствует «кэп» на 5'-конце, а 3'-концевой участок поли(А) содержит около 55 нуклеотидов. Этот полинуклеотидный хвост добавляется после транскрипции при участии митохондриальной поли-А-полимеразы.
В отличие от человека у некоторых растений и грибов (включая дрожжи) митохондриальные гены содержат интроны, которые должны быть удалены из транскрипта с последующим сплайсингом (разд. 3.2.7). У растений интроны обнаружены также примерно в 20 генах хлоропластов. Многие интроны в генах органелл содержат родственные нуклеотидные последовательности, которые могут исключаться из РНК-транскриптов в результате реакции, катализируемой самой РНК (разд. 9.4.14), хотя в этом «самосплайсинге» обычно участвуют и белки. Открытие интронов в генах органелл было неожиданным с точки зрения эндосимбиотической теории происхождения энергопреобразующих органелл, так как в генах бактерий, от предков которых могли произойти митохондрии и хлоропласты, интронов не обнаружено.
У дрожжей интроны могут иметься в митохондриальном гене одного штамма, но отсутствовать в том же гене другого штамма. Повидимому, такие «факультативные» интроны способны включаться в гены и выходить из них подобно транспозонам. С другой стороны, в некоторых митохондриальных генах дрожжей интроны занимают те же позиции, что и в митохондриях Aspergillus и Neurospora; значит, они были унаследованы от общего предка этих трех грибов. Вероятно, интроны имеют древнее происхождение, и хотя они были утрачены многими бактериями, они сохранились в геномах тех органелл, где регуляция сплайсинга РНК помогает контролировать экспрессию гена (разд. 10.5.5).
7-36
7.5.9. Неменделевское (цитоплазматическое) наследование митохондриальных генов позволяет отличать их от генов клеточного
ядра [54]
По ряду причин большинство экспериментов по изучению механизмов биогенеза митохондрий проводится на культурах Saccharomyces carlsbergensis (пивные дрожжи) и S. cerevisiae (пекарские дрожжи). Во-первых, при росте на глюкозе эти дрожжи обнаруживают уникальную способность существовать только за счет гликолиза и поэтому могут обходиться без функционально активных митохондрий, т.е. без окислительного фосфорилирования. Это дает возможность работать с клетками, митохондриальная и ядерная ДНК которых несут мутации, препятствующие нормальному развитию митохондрий. Такие мутации летальны почти у всех организмов. Во-вторых, дрожжи - простые одноклеточные эукариоты - легко выращивать и подвергать биохимическим исследованиям. И наконец, у дрожжей, обычно размножающихся бесполым способом путем почкования (асимметричного митоза), встречается и половой процесс. При половом размножении две гаплоидные клетки сливаются, образуя диплоидную зиготу, которая затем либо делится путем митоза, либо претерпевает мейоз и снова дает гаплоидные клетки. Возможность контролировать в лабораторных условиях чередование бесполого и полового размножения (разд. 13.2) намного облегчает проведение генетического анализа. Такой анализ позволяет выявить гены, ответственные за функцию митохондрий, и установить, которые из них находятся в ядерной ДНК и которые - в митохондриальной, поскольку мутации митохондриальных генов не наследуются по законам Менделя, которым подчиняется наследование ядерных генов.

494
Рис. 7-71. Различие в схеме наследования митохондриальных и ядерных генов у дрожжей. Две дрожжевые клетки из четырех, образовавшихся в результате мейоза, получают тот или иной ядерный ген от одной гаплоидной родительской клетки, а две другие - от другой (менделевское наследование). В отличие от этого в результате постепенной митотической сегрегации митохондрий в период вегетативного роста (см. текст) вполне может случиться, что все четыре клетки, образовавшиеся при мейозе, получат митохондриальные гены только от одной из двух гаплоидных родительских клеток (неменделевское, или цитоплазматическое, наследование). В этом примере мутация митохондриального гена придает митохондриям устойчивость к хлорамфениколу - ингибитору белкового синтеза в энергопреобразующих органеллах и бактериях (разд. 5.1.15).
На рис. 7-71 приведен пример неменделевского (цитоплазматического) наследования митохондриальных генов в потомстве гаплоидных дрожжевых клеток. Мутантный ген придает белок-синтезирующей системе митохондрий устойчивость к хлорамфениколу; дрожжевые клетки, несущие такой ген, можно легко обнаружить, выращивая культуры в присутствии хлорамфеникола на таком субстрате, как глицерол, который нельзя использовать для гликолиза. В условиях блокады гликолиза АТР будет доставляться только функционально активными митохондриями, и поэтому на такой среде способны расти лишь клетки, обладающие устойчивыми к хлорамфениколу митохондриями. При слиянии гаплоидной клетки, устойчивой к хлорамфениколу, с гаплоидной клеткой дикого типа, чувствительной к этому антибиотику, образуется диплоидная зигота, содержащая смесь митохондрий как мутантного, так и дикого типа. Но если в результате митоза от зиготы отпочкуется диплоидная дочерняя клетка, то в нее перейдет лишь небольшая часть митохондрий. После нескольких митотических циклов в какой-то из новых клеток все митохондрии могут оказаться одинаковыми - либо мутантного, либо дикого типа. Поэтому все потомство такой клетки будет иметь генетически идентичные митохондрии. Такой случайный процесс, в результате
495
которого образуется диплоидное потомство с митохондриальной ДНК только одного типа, называют митотической сегрегацией. Когда диплоидная клетка с одним типом митохондрий претерпевает мейоз, все четыре дочерние гаплоидные клетки получают одинаковые митохондриальные гены. Этот тип наследования называют неменделевским, или цитоплазматтеским, в отличие от менделевского наследования ядерных генов (рис. 7-71); он указывает на то, что изучаемый ген находится вне ядерных хромосом, т.е., вероятно, в органеллах цитоплазмы.
7.5.10. У многих организмов гены органелл наследуются по материнской линии [55]
Для некоторых организмов, в том числе и для человека, последствия цитоплазматической передачи генов более существенны, чем для дрожжей. У дрожжей сливающиеся две гаплоидные клетки имеют одинаковые размеры и вносят в зиготу одинаковое количество митохондриальной ДНК (рис. 7-71). Таким образом, у дрожжей митохондриальный геном наследуется от обоих родителей, вносящих равный вклад в генофонд потомства (хотя, как мы видели, спустя несколько генераций отдельные потомки нередко будут содержать митохондрии только одного из родительских типов). В отличие от этого у высших животных яйцеклетка вносит в зиготу намного больше цитоплазмы, чем спермий, а у некоторых животных спермин могут вообще не вносить цитоплазмы. Поэтому можно думать, что у высших животных митохондриальный геном будет передаваться только от одного родителя, а именно по материнской линии. Это было подтверждено в экспериментах с лабораторными животными двух линий, различающихся по типу митохондриальной ДНК. При скрещивании животных, несущих митохондриальную ДНК типа А, с животными типа В получается потомство, содержащее митохондриальную ДНК только материнского типа. Точно так же, если проследить распределение различных последовательностей митохондриальной ДНК в больших семьях, можно показать, что ДНК митохондрий и у человека наследуется по материнской линии.
Примерно у двух третей высших растений хлоропласты мужского родителя (они содержатся в пыльцевых зернах) не попадают в зиготу; таким образом, ДНК хлоропластов, так же как и митохондрий, наследуется по материнской линии. У других растений дефектные хлоропласты служат причиной пестролистности: в результате митотической сегрегации в процессе роста и развития растения смесь нормальных и дефектных хлоропластов разделяется, что приводит к образованию листьев с чередующимися зелеными и белыми участками; в зеленых участках содержатся нормальные хлоропласты, а в белых - дефектные.
7.5.11. Как показывает изучение мутантов "petite" у дрожжей, важнейшую роль в биогенезе митохондрий играет клеточное ядро
Ключевую роль в анализе биогенеза митохондрий сыграли генетические исследования на дрожжах. Ярким примером служит изучение мутантов с обширными делециями в митохондриальной ДНК, которая приводит к полному прекращению белкового синтеза в митохондриях. Не удивительно поэтому, что у таких мутантов отсутствуют «дышащие» митохондрии. Редко встречающаяся, но важная группа таких мутантов вообще не имеет митохондриальной ДНК. Так как при росте на среде с низким содержанием глюкозы такие мутанты образуют необычно мелкие колонии, всех мутантов с дефектными митохондриями называют цитоплазматическими мутантами petite.
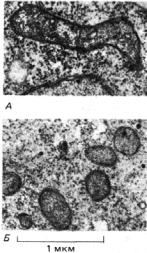
496
Рис. 7-72. Электронные микрофотографии тонких срезов дрожжевых клеток; можно видеть строение нормальных митохондрий (А) и строение митохондрий у мутанта petite, у которого отсутствуют все белки, кодируемые митохондриальным геномом (Б). В последнем случае органелла состоит только из белков, кодируемых ядерным геномом. (С любезного разрешения Barbara Stevens.)
Хотя у мутантов petite нет митохондриального синтеза белка и поэтому они не образуют митохондрий, способных синтезировать АТР, тем не менее у них есть митохондрии с нормальной наружной мембраной, но с плохо развитыми кристами внутренней мембраны (рис. 7-72). В таких митохондриях имеются практически все митохондриальные белки, кодируемые ядерным геномом и переносимые в органеллу из цитозоля, в том числе ДНК- и РНК-полимеразы, все ферменты цикла лимонной кислоты и большинство белков внутренней мембраны. Это наглядно демонстрирует преобладающую роль ядерного генома в биогенезе митохондрий. Кроме того, ясно, что органеллы, способные делиться надвое, могут неопределенно долго воспроизводиться в цитоплазме пролиферирующих эукариотических клеток даже при полном отсутствии собственного генома. Многие биологи полагают, что таким же путем обычно воспроизводятся пероксисомы (разд. 8.5.2).
Что касается хлоропластов, то здесь ближайшими аналогами дрожжевых митохондриальных мутантов petite могут служить мутанты таких одноклеточных водорослей, как Euglena. Клетки, в которых отсутствует хлоропластный синтез белка, все же содержат хлоропласты и вполне жизнеспособны при наличии окисляемых субстратов. Однако если у высших растений развитие зрелых хлоропластов блокировано из-за отсутствия света (разд. 20.4.1), из-за дефектов их ДНК или ее полного отсутствия, то такие растения погибают, как только запасы питательных веществ истощаются.
7-37
7.5.12. Образование митохондрий и хлоропластов регулируется белками, кодируемыми ядерным геномом [57]
Генетические системы ядра и органелл должны координировать свое участие в построении митохондрий и хлоропластов. Общий контроль, несомненно, осуществляется ядром, поскольку у мутантов с блокированным синтезом белка в органеллах митохондрии и хлоропласты образуются в нормальных количествах, хотя и с нарушенной функцией. В некоторых из таких функционально дефектных органелл продолжается синтез ДНК и частично РНК, из чего следует, что все необходимые для этих процессов белки кодируются ядерными генами.
Ядро должно регулировать число митохондрий и хлоропластов в соответствии с потребностью клетки; ядро должно также контролировать количество белков, синтезируемых на рибосомах внутри органелл, чтобы поддерживать надлежащий баланс между участием ядра и органелл в биогенезе митохондрий и хлоропластов. Хотя эти регуляторные аспекты имеют ключевое значение для понимания гомеостаза эукариотических клеток, наши знания об этом недостаточны.
Ядерную регуляцию белкового синтеза в митохондриях интенсивно изучали на дрожжевых мутантах. У Saccharomyces cerevisiae было выделено множество мутантов с изменениями в ядерном (а также и в митохондриальном - см. разд. 7.5.9) геноме, не способных к образованию дышащих митохондрий. Каждый из этих ядерных мутантов petite имеет один дефектный белок, кодируемый ядерной ДНК и необходимый для функционирования митохондрий. Выращивая дрожжевые культуры на среде с мечеными аминокислотами и циклогексимидом, подавляющим синтез белков, кодируемых ядерными генами, можно установить, какое влияние оказывает каждая из таких ядерных мутаций на экспрессию митохондриальных генов. Оказалось, что мутации ядерных генов, кодирующих митохондриальные белки, непосредственно связанные с дыхательной функцией митохондрий (такие, как одна из субсединиц АТР-
497
синтетазы или один из ферментов цикла лимонной кислоты), как и следовало ожидать, не влияют на белковый синтез в митохондриях. Мутации же тех генов ядра, в которых закодированы белки митохондриальных рибосом или субъединицы митохондриальной РНК-полимеразы, блокируют в митохондриях синтез всех белков.
К регуляторным процессам наибольшее отношение имеет третья группа ядерных мутантов petite, у которых отсутствуют или изменены один или несколько генных продуктов, кодируемых митохондриальной ДНК. В ядре дрожжевой клетки обнаружено более 50 таких генов, и некоторые из них, необходимые для экспрессии того или иного митохондриального гена, уже подвергнуты клонированию и охарактеризованы. Часть этих генов кодирует белки, которые, видимо, воздействуют прямо на определенную молекулу мРНК, повышая либо ее стабильность, либо эффективность ее использования в митохондриальном белковом синтезе. Продукты других генов участвуют в сплайсинге митохондриальной РНК и, следовательно, необходимы для экспрессии тех генов митохондрий, которые содержат интроны. Как полагают, оба типа ядерных генов участвуют в регуляции функций белков, кодируемых митохондрией, в соответствии с метаболическими потребностями клетки, однако механизмы этой регуляции не известны.
Хотя главная роль и принадлежит ядру, есть данные о том, что взаимодействие генетических систем ядра и митохондрий происходит в обоих направлениях. Например, если в интактной клетке блокировать митохондриальный синтез белка, то будет наблюдаться повышенное образование переносимых в органеллу ферментов, участвующих в синтезе митохондриальных ДНК, РНК и белков, как будто клетка пытается преодолеть эту блокаду. Природу сигнала, посылаемого от митохондрий к ядру, еще предстоит выяснить.
7.5.13. Энергопреобразующие органеллы содержат тканеспецифические белки [58]
Клетка регулирует функции митохондрий и более обычными способами. У млекопитающих главным метаболическим путем переработки азотсодержащих продуктов обмена служит цикл мочевины. Образующаяся при этом мочевина выводится с мочой. Ферменты, кодируемые ядерным геномом, катализируют несколько этапов этого цикла в митохондриальном матриксе. Мочевина образуется лишь в некоторых органах, таких как печень, и ферменты цикла мочевины синтезируются и переходят в митохондрии только в этих органах. Кроме того, дыхательные ферментные комплексы, входящие в состав внутренней митохондриальной мембраны, у млекопитающих содержат несколько тканеспецифических субъединиц, которые кодируются ядром и, вероятно, действуют как регуляторы переноса электронов. Например, у некоторых людей с наследственным заболеванием мышц одна из субъединиц цитохромоксидазы дефектна; поскольку эта субъединица специфична для скелетных мышц, волокна сердечной мышцы у этих людей функционируют нормально, что позволяет таким больным выживать. Как и следовало ожидать, тканеспецифические различия свойственны и хлоропластным белкам, кодируемым ядерными генами.
Рассмотрим теперь, каким образом специфические цитоплазматические белки переносятся в митохондрии и хлоропласты; более детально этот вопрос обсуждается в гл. 8.

498
7.5.14. Перенос белков в митохондрии и хлоропласты требует затраты энергии [59]
Большая часть белков, содержащихся в митохондриях и хлоропластах, импортируется этими органеллами из цитозоля (разд. 8.4). В связи с этим возникают два вопроса: как клетка направляет белки к надлежащей органелле и каким образом эти белки проникают в нее?
Частичный ответ был получен при изучении транспорта малой субъединицы (S) рибулозобисфосфат-карбоксилазы в строму хлоропласта. Если мРНК, выделенную из цитоплазмы одноклеточной водоросли Chlamydomonas или из листьев гороха, ввести в качестве матрицы в белоксинтезирующую систему in vitro, то одним из многих образующихся белков будет предшественник S-белка, называемый пpo-S, который больше S на 50 аминокислотных остатков. При инкубации белка пpo-S с интактными хлоропластами он проникает в органеллы и превращается там под действием эндопептидазы в S-белок. Затем этот S-белок связывается с большой субъединицей рибулозобисфосфат-карбоксилазы, синтезируемой на рибосомах хлоропласта, и образует с нею в строме активный фермент. Перенос белка пpo-S в хлоропласт, как и следовало ожидать для процессов этого типа, требует затраты энергии, которую доставляет гидролиз АТР (разд. 8.4.7).
Сходным образом осуществляется и транспорт белков внутрь митохондрий. Если очищенные митохондрии дрожжей инкубировать с клеточным экстрактом, содержащим только что синтезированные радиоактивные дрожжевые белки, то можно наблюдать, что митохондриальные белки, кодируемые ядерным геномом, избирательно включаются в митохондрии - точно так же, как это происходит в интактной клетке. При этом белки наружной и внутренней мембран, матрикса и межмебранного пространства находят свой путь к соответствующему компартменту митохондрии (см. рис. 8-30).
По-видимому, транспорт белков через мембраны митохондрий и хлоропластов происходит в специальных контактных зонах, где внутренняя и наружная мембраны соединяются (рис. 7-73). Белки приходят сюда в форме предшественников, содержащих особый сигнальный пептид. Для того чтобы транспортируемый белок мог быть перенесен в органеллу в такой зоне, его пептидная цепь должна развернуться (см. разд. 8.4.4).
7.5.15. Хлоропласты сами синтезируют большую часть своих липидов, а митохондрии в основном получают их из цитозоля [60]
Помимо нуклеиновых кислот и белков для построения новых митохондрий и хлоропластов нужны липиды. Все необходимые хлоропластам липиды обычно образуются в самих органеллах. В листьях шпината, например, синтез всех жирных кислот клетки происходит в хлоропластах, и только образование ненасыщенных связей в их молекулах - в других местах. Даже важнейшие гликолипиды хлоропластов образуются в них самих.
В отличие от этого митохондрии получают большую часть своих липидов извне. В животных клетках фосфолипиды фосфатидилхолин и фосфатидилсерин синтезируются в эндоплазматическом ретикулуме и затем переходят в наружную мембрану митохондрий. Полагают (хотя это еще не доказано), что в процессе переноса участвуют специальные белки (разд. 8.6.15), а затем липиды включаются во внутреннюю мембрану - повидимому, в местах контакта двух мембран. Помимо декарбоксилирования получаемого извне фосфатидилсерина до фосфати-
Рис. 7-73. Контактные участки. А. Схематическое изображение небольшой части митохондрии или хлоропласта, содержащей контактную область мембраны. Видимо, такие области участвуют в избирательном переносе белков в органеллу. Недавно контактные участки (называемые также контактными зонами) были выделены, и их специфические белковые компоненты в настоящее время изучаются. Через эти зоны переносятся белки, кодируемые клеточным ядром и синтезируемые в цитозоле. Б. Электронная микрофотография небольшого участка хлоропласта гороха, в котором контактная область (показана стрелками) помечена коньюгатами антител с золотом, которые, как полагают, связываются интегральным мембранным белком, участвующим в транспорте белков. (Из D. Pain, J. S. Kanwar, G. Blobel, Nature, 331, 232-237, 6, 1988.)

499
дилэтаноламина, митохондрии сами катализируют превращение приносимых в органеллу липидов в кардиолипин. Кардиолипин представляет собой «двойной» фосфолипид, содержащий четыре остатка жирной кислоты; этот липид содержится главным образом во внутренней мембране митохондрии, где составляет около 20% всех липидов.
7-38
7.5.16. Митохондрии и хлоропласты, вероятно, произошли от эндосимбиотических бактерий [61]
Как уже говорилось в гл. 1, «прокариотический» характер генетической системы органелл, особенно ярко выраженный у хлоропластов, позволяет предполагать, что митохондрии и хлоропласты произошли от бактерий, некогда поглощенных путем эндоцитоза. Согласно этой эндосимбиотической гипотезе, клетки эукариот в начале своего эволюционного пути были анаэробными организмами без митохондрий и хлоропластов, а затем вступили в прочный симбиоз с бактериями и приспособили их систему окислительного фосфорилирования для своих нужд (рис. 7-74). Полагают, что событие, приведшее к появлению митохондрий, произошло 1,5 млрд. лет назад, когда в атмосферу поступило значительное количество кислорода, еще до разделения линий животных и растений (см. рис. 7-61). Вероятно, хлоропласты растений и водорослей появились позднее в результате другого эндосимбиоза, когда клеткой были захвачены фотосинтезирующие бактерии, выделяющие молекулярный кислород. Обычно предполагают, что произошло по меньшей мере три независимых события этого рода, так как тогда можно было бы объяснить различие пигментов и других особенностей у современных высших растений и у зеленых, бурых и красных водорослей (см. рис. 7-62).
Рис. 7-74. Предполагаемый путь эволюционного происхождения митохондрий (выделены цветом). Иногда считают, что все митохондрии произошли от одного и того же предка, однако митохондрии таких эволюционно далеких друг от друга форм, как трипаносомы и эвгленовые (см. рис. 1-16), могли возникнуть в результате независимых эндосимбиозов. Микроспоридии (Microsporidia, Protozoa) - coвременные анаэробные одноклеточные эукариоты, обитающие в кишечнике многих животных, не имеют митохондрий. Поскольку анализ нуклеотидной последовательности рРНК этих микроорганизмов показал, что в эволюционном отношении они очень далеки от всех других известных эукариот, предполагают, что предки микроспоридий тоже были анаэробами и были сходны с тем эукариотическим организмом, который впервые поглотил предка митохондрий (разд. 1.2.6).
500
Так как большинство генов, кодирующих белки современных митохондрий и хлоропластов, находится в ядерном геноме, можно думать, что в ходе эволюции эукариот значительная часть генов органелл была перенесена в ядерную ДНК. Это позволило бы объяснить, почему некоторые из ядерных генов, кодирующих митохондриальные белки, сходны с генами бактерий. Так, например, у курицы N-концевая аминокислотная последовательность митохондриального фермента супероксиддисмутазы гораздо больше похожа на соответствующий сегмент супероксиддисмутазы бактерий, чем на N-концевой участок того же фермента, выделенного из цитозоля тех же эукариотических клеток. Еще одним указанием на то, что подобные переносы участков происходили в ходе эволюции, служат обнаруженные в ядерном геноме некодирующие последовательности ДНК, имеющие, вероятно, недавнее митохондриальное происхождение; очевидно, что эти последовательности были интегрированы в ядерный геном как «балластная» ДНК.
Какой же тип бактерий дал начало митохондриям? Расшифровка полной аминокислотной последовательности и трехмерный рентгеноструктурный анализ цитохромов типа с из различных бактерий выявили близкое сходство этих белков между собой и с цитохромом с дыхательной цепи митохондрий растительных и животных клеток. На основе этих и других биохимических данных было предложено эволюционное древо, изображенное на рис. 7-62. По-видимому, митохондрии произошли от особого рода пурпурных фотосинтезирующих бактерий, которые утратили способность к фотосинтезу и сохранили только дыхательную цепь. Однако до сих пор не ясно, все ли митохондрии (так же как и хлоропласты) возникли в результате одного единственного случая эндосимбиоза. Хотя митохондрии простейших имеют отчетливо выраженные прокариотические свойства, некоторые из них достаточно отличаются от митохондрий растительных и животных клеток, чтобы можно было предположить их независимое происхождение.
7.5.17. Для чего митохондриям и хлоропластам собственная генетическая система? [62]
Почему митохондриям и хлоропластам необходима собственная генетическая система, тогда как другие органеллы, например пероксисомы и лизосомы, ее не имеют? Этот вопрос совсем не тривиален, так как поддержание отдельной генетической системы дорого обходится клетке: специально для этих целей в ядерном геноме должно быть закодировано более 90 белков, в том числе много рибосомных белков, аминоациал-тРНК-синтетазы, ДНК- и РНК-полимеразы, ферменты процессинга и модификации РНК (рис. 7-75). Большинство изученных белков из митохондрий и хлоропластов отличаются по аминокислотной последовательности от своих аналогов из других частей клетки, и есть основание полагать, что в этих органеллах сравнительно мало таких белков, которые могли бы встретиться еще где-нибудь. Это означает, что только для поддержания генетической системы каждого вида энергетических органелл в ядерном геноме должно быть не менее 90 дополнительных генов. Причины такого «расточительства» неясны, и надежда на то, что разгадка будет найдена в нуклеотидных последовательностях митохондриальной ДНК, не оправдалась. Трудно представить себе, почему образующиеся в митохондриях белки должны непременно синтезироваться там, а не в цитозоле.
Одно время предполагалось, что некоторые из синтезируемых внутри органеллы белков слишком гидрофобны, чтобы пройти сквозь ее мембрану из цитозоля. Однако полученные позже данные показали, что такое объяснение неправдоподобно. Во многих случаях даже высоко-
