
Контрольная Химия
.pdfHNO3+Zn = N2O + Zn(NO3)2 + H2O
9.Определите, на сколько градусов следует повысить температуру, чтобы скорость реакции возросла в 8 раз, если температурный коэффициент скорости равен 2
10.Вычислите, какая масса фосфорита с массовой долей примесей 12 % необходима для получения фосфора массой 200 г
Вариант № 13.
1.Найдите массу, количество вещества и число молекул 34 г аммиака
2.Написать реакцию ионного обмена между следующими веществами (полное и сокращенное ионное уравнения): BaCl2 и Na3PO4
3.Определить энтальпию реакции: CuO(т) + 2HCl(г) = CuCl2(т) + H2O(ж). Данная реакция является экзотермической или эндотермической?
4.Как повлияет уменьшение давления на равновесие в реакциях: 1)N2O4(г) = 2NO2(г);
2)2NO(г) + O2(г) = 2NO2(г);
3)Fe2O3(к) + CO(г) = 2Fe3O4(к) + CO2(г).
5.Рассчитайте молярность и нормальность 2,6 %-ного раствора карбоната калия (ρ=1,02г/мл)
6.Написать характеристику элемента (символ, название, порядковый номер, число протонов, нейтронов, электронов, относительная атомная масса, металл или неметалл), электронную и электронно-графическую формулу: № 13
7.Дать название соединения. Указать внешнюю, внутреннюю сферу, лиганды, координационное число, комплексообразователь, написать диссоциацию комплексного соединения:
[Co(NH3)4(NO3)2]NO3
8.Уравнять реакцию методом электронного баланса
PbS + HNO3 = S + Pb(NO3)2 +NO+ H2O
9.При 20 °С скорость реакции равна 0,004 моль/л·с. Определите скорость реакции при 40°С. Если температурный коэффициент скорости реакции равен 2
10.Определите массу NaOH, которую можно получить при взаимодействии соды с известковым молоком, полученным из 5кг известняка, содержащего 80%
CaCO3.
Вариант № 14.
1.Найти массу и количество вещества 4,01·1021 молекул нитрата аммония.
2.Написать реакцию ионного обмена между следующими веществами (полное и сокращенное ионное уравнения): NaOH и MgCl2
3.Как повлияет уменьшение температуры на равновесие в следующих системах: 1)A + B = 2C,∆H0 = −100кДж;
2)2D + E = 2F,∆H0 = 20кДж.
4.Газообразный этиловый спирт C2H5OH можно получить при взаимодействии
11
этилена C2H4(г) и водяных паров. Напишите термохимическое уравнение этой реакции и вычислите ее тепловой эффект
5.Рассчитайте молярность и нормальность 68,3 %-ного раствора нитрата железа (II) (ρ=2,18г/мл)
6.Написать характеристику элемента (символ, название, порядковый номер, число протонов, нейтронов, электронов, относительная атомная масса, металл или неметалл), электронную и электронно-графическую формулу: № 15
7.Дать название соединения. Указать внешнюю, внутреннюю сферу, лиганды, координационное число, комплексообразователь, написать диссоциацию комплексного соединения:
[Ag(NH3)2]Cl
8.Уравнять реакцию методом электронного баланса
I2 + Cl2 +H2O = HIO3 + HCl
9.При 20 °С скорость реакции равна 0,004 моль/л·с. Определите скорость реакции при 10°С. Если температурный коэффициент скорости реакции равен 2
10.Вычислите объем оксида углерода (IV). Который можно получить при обжиге 500 кг известняка, содержащего 92 % карбоната кальция.
Вариант № 15.
1.Найдите массу, число молекул и объем 0,1 моль CO2.
2.Написать реакцию ионного обмена между следующими веществами (полное и сокращенное ионное уравнения): BaCl2 и H2SO4
3.Как повлияет увеличение давления на равновесие реакций:
А) H2(г) + Br2(г) = 2HBr(г);
Б) CO(г) + Cl2(г) = COCl2(г).
4.При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод CS2(г). Напишите термохимическое уравнение этой реакции и вычислите ее тепловой эффект.
5.Рассчитайте молярность и нормальность 36 %-ного раствора карбоната натрия (ρ=1,22г/мл)
6.Написать характеристику элемента (символ, название, порядковый номер, число протонов, нейтронов, электронов, относительная атомная масса, металл или неметалл), электронную и электронно-графическую формулу: № 17
7.Дать название соединения. Указать внешнюю, внутреннюю сферу, лиганды, координационное число, комплексообразователь, написать диссоциацию комплексного соединения: Na[Ag(CN)2]
8.Уравнять реакцию методом электронного баланса
KBr + KBrO3 + H2SO4 = Br2 + K2SO4 + H2O
9.При 20 °С скорость реакции равна 0,004 моль/л·с. Определите скорость реакции при 0°С. Если температурный коэффициент скорости реакции равен 2
10.При взаимодействии 5 г технического магния с избытком соляной кислоты выделилось 3,36 л водорода. Вычислите массовую долю чистого магния в техническом магнии.
12
Вариант № 16.
1.Найдите количество вещества и число молекул 24,5 г серной кислоты.
2.Написать реакцию ионного обмена между следующими веществами (полное и сокращенное ионное уравнения): Na2SO3 и CaBr2
3.Как повлияет уменьшение давления на равновесие в следующих системах (все вещества газы):
1)A + B = 2C; 2)D + E = 3F.
4.Напишите термохимическое уравнение реакции образования метана CH4(г) из оксида углерода CO(г) и водорода. Сколько теплоты выделится в результате этой реакции?
5.Рассчитайте молярность и нормальность 98 %-ного раствора серной кислоты (ρ=1,84г/мл)
6.Написать характеристику элемента (символ, название, порядковый номер, число протонов, нейтронов, электронов, относительная атомная масса, металл или неметалл), электронную и электронно-графическую формулу: № 35
7.Дать название соединения. Указать внешнюю, внутреннюю сферу, лиганды, координационное число, комплексообразователь, написать диссоциацию комплексного соединения: [Co2(CO)8]
8.Уравнять реакцию методом электронного баланса
Au+ HNO3+ HCl = AuCl3+NO + H2O
9.Температурный коэффициент реакции равен 3. Во сколько раз увеличится скорость реакции при увеличении температуры на 30°С?
10.Песок массой 2 кг сплавили с гидроксидом калия, получив в результате реакции силикат калия. Определите массу полученного силиката калия, если массовая доля оксида кремния в песке равна 90%
Вариант № 17.
1.Найдите массу, число молекул и объем 0,5 моль ацетилена
2.Написать реакцию ионного обмена между следующими веществами (полное и сокращенное ионное уравнения): BaCO3 и HNO3
3.Реакция горения углерода протекает по уравнению C(т) + O2(г) = CO2(г). Вычислите стандартную энергию Гибса
4.Реакция протекает по уравнению: 2SO2(г) + O2(г) = 2SO3(ж),∆H0 = −284,2кДж.
Изменением каких параметров можно добиться смещения равновесия в сторону образования оксида серы (IV)?
6.Рассчитайте молярность и нормальность 5,67 %-ного раствора Al2(SO4)3 (ρ=1,53г/мл) Написать характеристику элемента (символ, название, порядковый номер, число протонов, нейтронов, электронов, относительная атомная масса, металл или неметалл), электронную и электронно-графическую формулу: № 10
7.Дать название соединения. Указать внешнюю, внутреннюю сферу, лиганды, координационное число, комплексообразователь, написать диссоциацию комплексного соединения:
13
Na2[Sn(OH)6]
8.Уравнять реакцию методом электронного баланса
HNO3+Zn = N2O + Zn(NO3)2 + H2O
9.Как измениться скорость реакции, уравнение которой CO+2H2→CH3OH при увеличении концентрации исходных веществ в 2 раза?
10.Вычислите, какая масса магнетита Fe3O4, содержащего 10 % примесей, необходима для получения железа массой 4 т
Вариант № 18.
1.Найдите массу и количество вещества 5,01·1021 молекул сернистой кислоты
2.Написать реакцию ионного обмена между следующими веществами (полное и сокращенное ионное уравнения): Ca(OH)2 и K2CO3
3.При взаимодействии газообразных метана и сероводорода образуются сероуглерод CS2(г) и водород. Напишите термохимическое уравнение этой реакции и вычислите ее тепловой эффект.
4.Исходные концентрации S и O2 в системе S(т) + O2(г) = SO2(г). составляют соответственно 0,8 и 0,4 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 30 % O2.
5.Рассчитайте молярность и нормальность 61,4 %-ного раствора сульфата магния (ρ=1,31г/мл)
6.Написать характеристику элемента (символ, название, порядковый номер, число протонов, нейтронов, электронов, относительная атомная масса, металл или неметалл), электронную и электронно-графическую формулу: № 18
7.Дать название соединения. Указать внешнюю, внутреннюю сферу, лиганды, координационное число, комплексообразователь, написать диссоциацию комплексного соединения: [Cr(H2O)3F3]
8.Уравнять реакцию методом электронного баланса
FeS + HNO3 = Fe(NO3)2 + S +NO+ H2O
9.Во сколько раз нужно увеличить концентрацию SO2 в реакции, уравнение которой 2SO2+O2=2SO3, чтобы изменить скорость реакции в 16 раз?
10.Образец технического карбида алюминия массой 16 г обработали избытком воды. Определите объем газа, который получили, если массовая доля примесей в карбиде составляет 10%.
Вариант № 19.
1.Найдите массу и число молекул 0,25 моль хлорида кальция
2.Написать реакцию ионного обмена между следующими веществами (полное и сокращенное ионное уравнения): AgNO3 и HCl
3.Вычислите тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода
4.Азот окисляется по уравнению: 0,5N2(г) + O2(г) ↔ NO2(г). Как изменятся
14
скорость прямой и обратной реакций, если объем системы уменьшится в 3 раза
5.Рассчитайте молярность и нормальность 36 %-ного раствора азотной кислоты (ρ=1,22г/мл)
6.Написать характеристику элемента (символ, название, порядковый номер, число протонов, нейтронов, электронов, относительная атомная масса, металл или неметалл), электронную и электронно-графическую формулу: № 4
7.Дать название соединения. Указать внешнюю, внутреннюю сферу, лиганды, координационное число, комплексообразователь, написать диссоциацию комплексного соединения: [Pt(NH3)2Cl2]
8.Уравнять реакцию методом электронного баланса
KMnO4 + K2S + H2SO4 = K2SO4 +MnSO4 +S+ H2O
9.Температурный коэффициент реакции равен 3,2. На сколько градусов нужно увеличить температуру, чтобы скорость реакции увеличилась в 104,86 раза
10.Массовая доля ZnS в цинковой обманке составляет 97 %. Определите, какой объем сероводорода образуется из 500 кг цинковой обманки
Вариант № 20.
1.Найдите количество вещества и количество молекул 36 г воды
2.Написать реакцию ионного обмена между следующими веществами (полное и сокращенное ионное уравнения): Pb3(PO4)2 и Na2SO4
3.При сгорании газообразного аммиака образуются пары воды и моноксид азота NO(г). Напишите термохимическое уравнение этой реакции и вычислите ее энтальпию
4.Окисление серы протекает по уравнению: S(т) + O2(г) ↔ SO2(г).
Как изменятся скорость прямой и обратной реакций, если объем системы увеличится в два раза?
5.Рассчитайте молярность и нормальность 20%-ного раствора соляной кислоты (ρ=1,1г/мл)
6.Написать характеристику элемента (символ, название, порядковый номер, число протонов, нейтронов, электронов, относительная атомная масса, металл или неметалл), электронную и электронно-графическую формулу: № 53
7.Дать название соединения. Указать внешнюю, внутреннюю сферу, лиганды, координационное число, комплексообразователь, написать диссоциацию комплексного соединения:
[Ag(NH3)2]Cl
8.Уравнять реакцию методом электронного баланса H2S+ Cl2+ H2O = H2SO4 + HCl
9.Температурный коэффициент скорости химической реакции равен 2,5. Во сколько раз уменьшится скорость реакции при понижении температуры на 30°С
10.При действии на мрамор массой 10,5 г соляной кислоты выделился оксид углерода (IV) объемом 2,24 л. Определите массовую долю карбоната кальция в мраморе.
15
2.ВЫБОР ИНДИВИДУАЛЬНОГО ЗАДАНИЯ
1.В контрольной работе студент выбирает условие, соответствующее номеру своего варианта.
2.Выбор варианта осуществляется по номеру в списке.
3.ТРЕБОВАНИЯ к ВЫПОЛНЕНИЮ РГР
1.Каждый студент 1-го курса должен выполнить расчетно-графическую работу по химии в срок. Срок предоставления РГР – 25 декабря
2.Работы оформляются в виде папки на листах А4, и сдаются
преподавателю.
3.Работа пишется на одной стороне листа (обратная сторона остается чистой)
4.После рецензирования преподавателем РГР может быть возвращена студенту для исправления ошибок.
5.К сдаче зачета студент допускается лишь при наличии положительной рецензии на РГР.
6.Номер варианта указывается на титульном листе (образец оформления титульного листа приведен ниже).
16
3.1 ОБРАЗЕЦ ОФОРМЛЕНИЯ ТИТУЛЬНОГО ЛИСТА
МИНИСТЕРСТВО НАУКИ и ОБРАЗОВАНИЯ РФ
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ ОТКРЫТЫЙ УНИВЕРСИТЕТ КОЛОМЕНСКИЙ ИНСТИТУТ
_________________________________________________________________
КАФЕДРА СТРОИТЕЛЬНОГО ПРОИЗВОДСТВА
Расчетно-графическая по химии
Автор: студент группы УТС-11 Иванов И.И. (вариант №5)
Рецензент: преподаватель Устинова А.П. Дата представления: «_»______2013 г
Коломна 2013
17

4. ПРИЛОЖЕНИЕ
4.1. Таблица растворимости веществ в воде
4.2. Периодическая система химических элементов Д.И. Менделеева
18
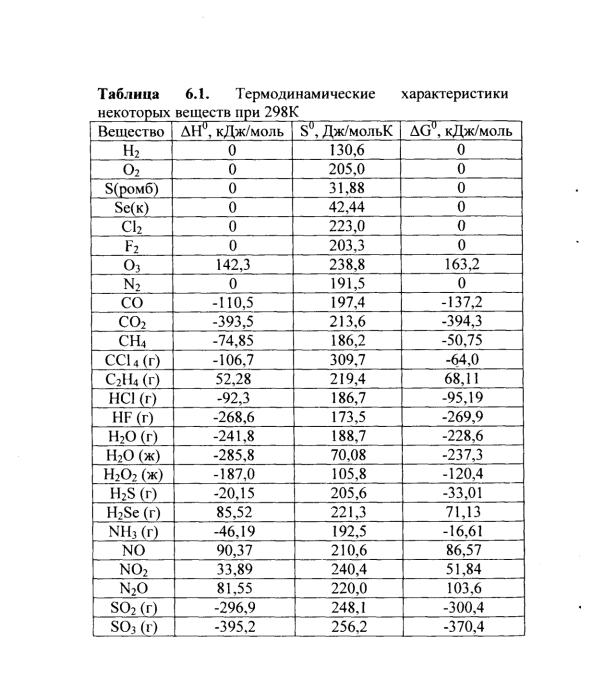
4.3. Термодинамические характеристики некоторых веществ при 298 К
19
ОГЛАВЛЕНИЕ
1.Задания ……………………………………………………….………………………3
2.Выбор индивидуального задания…………............................................................ 16
3.Требования к выполнению РГР…………..………………………………………. 16
3.1.Образец оформления титульного листа …………..……………………………..17
4.Приложение…………………………………………………………………...……..18
4.1.Таблица растворимости…………………………………………………………..18
4.2.Периодическая система химических элементов Д.И.
Менделеева………………………………………………………………………..……18
4.3. Термодинамические характеристики веществ……………………………..…..19
20
