молекулярка
.docx|
1.Предмет молекулярной генетики М.г-- это наука о механизмах воспроизведения, реализации, передачи и хранения генетической информации - это раздел генетики, описывающий структурно-функциональную организацию генетического аппарата живых систем, а также и механизмы его реализации ставит целью познание материальных основ наследственности и изменчивости живых существ путём исследования протекающих на субклеточном, молекулярном уровне процессов передачи, реализации и изменения генетической информации, а также способа её хранения. предметом являются структурно-функциональная организация генетического аппарата клеток и механизм реализации наследственной информации. Начало М.г. положила разработка модели ДНК Уотсона-Крика. Возникнув как биохимия нк, м.г пережила период бурного развития собственных методов исследования, которыми теперь отличается от биохимии. К ним, в частности, относятся методы генной инженерии, клонирования, искусственной экспрессии и нокаута генов. Поскольку ДНК является материальным носителем генетической информации, молекулярная биология значительно сблизилась с генетикой, и на стыке образовалась молекулярная генетика, являющаяся одновременно разделом генетики и молекулярной биологии. Так же, как молекулярная биология широко применяет вирусы как инструмент исследования, в вирусологии для решения своих задач используют методы молекулярной биологии. Для анализа генетической информации привлекается вычислительная техника, в связи с чем появились новые направления молекулярной генетики, которые иногда считают особыми дисциплинами: биоинформатика, геномика и протеомика
3.Свойства и ф-ии нк нк – НОСИТЕЛИ ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИИ - нерегулярные полимеры, мономерами которых являются нуклеотиды. Ф-ии: -нос-ль ген. инфии - функция обеспечивается генетическим кодом --Воспроизв-е и передача ген. информации в покол-х клеток и орг-в -функция обеспечивается процессом репликации -реализ-я ген.инф-ии - функция обеспечивается процессами транскрипции и трансляции Нк: хорошо растворимы в воде,практически не растворимы в органических растворителях,очень чувствительны к действию температуры и критических значений уровня pH. молекулы ДНК, выделенные из природных источников, способны фрагментироваться под действием механических сил, например при перемешивании раствора,нк фрагментируются ферментами — нуклеазами. Химические свойства РНК. Напоминают свойства ДНК, однако наличие дополнительных групп ОН в рибозе и меньшее содержание стабилизированных спиральных участков делает молекулы РНК химически более уязвимыми. При действии кислот или щелочей основные фрагменты полимерной цепи Р(О)-О-СН2 легко гидролизуются, группировки А, У, Г и Ц отщепляются легче. Химические свойства ДНК. В воде ДНК образует вязкие растворы, при нагревании таких растворов до 60°С или при действии щелочей двойная спираль распадается на две составляющие цепи, которые вновь могут объединиться, если вернуться к исходным условиям. В слабокислых условиях происходит гидролиз, в результате частично расщепляются фрагменты – Р-О-СН2- с образованием фрагментов – Р-ОН и НО-СН2, соответственно результате образуются мономерные, димерные к-ты, представ-е собой звенья, из которых была собрана цепь ДНК. 5. Вирусы, бактерии и эукариотические организмы как объекты М.Г Геномы организмов относительно просты в организации Быстро размножаются, легко культивируются на искусственных средах Можно получить потомство от одной исходной клетки, а именно - колонии генотипически однородных клеток Возможно изучение фенотипического проявления генов на биохимическом уровне по проявлению действия отдельных ферментов Можно легко получить разнообразные мутации Например, используются ауксотрофные мутации - мутации связанные с утерей способности к синтезу какого – либо соединения, при этом если в среду добавить вещество, синтез которого утрачен – клетки способны расти на селективной (минимальной) питательной среде, а отличии от клеток дикого типа, называемых прототрофными- способны к синтезу) Вирусы:фаг лямбда, Phi X 174 первый полностью секвенированный геном (кольцевая ДНК, содержащая 11 генов.. Прокариоты Спорулирующая Bacillus subtilis E. coli — грамотрицательная бактерия (один из основных объектов).,Bacillus subtilis — грамположительная бактерия изучение споруляции, работы жгутиков.,Mycoplasma genitalium — «минимальный организм», имеет один из самых маленьких геномов среди всех клеточных организмов,Salmonella typhimurium — грамотрицательная бактерия, патогенная для мышей и других мелких грызунов, условно патогенна для человека, используется в исследовании мутагенного и канцерогенного эффекта различных химических веществ Протисты Dictyostelium discoideum —его геном секвенирован, Tetrahymena thermophila — пресноводная инфузория; геном секвенирован. Грибы Нейроспора густая Neurospora crassa — плесень, изучение генетической регуляции метаболизма, мейоза и циркадных ритмов Растения Зелёный мох Фискомитрелла раскрытая—Пока это единственный представитель мохообразных, чей геном полностью секвенирован; разработана методика генетической трансформации для данного вида,Плаунок вида Selaginellai — эволюция растений, молекулярная биология; геном (один из самых коротких среди высших растений, около 100 мегабаз) секвенирован,,Люцерна трункатула— модельное бобовое,Кукуруза сахарная — одна из основных зерновых культур и классический генетический модельный организм; у этого диплоидного однодольного растения 10 пар крупных хромосом, которые легко изучать под микроскопом, что облегчает цитогенетические исследования; известно большое число фенотипически выраженных мутаций, гены которых закартированы, и большое число потомков от каждого скрещивания именно у кукурузы было впервые обнаружено явление цитоплазматической мужской стерильности. Геном кукурузы отсеквенирован практически полностью Беспозвоночные: нематостелла — литоральная роющая актиния. Дрозофилы — плодовая мушка, знаменитый объект генетических исследований. Легко содержится и разводится в лаборатории, имеет быструю смену поколений и множество мутаций с различным фенотипическим выражением. Позвоночные Лабораторные мыши, Фугу имеет компактный геном с небольшим количеством некодирующих последовательностей. Геном секвенирован.Серая крыса,
7. Репликация ДНК-Это процесс образования идентичных копий ДНК, осуществляемый комплексом ферментов и белков, выполняющих топологическую функцию Цель процесса - передача генетической информации в поколениях клеток и организмов Принципы репликации :Комплементарность,Антипараллельность. Униполярность. Потребность в затравке. Прерывистость. Полуконсервативность. Первые три принципа можно сформулировать в одной фразе: синтез каждой дочерней цепи ДНК идет комплементарно и антипараллельно матричной цепи и всегда в направлении 5' → 3'
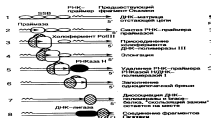
(1) запаздывающая нить, (2) лидирующая нить, (3)ДНК-полимераза, (4) ДНК-лигаза, (5) РНК-праймер, (6)праймаза, (7) фрагмент Оказаки, (8) ДНК-полимераза (Polδ), (9)хеликаза, (10) одиночная нить со связанными белками, (11)топоизомераза Репликация проходит в три этапа:инициация,элонгация,терминация. Инициация. Подготовка ДНК матрицы. Точки начала репликации на молекуле ДНК – ori-сайт - имеют специфическую последовательность оснований, богатую парами А-Т. Процесс начинается с того, что с каждой такой последовательностью связываются несколько молекул специальных узнающих белков.Далее геликаза осуществляет денатурацию ДНК, а топоизомеразы снимают напряжение еще не раскрученной ДНК. SSb-белки с свою очередь препятствуют обратной ренатурации ДНК. Элонгация. Синтез ДНК цепей. Репликационная вилка разделяется на отстающую цепь и лидирующую. Т.к ДНК-полимераза может работать только направлении 5'3', то на лидирующей цепи синтез идет непрерывно. Отстающая цепь образуется в виде фрагментов Оказаки. ДНК-полимераза III доходит до РНК-затравки предыдущего фрагмента Оказаки и отделяется. Ей на смену приходит ДНК-полимераза I, которая осуществляет последовательное отщепление нуклеотидов с 5’-конца РНК-затравки предшествующего фрагмента. Терминация. Окончание синтеза. ДНК-лигаза соединяет фрагменты Оказаки, а гираза закручивает цепочки ДНК в спираль. РНК-полимераза I (прокариот), (РНКазаН у эукариот) - удаляет РНК-праймеры. Теломераза достраивает теломерные участки хромосом эукариот. Регуляция репликации осуществляется в основном на этапе инициации. репликация может начинаться не с любого участка ДНК, а со строго определённого, называемого сайтом инициации репликации. В геноме таких сайтов может быть как всего один, так и много. Репликон — это участок ДНК, который содержит сайт инициации репликации и реплицируется после начала синтеза ДНК с этого сайта. Молекулярные механизмы, которые контролируют количество актов инициации репликации в каждом сайте за один цикл деления клетки, называются контролем копийности. Репликация начинается в сайте инициации репликации с расплетания двойной спирали ДНК, при этом формируется репликационная вилка — место непосредственной репликации ДНК. В каждом сайте может формироваться одна или две репликационные вилки в зависимости от того, является ли репликация одно- или двунаправленной. ДНК расходятся, образуют репликационную вилку, и каждая из них становится матрицей, на которой синтезируется новая комплементарная цепь. В результате образуются две новые двуспиральные молекулы ДНК, идентичные родительской молекуле. 10. Понятие о репликоне. Хромосома как полирепликон. Репликон - участок ДНК между двумя ori. Размер репликона соответствует размеру последовательности ДНК, расположенной между активными смежными репликонами. Каждая эукариотическая хромосома - полирепликон
13.
Инициация репликации ДНК у E.coli
и её регуляция. Связь репликации с
ростом и делением DnaA
распознает oriC
и играет ключевую роль в сборке
реплисомы. реплисома
–
многокомпонентный белковый комплекс,
осуществляющей двунаправленный синтез
ДНК Этапы
инициации синтеза ДНК на ori.Сборка
исходного
комплекса
начинается с взаимодействия белка
DnaA
+ ATP
с DnaA-боксами
R1–R4
и M.
В присутствии ATP
(5 мМ) исходный комплекс превращается
в открытый
комплекс,
где происходит частичное расплетение
АТ-богатых 13 н повторов, при участии
структурирующего белка HU
или интеграционного фактора
бактерии-хозяина IHF.
DnaA
вытесняет SSB-белок,
подготавливая одноцепочечные участки
частично расплетенной ДНК , с которыми
взаимодействует белок DnaB
(хеликаза) образуя препраймирующий
комплекс I.
Гексамер
DnaB
связан с шестью мономерами DnaC
и с шестью молекулами АТФВ результате
гидролиза АТФ, DnaC
освобождается из комплекса, хеликаза
DnaB
активируется вблизи DnaA-боксов
R2,
R3,
и R4
и образуется препраймирующий
комплекс II.
DnaB
взаимодействует с DnaG-праймазой,
а белок DnaA
освобождается из комплексаПри
образовании реплисомы происходит
АТФ-зависимое формирование комплекса
холофермента ДНК-полимеразы III,
связанного с 3‘-концами праймеров.
Затем происходит координированная
элонгация праймеров, сопровождаемая
двунаправленным синтезом ведущих и
отстающих цепей ДНК.
Деление прокариотной клетки начинается спустя некоторое время после завершения цикла репликации молекулы ДНК. Вероятно, репликация бактериальной хромосомы запускает какие-то процессы, ведущие к клеточному делению. Получены данные о том, что сигналом к клеточному делению служит начало репликации ДНК, ее завершение или репликация определенного локуса бактериальной хромосомы. Таким образом, в норме существует вполне определенная временная связь между репликацией хромосомы и делением бактериальной клетки. Воздействия различными химическими веществами и физическими факторами, приводящие к подавлению репликации ДНК, останавливают и клеточное деление. Однако при некоторых условиях связь между обоими процессами может быть нарушена, и клетки способны делиться в отсутствие синтеза ДНК. Это удалось получить введением определенных мутаций в генетический аппарат бактериальной клетки. Нарушить последовательность процессов репликации бактериальной хромосомы и клеточного деления также можно, выращивая бактерии при разной температуре. Культивирование Bacillus subtilis на богатой питательной среде при 37° приводит к интенсивному делению бактериальной хромосомы и росту клеток, в результате чего в культуре образуются нитевидные клетки, содержащие множество хромосомных копий с отсутствующими совсем или незамкнутыми поперечными перегородками. При замедлении скорости роста наблюдается деление нитевидных клеток, приводящее к образованию бактериальных клеток нормальной длины. |
2.Основные этапы развития 1868-Обнаружен нуклеин. Его современное название - хроматин. Фридрих Мишер 1889-Показано, что нуклеин содержит нуклеиновую кислоту и белок. Введен термин "нуклеиновая кислота". Рихард Альтман 1900-Установлена структура азотистых оснований. 1909-В нуклеиновых кислотах обнаружены фосфорная кислота и рибоза. Левин 1930-Найдена дезоксирибоза. Левин 1938-Методом рентгеноструктурного анализа показано, что расстояние между нуклеотидами в ДНК равно 3,4 Å. Азотистые основания в ДНК уложены стопками. Уильям Астбюри, Флорин Белл 1940-Сформулирована гипотеза - "Один ген - один фермент". Джордж Бидл и Эдуард Татум 1944-Получены доказательства генетической роли ДНК. Освальд Эйвери, Колин Мак-Леод, Маклин Мак-Карти 1947-Установлено, что в ДНК есть водородные связи между группами N-H и C=O. Гулланд 1953-С помощью кислотного гидролиза ДНК с последующей хроматографией и количественным анализом установлены закономерности: А/Т=1; Г/Ц=1; (Г+Ц)/(А+Т)=К - коэффициент специфичности, постоянен для каждого вида. Эрвин Чаргафф 1953-Установление структуры ДНК. Джеймс Уотсон, Френсис Крик 1961-Открытие генетической регуляции синтеза ферментов. Андре Львов, Франсуа Жакоб, Жак Моно 1962-Расшифровка генетического кода. Маршалл Нирнберг, Генрих Маттеи, Северо Очоа 53-62-Сформулирована центральная догма молекулярной биологии - перенос генетической информации идет в направлении ДНК→РНК→белок 70-Химический синтез гена. Гобинд Корана 70-Открытие фермента обратной транскриптазы и явления обратной транскрипции. Говард Темин, Дэвид Балтимор, Ренато Дульбеко 74-Открытие рестриктаз. Гамильтон Смит, Даниэль Натанс, Вернер Арбер 78-Открытие сплайсинга. Филипп Шарп 82- Открытие автосплайсинга. Томас Чек 90-92-Инициирован проект «Геном человека», информация о последовательностях генов начала увеличиваться экспоненциально 97-Расшифрован геном E.coli K12-MG1655 (4,6 Mbp) 2000-расшифрован геном Dr.melanogaster (137 Mbp) 00-Расшифрован геном A.thalianar (115 Mbp) 01-Расшифрован геном человека 06-Реализация программ по секвенированию геномов про- и эукариот
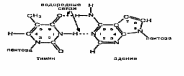
4.Принципы строения ДНК и РНК ДНК в длину не более 1ОО—200 нм. Молекула ДНК по массе достигает 6*1О-12 грамма.Ген. инф-я, заключенная в ДНК, состоит из последовательности нуклеотидов. ДНК состоит из 4х нуклеотидов, которые соответствуют четырем азотистым основаниям: А, Г, Т и Ц. Основную структурную цепь молекулы ДНК образуют последовательно соединенные друг с другом молекулы пентозы и ортофосфорной кислоты. Цепь ДНК представляет углеводно-фосфатную последовательность, с которой соединены азотистые основания. Углеводные и фосфатные группы выполняют только структурную функцию. Молекулы ортофосфорной кислоты соединяют между собой молекулы дезоксирибозы за счет образования химических связей.Молекула ДНК имеет 2 цепи нуклеотидов, расположенных параллельно друг другу, но в обратной последовательности. Эти цепи удерживаются между собой за счет водородных связей между парами А - Т и Г - Ц. При этом азотистые основания располагаются внутри спирали. Водородные связи образуются между любым электроотрицательным атомом, например кислородом Т или азотом А и атомом водорода, ковалентно связанным с другим электроотрицательным атомом:
Между аденином и тимином образуются две водородные связи, между гуанином и цитозином — три. Эти связи играют очень важную роль в поддержании вторичной структуры ДНК.А комплем.Т, Г-Ц СТРУКТУРА РНК Нить РНК — послед-ть рибонуклеотидов, соединенных в одну цепь. РНК имеет линейную структуру молекулы. Рибонуклеотиды соединены так, что образуют неразветвленную нить большой длины. Углеводный компонент РНК представлен рибозой. Азотистыми основаниями РНК являются аденин и гуании из пуриновых оснований и цитозин и урацил из пиримидиновых. Отличительной особенностью РНК от ДНК -для нее не характерно устойчивое спиральное строение. Структура РНК определяется последовательностью рибонуклеотидов- первичной структурой РНК. Первичная структура строго специфична и уникальна для каждого вида РНК. Первичная структура РНК представляет собой своеобразную запись биологической информации, закодированную в РНК определенным набором рибонуклеотидов, и определяет вторичную структуру, которая проявляется в закручивании нити РНК в спираль. Третичная структура также определяется первичной структурой и представляет собой пространственное расположение всей молекулы РНК. Третичная структура включает вторичную структуру и те фрагменты полинуклеотидной цепи, которые соединяют один участок вторичной структуры с другим. Это взаиморасположение и связь фрагментов РНК. Вторичная и третичная структуры РНК формируются преимущественно за счет водородных связей и гидрофобных взаимодействий между азотистыми рибонуклеиновыми основаниями. Молекулы гидрофобного вещества воздействуют силами электронного притяжения на молекулы углеводородов. От количества и расположения водородных связей и контактов гидрофобного взаимодействия зависит пространственное расположение всей молекулы рнк.
8.ДНК-полимераза ДНК-полимераза I обладает репаративной функцией, ДНК-полимераза II обладает репарационной функцией , ДНК-полимераза III синтезирует in vivo новые цепи ДНК Строение и свойства ДНК-полимеразы Корнберга (ДНК-полимеразы I): это одна полипептидная цепь с молекулярным весом 109 тыс.в состав полимеразы входят ионы цинка, она абсолютно зависима от ионов магния. Обнаружены разные каталитические активности ДНК - полимеразы I:Полимеризационная в направлении 5`→ 3`. Фермент работает только тогда, когда он находится на молекуле ДНК и имеет соответствующую конформацию Гидролитическая активность: проявляется в направлении 3'→5' и 5'→3‘
Активность 3‘ → 5' проявляется на неспаренном 3'-гидроксильном конце. Фермент возвращается при ошибке включения и "откусывает" неправильный нуклеотид. Это корректорская функция фермента.Все ДНК-полимеразы обладают этой активностью. У эукариот и их гомологи упрокариот. α-дрожжи pol1-Синтез ведущей цепи геномной ДНК в репликативной вилке; в комплексе с праймазой обеспечение синтеза праймеров на обеих цепях ДНК,β-E.coli-pol1-Заполнение брешей при эксцизионной репарации ДНК, участие в рекомбинации,γ-дрожжи MIP1-Репликация митохондриальной ДНК,δ-дрожжи, е.коли-pol3-Синтез отстающей цепи геномной ДНК в репликативной вилке,ε-pol2-Репарация ДНК, регуляция клеточного цикла,η-дрожжи RAD30,коли DinB,UmuC-Синтез ДНК на поврежденной матрице, с включением остатков А напротив тиминовых димеров.
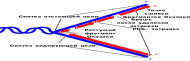
9. Схема прерывистой антипаралельной репликации Оказаки предположил, что синтез ДНК идет короткими фрагментами, короткие фрагменты должны ферментативно сшиваться. Фр.Ок— это относительно короткие фрагменты ДНК (с РНК-праймером на 5' конце), которые образуются на отстающей цепи в процессе репликации ДНК. Длина фрагментов Оказаки у E. coli составляет около 1000—2000 нуклеотидов, и обычно 100—200 нуклеотидов у эукариот. Каждый фрагмент Оказаки образуется рядом с репликационной вилкой после РНК-праймера, образуемого праймазой, и далее продолжается ДНК-полимеразой III в случае прокариот. У эукариот отстающая цепь синтезируется ДНК-полимеразой δ. Праймер позднее удаляется ферментом с эндонуклеазной активностью подобной РНКазе Н, flap-эндонуклеазами и геликазой/нуклеазой Dna2 Оказаки специально разработал два новых метода исследования Метод импульсного мечения Оказаки через короткий момент времени после добавления меченого тимидина предложил вводить 1000-кратный избыток холодного (немеченого) тимидина. Таким образом, метка включалась только в течение очень короткого времени. до Оказаки метку вводили в среду, эатем быстро отмывали клетки, при этом минимальное время подачи метки было 5 мин Метод фракционирования в щелочном градиенте сахарозы :сахароза готовится на щелочи ,в щелочной сахарозе происходит денатурация ДНК, после этого короткие фрагменты ДНК можно выявить при центрифугировании в градиенте плотности сахарозы, разделяющем молекулы по молекулярному весу,
Ведущая цепь ДНК синтезируется непрерывной, в то время как отстающая цепь синтезируется в виде фрагментов
11. Репликативный комплекс, осуществляющий синтез ведущей цепи ДНК, включает в себяминимальный (кор-) фермент ДНК-полимеразы III , подвижный связывающий бета-белок и белки гамма-комплекса , состоящего из пяти полипептидов При облучении клеток E. coli УФ-светом в них индуцируется синтез укороченного бета*-белка ,который является продуктом того же гена, что и бета-субъединица холофермента ДНК-полимеразы III . По-видимому, функциональная роль бета*-белка заключается в обеспечении репликации ДНК на матрице, поврежденной УФ-светом. Роль гамма-комплекса заключается в распознавании РНК- затравок на матричной ДНК. Гамма-комплекс связывается с единственным праймером ведущей цепи ДНК или с каждым из праймеров фрагментов Оказаки отстающей цепи, что, в свою очередь, делает возможным присоединение к промаркированным таким образом праймерам минимального фермента ДНК-полимеразы и бета-белка
Две молекулы бета-белка входят в состав репликативного комплекса вслед за белками гамма-комплекса , связываясь с ДНК позади белков гамма-комплекса и оставляя 3'-конец праймера доступным для ДНК-полимеразы. Димер бета-белка образует кольцо вокруг молекулы ДНК и стимулирует АТРазную активность белков гамма-комплекса. Функциональный аналог бета-белка образует пространственную структуру, охватывающую молекулу ДНК тремя молекулами.Бета-белки и белки гамма-комплекса, будучи связанными с дуплексом праймер-матрица, обеспечивают присоединение к этому комплексу минимального фермента ДНК-полимеразы . Затем ДНК- полимераза при наличии доступных четырех дезоксирибонуклеозидтрифосфатов, используя праймер для инициации синтеза ДНК, с высокой эффективностью синтезирует цепь ДНК, комплементарную ДНК-матрице. Те же самые белки участвуют и в синтезе отстающей цепи ДНК . В этом случае прерывистый синтез ДНК многократно инициируется на большом количестве праймеров, и ДНК синтезируется в виде фрагментов Оказаки длиной около 1000 нт. Синтез затравок, представляющих собой короткие последовательности РНК. ДНК- полимераза начинает элонгацию цепей ДНК, присоединяя первый дезоксирибонуклеозидмонофосфат к 3'-концевому нуклеотиду РНК- затравки. В процессе элонгации участвуют бета-белок и белки гамма-комплекса, которые перемещаются вдоль молекулы ДНК вместе с каталитической субъединицей ДНК-полимеразы. Ведущая и отстающая цепи ДНК реплицируются координированно, что обеспечивается димеризацией ДНК-полимеразных комплексов. холофермент ДНК-полимеразы E. coli сохраняется в виде стабильного комплекса и в отсутствие ДНК.Во время синтеза ДНК в репликативной вилке один и тот же белковый комплекс осуществляет как высоко процессивный непрерывный синтез ведущей цепи ДНК, так и прерывистый синтез фрагментов Оказаки отстающей цепи, претерпевая во втором случае периодическую диссоциацию от матрицы для инициации синтеза ДНК с каждого нового праймера. При встрече репликативного белкового комплекса с дуплексом, образованным матричной ДНК и РНК-затравкой, бета-белок остается связанным с вновь синтезированной ДНК, а у отделившихся ДНК-полимеразы и белков гамма-комплекса появляется возможность вступить в новый цикл синтеза фрагмента Оказаки путем взаимодействия с очередным дуплексом РНК-затравка-матрица. При этом вхождение ДНК-полимеразы в новый репликативный комплекс облегчается наличием в нем бета- белка и белков гамма-комплекса, ассоциированных с очередным РНК- праймером. Таким образом, холофермент ДНК-полимеразы III обладает способностью распознавать молекулярное окружение, создаваемое матричной ДНК, осуществлять терминацию синтеза ДНК при наличии сигнала в виде дуплекса ДНК-затравка и реинициировать синтез ДНК на следующем праймере. Одна и та же молекула ДНК-полимеразы III в составе реплицирующего комплекса способна проводить синтез всех фрагментов Оказаки отстающей цепи реплицируемой ДНК, последовательно осуществляя инициацию, терминацию и реинициацию синтеза каждого из них. После очередной терминации синтеза ДНК отстающей цепи 3'- конец вновь синтезированной ДНК оказывается вплотную приближенным к 5'-концу праймера следующего фрагмента Оказаки. Для соединения двух фрагментов с помощью ДНК-лигазы необходимы предварительное удаление РНК-праймера и достройка цепи ДНК в образующейся бреши. РНК-затравка удаляется с помощью РНКазы H, нуклеазы, специфически расщепляющей РНК в ДНК-РНК-гибридах, и(или) с участием 5'->3'- экзонуклеазы ДНК-полимеразы I. Во втором случае одновременно с удалением праймера происходит застройка образующейся бреши той же ДНК-полимеразой. В итоге два соседних фрагмента Оказаки вплотную приближаются друг к другу и оказываются отделенными лишь одноцепочечным разрывом, который может репарироваться ДНК- лигазой. |