
- •Задачи и разделы физической химии.
- •1.2 Основные понятия химической термодинамики.
- •1.3 Первый закон термодинамики.
- •1.4 Расчет работы расширения идеального газа в различных процессах.
- •1.5 Теплота процессов при постоянном объеме (qv) и постоянном давлении (Qp).
- •1.6 Закон Гесса.
- •1.7 Связь между Qp и qv для химических реакций.
- •1. 8 Теплоемкость вещества
- •1.9 Зависимость теплового эффекта химической реакции от температуры. Уравнение Кирхгофа.
1.7 Связь между Qp и qv для химических реакций.
Рассмотрим реакцию, протекающую при постоянном давлении p. По определению:
Н U + pV; тогда
= U + pV
Qp = QV + pV
Qp – QV = pV (23)
Если в реакции участвуют газообразные вещества, то, считая их идеальными газами, с учетом уравнения Менделеева-Клапейрона
pV = nгазRT, (24)
можно получить выражения:
= U + nгазRT или
Qp = QV + nгазRT или
Qp – QV = nгазRT,
где nгаз – изменение числа молей газообразных веществ в результате одного пробега реакции,
т.е.
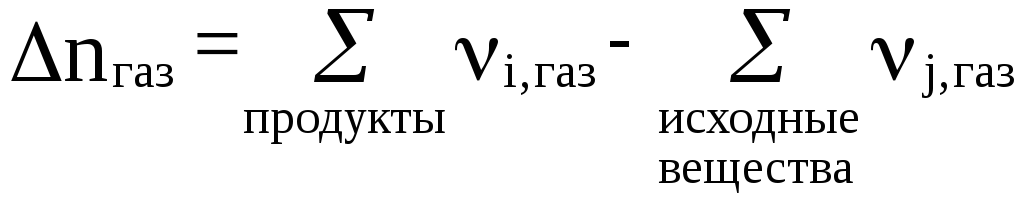 (25)
(25)
Иногда пишут вместо nгаз символы газ.
Один пробег реакции означает, что в реакцию вступило такое количество молей каждого из веществ, которое соответствует их стехиометрическим коэффициентам в уравнении реакции.
1. 8 Теплоемкость вещества
Теплоемкость – это количество теплоты, необходимое для нагревания единицы массы вещества на 1 К.
![]() (26)
(26)
Теплоёмкость, рассчитанная на 1 моль вещества, называется молярной, а на единицу массы – удельной.
Размерность
удельной теплоемкости
![]() .
.
Размерность
молярной теплоемкости
![]() .
.
Различают также понятия истинной и средней теплоемкостей.
Средней
молярной теплоемкостью
![]() в интервале температур Т1 Т2
называется отношение конечного количества
теплоты Q, которое необходимо подвести
к 1 моль вещества, чтобы изменить его
температуру от Т1
до Т2,
к разности температур Т2
– Т1:
в интервале температур Т1 Т2
называется отношение конечного количества
теплоты Q, которое необходимо подвести
к 1 моль вещества, чтобы изменить его
температуру от Т1
до Т2,
к разности температур Т2
– Т1:
![]() . (27)
. (27)
Истинная молярная теплоемкость С – это отношение бесконечно малого количества теплоты Q, которое нужно подвести к 1 моль вещества, чтобы повысить его температуру на бесконечно малую величину dT, к этому бесконечно малому приращению температуры:
![]() (28)
(28)
Существуют также теплоемкости при постоянном объеме (изохорная теплоемкость, СV) и постоянном давлении (изобарная теплоемкость, СР).
![]() ,
,
![]() .
(29)
.
(29)
Следует знать, что теплоёмкость при постоянном давлении Србольше, чем теплоёмкость при постоянном объёме СV, так как нагревание вещества при постоянном давлении сопровождается работой расширения, т.е.
![]() (30)
(30)
Для идеальных газов справедливо уравнение Майера:
![]() (31)
(31)
Величина R(универсальная газовая постоянная)равна работе расширения 1 моль идеального газа (прир=const) при увеличении его температуры на 1 градус. (R=8,314 Дж/(моль∙К)
В
справочниках приведены значения
стандартной молярной изобарной истинной
теплоемкости С0р, 298,
а также средней молярной изобарной
теплоемкости (![]() ).
).
Теплоемкость любого вещества это свойство, зависящее от температуры. Эту зависимость нельзя предсказать теоретически, она определяется экспериментально с помощью специальных устройств – калориметров.

Обычно для температур выше комнатной температурную зависимость теплоемкости записывают в виде следующих полиномов:
С0р = а + bТ + сТ2
или С0р
= а+ bТ +
![]() . (32)
. (32)
1.9 Зависимость теплового эффекта химической реакции от температуры. Уравнение Кирхгофа.
Рассмотрим при р = const реакцию:
АА + ВВ DD + ЕЕ.
Так
как
![]() , (33)
, (33)
то для рассматриваемой реакции :
r = DHD + EHE – AHA – BHB,
![]() ,
,
где i >0 для продуктов реакции, i < 0 для исходных веществ.
Здесь везде Нi – энтальпия 1 моль i-ого реагента.
Возьмем частную производную от по Т при р = const:
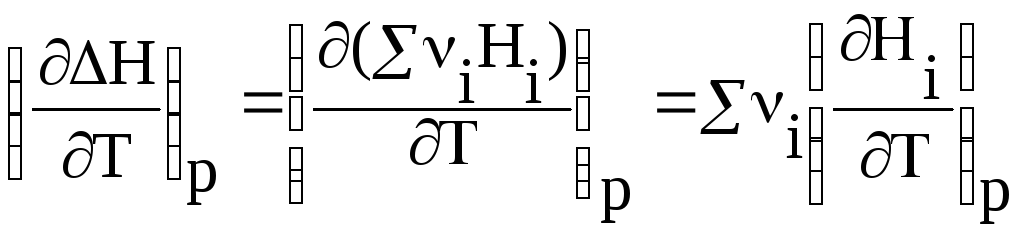 .
(33)
.
(33)
Однако, по определению теплоемкости:
![]() ,
поэтому
,
поэтому
![]() (34)
(34)
где ![]() ,
,
(Ср – изменение изобарной теплоемкости в результате одного пробега реакции).
![]() -дифференциальная
форма записи уравнения Кирхгофа.
-дифференциальная
форма записи уравнения Кирхгофа.
При
постоянном давлении p = 1 атм. ![]() (35)
(35)
Для практических расчетов уравнение Кирхгофа надо проинтегрировать, предварительно разделив переменные:
 ;
(36)
;
(36)
Получим уравнение Кирхгофа в интегральной форме:
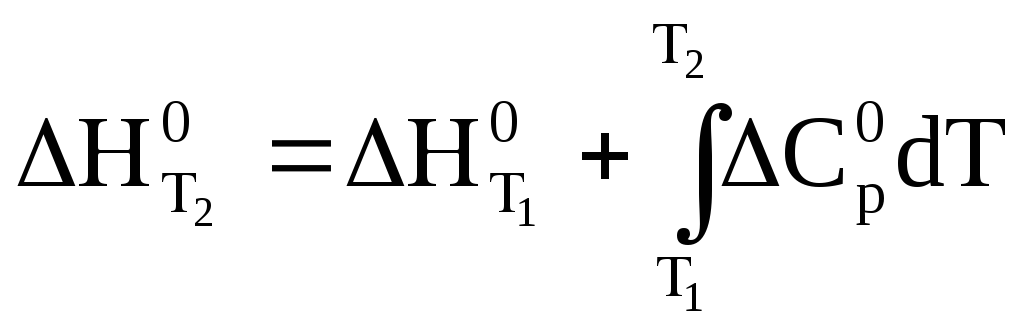 (37)
(37)
На практике удобно выбрать Т2 = Т, Т1 = 298 К. Тогда получим:
![]() ;
(38)
;
(38)
При вычислениях, в которых не нужна высокая точность, используются следующие приближения:
1) Считают,
что С0р
не зависит от температуры, и принимают
величину С0р
равной изменению средней теплоемкости
(![]() ).
).
![]() . (39)
. (39)
2) Считают, что С0р = const = С0р,298 .
![]() . (40)
. (40)
