
- •Лекция 2
- •2.1 Второй закон термодинамики.
- •2.2 Энтропия и термодинамическая вероятность системы.
- •2.3 Расчет изменения энтропии в различных процессах.
- •2.3 Постулат Планка. Третий закон термодинамики.
- •2.4 Термодинамические потенциалы. Энергия Гиббса. Энергия Гельмгольца
- •2.5 Характеристические функции. Уравнения Гиббса–Гельмгольца.
- •Самопроизвольное протекание химической реакции. Расчет изменения энергии Гиббса в химических реакциях
- •Химический потенциал.
- •Полный дифференциал внутренней энергии открытой системы можем записать
- •2.8 Активность и летучесть.
2.2 Энтропия и термодинамическая вероятность системы.
Только с развитием статистической термодинамики удалось выяснить, что стоит за энтропией. В 1896 г. Больцман показал, что смысл энтропии носит статистический (вероятностный) характер.
S = klnW, (10)
где k – коэффициент пропорциональности, называемый постоянной Больцмана или константой Больцмана
(
k = ![]() = 8,314
= 8,314 ![]() / 6,021023 моль–1
1,3810–23
/ 6,021023 моль–1
1,3810–23 ![]() ),
),
W – термодинамическая вероятность данного состояния системы.
Чем больше неупорядоченность системы, тем система более вероятна, и тем ее энтропия больше. Иными словами, можно сказать, что энтропия – это мера хаоса.
Второй закон термодинамики имеет ограниченный (статистический) характер, поскольку он применим к системам, состоящим из большого числа частиц. При этом возможны различные отклонения от второго закона (флуктуации), которые в отдельные моменты времени тем более вероятны, чем меньше частиц содержится в системе (или в отдельном элементе объема системы).
2.3 Расчет изменения энтропии в различных процессах.
Второй
закон термодинамики в виде
![]() ,
записанный для равновесных процессов,
позволяет вычислить не абсолютное
значение энтропии, а только разность
энтропий в двух состояниях системы.
,
записанный для равновесных процессов,
позволяет вычислить не абсолютное
значение энтропии, а только разность
энтропий в двух состояниях системы.
![]() .
.
Расчет изменения энтропии в необратимых процессах.
Запишем равенство и неравенство Клаузиуса для обратимого и необратимого процесса:
![]() ;
;
![]() (12)
(12)
Пусть система из состояния 1 в состояние 2 перейдет двумя путями обратимым и необратимым. Поскольку энтропия есть функция состояния, то ее изменение не зависит от пути перехода системы из одного состояния в другое, т.е. Sнеобр = Sобр =S2 S1 (13)
Поэтому для нахождения изменения энтропии реального необратимого процесса нужно разбить его на стадии, которые проводятся обратимо, вычислить для них изменения энтропии по соответствующим уравнениям для обратимых процессов, а затем просуммировать изменения энтропии S для всех стадий.
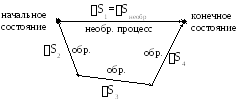
S1 = S2 + S3 + S4. (14)
Изменения энтропии в процессе фазового перехода (изотермический процесс).
К изотермическим процессам фазового перехода можно отнести плавление, кипение, и др., здесь Т =const. Данный процесс проведем обратимо и рассчитаем изменение энтропии S:
![]() ; где
(15)
; где
(15)
Q – величина теплового эффекта соответствующего фазового перехода.
Если рассматривать переход при постоянном давлении, то:
Qр=Hф.п.
![]() , где (16)
, где (16)
Hф.п – энтальпия фазового перехода.
Обычно S относят к 1 моль вещества.
Изменение энтропии при нагревании (охлаждении) вещества от Т1 до Т2
при постоянном объеме.
Рассмотрим моль вещества. При постоянном объеме Q = QV, но
QV = dU =СVdT, поэтому
![]() . (17)
. (17)
Интегрируем:
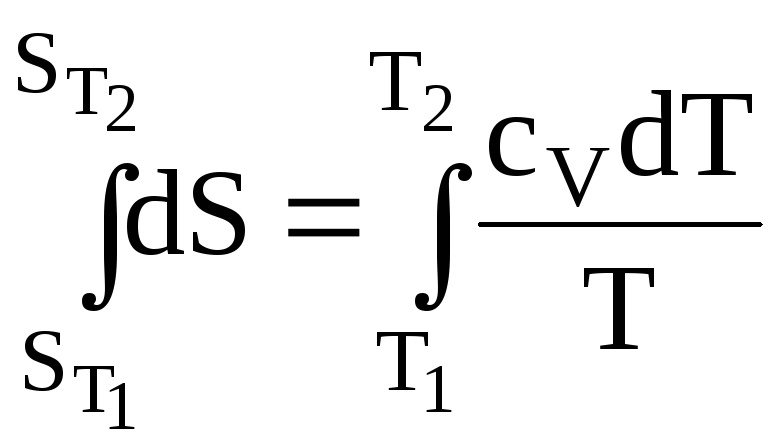 ;
; 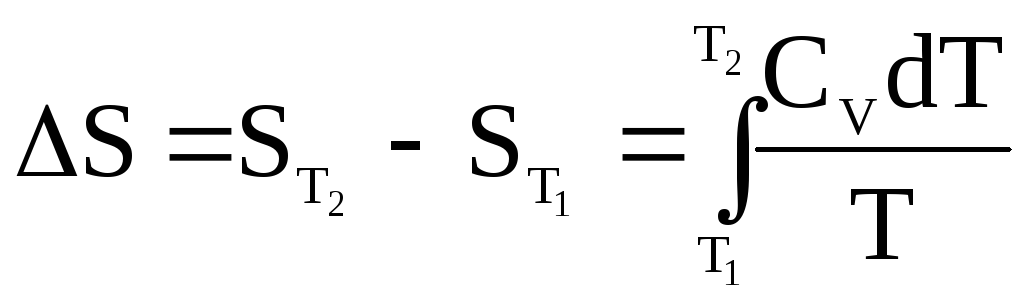 . (18)
. (18)
Если СV = const, то получаем для 1 моля:
![]() . (19)
. (19)
Изменение энтропии при нагревании (охлаждении) вещества
от Т1 до Т2 при постоянном давлении.
Аналогично предыдущему получим :
Q = Qр = dH, dH = СpdT;
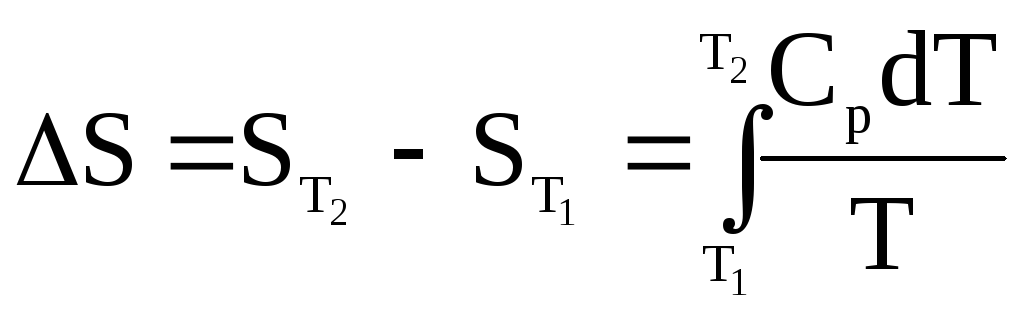 ;
(20)
;
(20)
Если р = 1 атм и С0p = const:
![]() (21)
(21)
Пример 2.1. Определить изменение энтропии при нагреве 1 моль Al от 25 до 6000С, если для него в этом интервале теплоёмкость зависит от температуры следующим образом:
![]()
![]() ,
(Дж/моль К).
,
(Дж/моль К).
Решение. Согласно уравнению (2.7) имеем:
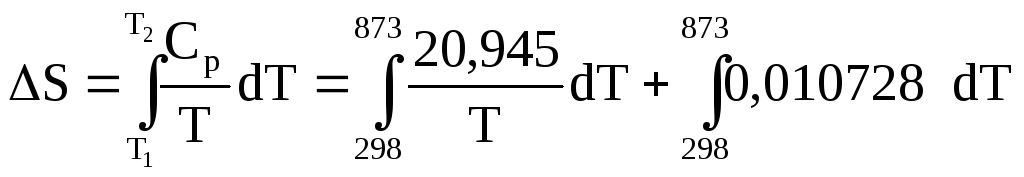 ,
,
![]() (Дж/моль К).
(Дж/моль К).
Изменение энтропии при изотермическом расширении (сжатии)
идеального газа.
Ранее из объединенного первого и второго закона термодинамики для обратимых процессов было показано, что
![]() , (22)
, (22)
но
dU = СVdT;
для 1 моля идеального газа справедливо
уравнение Менделеева-Клапейрона pV = RT,
следовательно ![]() .
Поэтому получим:
.
Поэтому получим:
![]() (23)
(23)
При
T = const dT = 0, следовательно, ![]() .
.
Проинтегрируем последнее выражение:
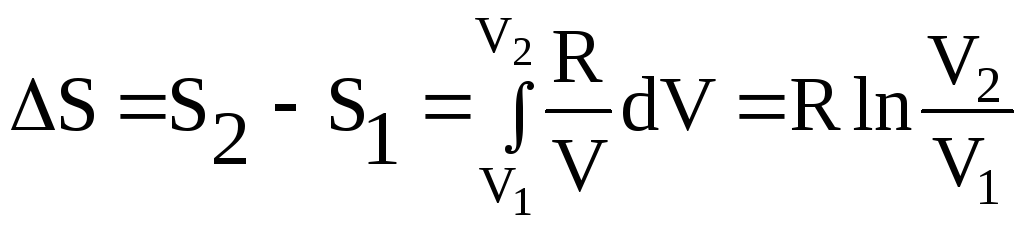 .
(24)
.
(24)
Так как при постоянной температуре для идеального газа справедлив закон Бойля-Мариотта:
р1V1 = р2V2,
то
![]() ,
,
следовательно,
![]() .
(25)
.
(25)
Изменение энтропии идеального газа при одновременном изменении его температуры и объема или при одновременном изменении его температуры и давления.
Проинтегрировав
соотношение ![]() при СV = const,
получим:
при СV = const,
получим:
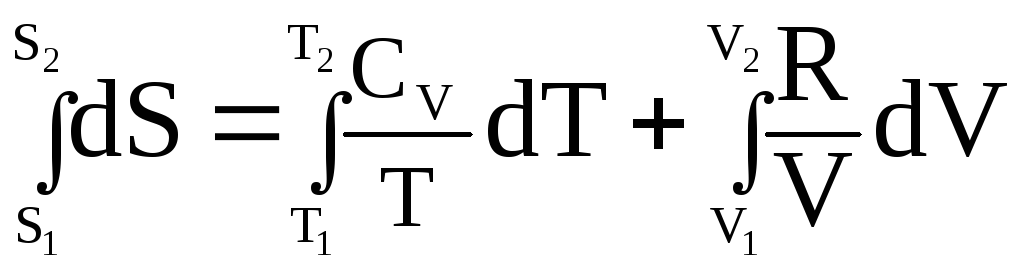 ;
(26)
;
(26)
![]() .
(27)
.
(27)
Из последнего соотношения, с учетом того, что для 1 моля идеального газа выполняется уравнение Майера (Ср – СV = R, следовательно, СV = Ср – R),
проведя
соответствующие преобразования и учтя,
что ![]() и
и ![]() (объединенный газовый закон), получим:
(объединенный газовый закон), получим:
![]() .
(28)
.
(28)
