
- •Сборник заданий
- •Задание 1 по теме "строение вещества"
- •1 Задание 1 по теме: «строение атома»
- •2.1 Опишите строение предложенных в варианте задания молекул и молекулярных ионов по методу валентных связей (мвс).
- •2.2 Строение молекул и ионов по методу молекулярных орбиталей (мо)
- •Раздел 3.1
- •3.1 Проанализируйте влияние сил межмолекулярного взаимодействия на свойства веществ (решите задачу с указанным номером).
- •Список рекомендуемой литературы
- •Задание 2 по теме: «термохимия. Направление химических реакций»
- •Примеры решения задач
- •2 Рекомендации для самостоятельной работы студентов и варианты заданий
- •3 Задачи для самостоятельного решения
- •4. Варианты заданий
- •1 Примеры решения задач
- •1.3 Вычисление константы химического равновесия
- •1.4 Вычисление равновесных концентраций
- •1.5 Направление смещения равновесия
- •Задачи для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание 4 по теме «Растворы»
- •Примеры решения задач
- •1.1 Процентная концентрация
- •1.3 Моляльная концентрация (моляльность) , мольная доля, титр
- •1.4 Осмотическое давление. Закон вант- гоффа
- •1.5 Давление насыщенного пара растворов. Тонометрический закон рауля
- •1.6 Температуры кипения и замерзания растворов.
- •2.Задачи для самостоятельного решения
- •3. Варианты заданий для самостоятельной работы
- •Список рекомендуемой литературы
- •Задание 5 по теме "растворы электролитов"
- •Примеры решения задач
- •1.1 Вычисление степени диссоциации слабых электролитов
- •1.2 Сильные электролиты. Вычисление степени электролитической диссоциации
- •1.3 Произведение растворимости
- •1.5 Обменные реакции в растворах электролитов
- •Задачи для самостоятельного решения
- •Варианты домашних заданий
- •Приложение а
- •Список рекомендуемой литературы
- •Задание 6 по теме «гидролиз солей»
- •Примеры решения задач
- •Варианты контрольных заданий
- •Приложение а
- •Список рекомендуемой литературы
- •Задание 7 по теме «Окислительно–восстановительные реакции. Электрохимия»
- •Примеры решения задач
- •2 Задания для самостоятельного решения
- •Список рекомендуемой литературы
- •Задание 8 по теме «Классификация и свойства неорганических веществ»
- •Примеры решения задач
- •Пример 5. С какими из перечисленных веществ вступит в реакцию серная кислота:koh,CuO,Ba(oh)2,Fe2o3,Al2o3,co2,SiO2,h3po4, o2,h2o? Составьте уравнения возможных реакций.
- •Задания для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание 9 по теме "Комплексные соединения"
- •Примеры решения задач
- •2 Задачи для самостоятельного решения
- •3 Варианты заданий
- •Список рекомендуемой литературы
- •Задание 10 по теме «свойства элементов и их соединений»
- •ПримерЫ решения задач
- •3 Варианты заданий
- •Список рекомендуемой литературы
- •Сборник заданий для самостоятельной работы студентов по дисциплине «Общая и неорганическая химия»
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов,1
3 Варианты заданий
|
Вариант |
Номера задач | ||||
|
1 |
2.1.1. |
2.2.1. |
2.3.1. |
2.4.1. |
2.5.1. |
|
2 |
2.1.2. |
2.2.2. |
2.3.2. |
2.4.2. |
2.5.2 |
|
3 |
2.1.3. |
2.2.3. |
2.3.3. |
2.4.3. |
2.5.3. |
|
4 |
2.1.4. |
2.2.4. |
2.3.4. |
2.4.4. |
2.5.4. |
|
5 |
2.1.5. |
2.2.5. |
2.3.5. |
2.4.5. |
2.5.5. |
|
6 |
2.1.6. |
2.2.6. |
2.3.6. |
2.4.6. |
2.5.6. |
|
7 |
2.1.7. |
2.2.7. |
2.3.7. |
2.4.7. |
2.5.7. |
|
8 |
2.1.8. |
2.2.8. |
2.3.8. |
2.4.8. |
2.5.8. |
|
9 |
2.1.9. |
2.2.9. |
2.3.9. |
2.4.9. |
2.5.9. |
|
10 |
2.1.10. |
2.2.10 |
2.3.10. |
2.4.10. |
2.5.10. |
|
11 |
2.1.11. |
2.2.11. |
2.3.11. |
2.4.11. |
2.5.11. |
|
12 |
2.1.12. |
2.2.12. |
2.3.12. |
2.4.12. |
2.5.12. |
|
13 |
2.1.13. |
2.2.13. |
2.3.13. |
2.4.13. |
2.5.13. |
|
14 |
2.1.14. |
2.2.14. |
2.3.14. |
2.4.14. |
2.5.14. |
|
15 |
2.1.15. |
2.2.15. |
2.3.15. |
2.4.15. |
2.5.15. |
Список рекомендуемой литературы
1. Ахметов Н.С. Общая и неорганическая химия. - М.: Высшая школа, 2002.-743 с.
Глинка Н.Л. Задачи и упражнения по общей химии. М. Интеграл-Пресс, 2004.- с. 240
Гольбрайх З.Е. Сборник задач и упражнений по химии.- М.: Высшая школа, 2004.- 224 с.
Задание 10 по теме «свойства элементов и их соединений»
ПримерЫ решения задач
Пример 1
Вычислите общую жесткость воды , если в 2 л её находится по 800 мг ионов Mg2+ и Ca2+.
Решение: Если известны массы ионов или соответствующих им солей, то жесткость считается по формуле

где m1, m2, m3 – массы ионов металлов (или их солей) в воде, мг;
![]() –эквивалентные
массы ионов металлов (или их солей),
мг/экв;
–эквивалентные
массы ионов металлов (или их солей),
мг/экв;
V – объём воды, л.
Подставим числовые значения в предлагаемую формулу
![]() 33,33
+ 20 = 53,33 мэкв/л.
33,33
+ 20 = 53,33 мэкв/л.
Ответ: общая жесткость равна 53,33 мэкв/л.
Пример 2
Чему равна жесткость воды, если на титрование 100 мл образца её израсходовано: 12 мл 0,04 н раствора HCl?
Решение: Временная жесткость воды определяется по объёму кислоты, пошедшей на её титрование:
НСО3- + НС1 = Н2О + СО2↑ + С1-.
В соответствии с законом эквивалентов количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаково. Следовательно:
![]() ,
,
где
![]() – объём кислоты, пошедшей на титрование,
мл;
– объём кислоты, пошедшей на титрование,
мл;
![]() –объём
пробы воды, взятой для титрования, мл;
–объём
пробы воды, взятой для титрования, мл;
![]() –нормальная
концентрация кислоты, экв./л;
–нормальная
концентрация кислоты, экв./л;
Отсюда:
![]() =
=
![]() =
4,8мэкв/л.
=
4,8мэкв/л.
Ответ: жесткость равна 4,8мэкв/л.
Пример 3
Почему растворы щелочей надо хранить в хорошо закрытой посуде? Составьте уравнения реакций между гидоксидом калия и…
а) хлором;
б) оксидом серы (VI);
в) сероводородом.
Решение:
Растворы щелочей поглощают из воздуха углекислый газ, при этом образуются карбонаты щелочных металлов.
а) реакция гидроксида калия с хлором:
1) при комнатной температуре
2KOH + Cl2 → KCl + KClO + H2O;
хлорид гипохлорит
калия калия
2) при нагревании
6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O;
хлорид хлорат
калия калия
б) уравнения реакций между гидроксидом калия и оксидом серы (VI):
1) KOH + SO3 → KHSO4;
гидросульфат
калия
2) 2КОН + SO3 → K2SO4+ H2O;
сульфат
калия
в) уравнения реакций между гидроксидом калия и сероводородом:
1) KOH + H2S → KHS+ H2O;
гидросульфид
калия
2) 2КОН + Н2S → K2S+ 2H2O.
сульфид
калия
Пример 4
Определите объем газа (л, н.у.) полученный при взаимодействии 0,2 моль эквивалентов KMnO4 c избытком концентрированной соляной кислоты, если практический выход составляет 80%.
Решение: Между перманганатом калия и концентрированной соляной кислотой происходит реакция
1) 2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5 Cl2↑ +8H2O;
2 MnO4-
+ 8H++
5ē
→
Mn2+
+4H2O
MnO4-
+ 8H++
5ē
→
Mn2+
+4H2O
5 2Cl- - 2 ē → Cl2.
При взаимодействии 0,2 моль эквивалентов KMnO4 получается также 0,2 моль эквивалентов Cl2 (по закону эквивалентов).
Объем Cl равен 0,2экв · 11,2 л/экв = 2,24 л (теоретический выход). Практический выход 2,24 л · 0,8 = 1,792 л.
Ответ: 1,792 л.
Пример 5
Составьте уравнения реакций по следующей схеме:
![]()
Решение:
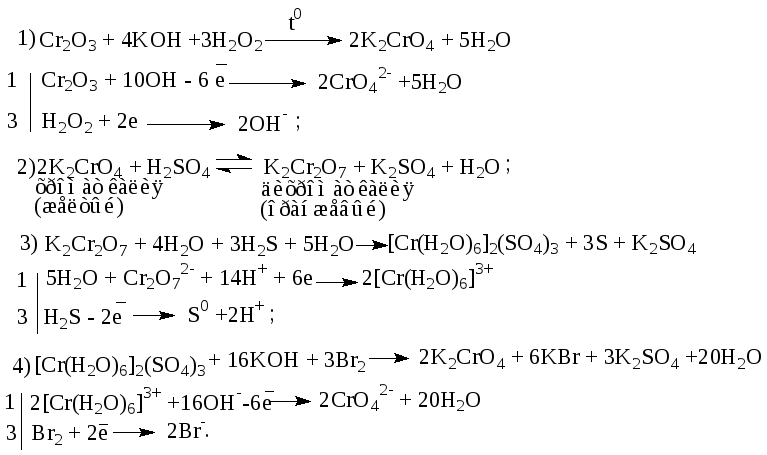
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
Как можно получить гидрид и нитрид кальция?
Напишите уравнения реакций этих соединений с водой. К окислительно-восстановительным реакциям составьте электронные уравнения.
Напишите уравнения реакций с водой следующих соединений натрия: Na2О2, Na2S, NaH, NaOH.
Какие соединения называют гашеной и негашеной известью? Составьте уравнения реакций их получения. Какое соединение образуется при прокаливании негашеной извести с углем? Что является окислителем и восстановителем в последней реакции? Составьте электронные и молекулярные уравнения.
Гидроксид какого из S-элементов проявляет амфотерные свойства? Составьте молекулярные и ионно-молекулярные уравнения реакций этого соединения:
а) с кислотой;
б) со щелочью.
Составьте уравнение реакций, которые нужно провести для осуществления следующих превращений:
Са -> СаН2 -> Са(ОН)2 -» СаС03 -> Са(НСОъ)2
Какие свойства может проявлять пероксид водорода в окислительно-восстановительных реакциях? Почему? На основании электронных уравнений напишите уравнения реакций перекиси водорода:
а) с Ag20;
б) с К1.
Почему пероксид водорода способен диспропорционировать (самоокисляться-самовосстанавливаться)? Составьте электронные уравнения процесса разложения перексида водорода.
Имеются СаСО3: и NaCl. Предложите все возможные способы получения белильной извести (выбор процессов и реактивов неограничен).
Назовите три изотопа водорода. Укажите состав их ядер. Что такое тяжелая вода? Как она получается и каковы ее свойства?
При сплавлении оксид бериллия взаимодействует с диоксидом кремния и с оксидом натрия. Напишите уравнения соответствующих реакций. О каких свойствах ВеО говорят эти реакции?
Определите молярную конц. (моль/л) и массовую долю (%) нитрита калия в растворе (ρ= 1002 г/л), если 75 мл этого раствора израсходовано на восстановление всего дихромата калия, содержащегося в 90 мл 0,1 М раствора (реакция протекает в кислой среде). Подтвердите принципиальную возможность протекания этой реакции в стандартных условиях при 250С.
Ответ: C(KN02) = 0,36 моль/л, ω% = 3%.
Почему пероксид водорода способен диспропорционировать (самоокисляться-самовосстанавливаться)? Составьте электронные уравнения процесса разложения перексида водорода.
При пропускании диоксида углерода через известковую воду (раствор Са(ОН)2) образуется осадок, который при дальнейшем пропускании СО2 растворяется. Дайте объяснения этому явлению. Составьте уравнения реакций.
Чем можно объяснить большую восстановительную способность щелочных металлов? При сплавлении гидроксида натрия с металлическим натрием последний восстанавливает водород щелочи в гидрид-ион. Составьте электронное и молекулярные уравнения этой реакции.
Составьте электронные и молекулярные уравнения реакций:
а) бериллия с раствором щелочи;
б) магния с конц. серной кислотой, учитывая, что окислитель приобретает низшую степень окисления.
Рассчитайте массовую долю пероксида водорода, если 25,12 мл его раствора (ρ = 1015 г/л) израсходовано на реакцию в нейтральной среде с перманганат-ионами, содержащимися в 100 мл 0,675 н. раствора.
Ответ: 4,5%.
Как можно получить гидроксиды щелочных металлов? Почему жидкие щелочи необходимо хранить в хорошо закрытой посуде? Составьте уравнения реакций, происходящих при насыщении гидроксида натрия:
а)хлором;
б) оксидом серы SO3;
в)сероводородом.
Составьте электронные и молекулярные уравнения реакций:
а) кальция с водой;
б) магния с азотной кислотой, учитывая что окислитель приобретает низшую степень окисления.
Как получают металлический натрий? Составьте электронные уравнения процессов, проходящих на электродах при электролизе расплава NaOH.
Какую степень окисления может проявлять водород в своих соединениях? Приведите примеры реакций, в которых газообразный водород играет роль окислителя и в которых -восстановителя.
При пропускании диоксида углерода через известковую воду (раствор Са(ОН)2) образуется осадок, который при дальнейшем пропускании СО2 растворяется. Дайте объяснение этому явлению. Составьте уравнение реакций.
Какие соединения магния и кальция применяются в качестве вяжущих строительных материалов? Чем обусловлены их вяжущие свойства?
Напишите уравнения реакций натрия с водородом, кислородом, азотом и серой. Какую степень окисления приобретают атомы окислителя в каждом из этих реакций?
Подтвердите расчетом, что образование пероксида натрия из простых веществ при 298 К в закрытой системе более вероятно, чем образование оксида и надпероксида натрия.
Какое свойство кальция позволяет применить его в металлотермии для получения некоторых металлов из них соединений. Составьте электронные и молекулярные уравнения реакций кальция:
а) с V2О5;
б) с CaSО4.
В каждом из этих реакций окислитель восстанавливается максимально, приобретая низшую степень окисления.
Предложите все возможные способы переходов по следующей схеме:
Na → NaО2 → Na2О → NaOH → NaHSOA → Na2SО4 → Na.
Как можно получить карбид кальция? Что образуется при взаимодействии его с водой? Напишите уравнения соответствующих реакций.
Предложите все возможные способы переходов по следующей схеме:
NaCl → Na → NaOH → Na2CО3 → NaHCО3 → NaCl
Напишите уравнения реакций калия с водородом, кислородом, азотом и серой. Какую степень окисления приобретают атомы окислителей в каждой из этих реакций?
2.30 Какое свойство стронция позволяет применить его в металлотермии для получения некоторых металлов из их соединений? Составьте электронные и молекулярные уравнения реакций кальция:
а) с V2О5;
б) с CaSO4
В каждой из этих реакций окислитель восстанавливается максимально, приобретая низшую степень окисления.
Определите массовую долю иода, если для перевода этого вещества, содержащегося в 15,43 мл раствора с плотностью 1076 г/л в йодноватую кислоту потребовалось 0,672 л (н. у.) хлора.
Ответ: 9,2%.
Какую массу гидроксида кальция надо прибавить к 275 л воды, чтобы устранить ее карбонатную жесткость, равную 5,5 мэкв/л?
Ответ: 56,06 г.
Какие оксиды и гидроксиды образуют олово и свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления элементов? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия раствора гидроксида натрия:
а) с оловом;
б) гидроксидом свинца (II).
При взаимодействии концентрированной азотной кислоты с медью выделяется газ. Определите, какой выделяется газ и в каком объеме, если израсходовано 6,4 г меди.
Ответ: 4,48 л.
Молекула фтора при взаимодействии с водой образует фтороводород и атомарный кислород, последний реагирует с фтором (продукт - фторид кислорода (II)) и с водой (продукт -пероксид водорода). Кроме того, в продуктах обнаружены озон и молекула кислорода. Составьте уравнения всех стадий процесса и его общее уравнение.
Чем существенно отличается действие разбавленной азотной кислоты на металлы от действия хлороводородной (соляной) и разбавленной серной кислот? Что является окислителем в первом случае, что в двух других? Приведите примеры.
Определите, какой объем (л, н. у.) газа выделится при взаимодействии 0,18 моль эквивалентов КМnО4 с избытком концентрированной соляной кислоты, если практический выход составляет 78%.
Ответ: 1,56 л.
Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций HNO2:
а) с бромной водой;
б) с HJ.
Возможно ли в закрытой системе при 298К получение газообразных Cl2O, ClO и Сl2О7 из простых веществ?
Ответ подтвердите расчетами ∆G0298.
2.40 В каком газообразном соединении азот проявляет свою низшую степень окисления? Напишите уравнения реакций получения этого соединения:
а) при взаимодействии хлорида с гидроксидом кальция;
б) разложением нитрида магния водой.
Жидкий трибромид фосфора объемом 9,475 мл обработали водой и добавили объем раствора «А» до 500 мл. К нему добавили 50 мл 0,1 М раствора нитрата серебра (I). Осадок отфильтровали и высушили.
Определите массу (г) осадка и молярные концентрации (моль/л) веществ в растворе «А».
Ответы: m(AgBr) = 0,0939 г; С(Н3РО3) = 0,0091, C(HNО3) = 0,0091; С(НВг) = 0,0182 моль/л.
Как проявляет себя сероводород в окислительно-восстановительных реакциях? Почему? Составьте электронные и молекулярные уравнения реакций взаимодействия раствора сероводорода:
а) с хлором;
б) кислородом.
Проводят термическое разложение 0,46 моль нитрата калия. После охлаждения сосуда получают твердое вещество «А». Его растворяют в воде, добавляют избыток хлорида аммония и смесь нагревают. Определите объем (л, н. у.) образующегося при этом газа. Предложите также способ получения вещества «А» из подкисленного серной кислотой раствора нитрата калия. Составьте уравнения всех реакций.
Ответ: 10,3 л.
Какую массу бесцветного кристаллического SeО2 можно получить при взаимодействии 1 г золота с безводной селеновой кислотой H2SeO4? Каким окислительно-восстановительным свойством обладает золото?
Ответ: 0,845 г.
Почему диоксид азота способен к реакциям самоокисления-самовосстановления (диспропорционирования)? На основании электронных уравнений напишите уравнение реакции растворения NO2 в гидроксиде натрия.
Смешано 61,25 г хлората калия с избытком канц. НС1. Определите объем (л, н. у.) выделившегося газа, если практический выход равен 65%.
Ответ: 21,84 л.
Почему сернистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций H2SO3:
а) с сероводородом;
б) хлором.
Какие из солей угольной кислоты имеют наибольшее промышленное применение? Как получить соду, исходя из металлического натрия, хлороводородной (соляной) кислоты, мрамора и воды? Почему в растворе соды лакмус приобретает синий цвет?
Ответ подтвердите составлением уравнений соответствующих реакций.
Определите массовую долю йодида калия, если для перевода этого вещества, содержащегося в 15,43 мл раствора с плотностью 1076 г/л, в йодноватую кислоту потребовалось 0,672 л (н. у.) хлора.
Ответ: 10%.
Как получают диоксид углерода в промышленности и в лаборатории? Напишите уравнения соответствующих реакций и реакций, с помощью которых можно осуществить следующие превращения:
NaHCО3 → СО2 → СаСО3 → Са(НСО3)2.
К 0,21 л 0,475 моль/л раствора бромида натрия, подкисленного серной кислотой, добавлен избыток бромата натрия. Определите количество образовавшегося простого вещества.
Ответ: 0,06 моль.
Какие реакции нужно провести, имея азот и воду, чтобы получить нитрат аммония? Составьте уравнения соответствующих реакций.
Смешивают 750 мл 0,1 моль/л йодноводородной кислоты и 750 мл 0,1 моль/л раствора йодноватой кислоты. Определите массу (г) осадка.
Ответ: 11,43 г, J2.
Какое применение находит кремний? Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Si02 → Si -→ K2SiО3 → H2SiО3.
Окислительно-восстановительные реакции напишите на основании электронных уравнений.
Составьте электронные и молекулярные уравнения реакций:
а) бериллия с раствором щелочи;
б) магния с конц. серной кислотой, учитывая, что окислитель восстанавливается до SO2.
Для получения бертолетовой соли пропускают хлор в горячий (800С) насыщенный раствор гидроксида кальция, а затем добавляют хлорид калия. При охлаждении до 200С образуется осадок продукта. Определите объем (л, н. у.) хлора, который истрачен для получения 100 г осадка.
Ответ: 54,85 л.
Напишите формулы и назовите кислородные кислоты хлора, укажите степень окисления хлора в каждом из них. Какая из кислот более сильный окислитель? На основании электронных уравнений закончите уравнение реакции:
Kl + NaOCl + H2SО4 →J2 +
Хлор приобретает низшую степень окисления.
Какие соединения называются гашеной и негашеной известью? Составьте уравнения реакций их получения. Какое соединение образуется при прокаливании негашеной извести с углем? Что является окислителем и восстановителем?
Какие степени окисления проявляют мышьяк, сурьма и висмут? Какая степень окисления является более характерной для каждого из них? Составьте электронные и молекулярные уравнения реакций:
а) мышьяка с концентрированной серной кислотой;
б) висмута с концентрированной серной кислотой.
При получении перхлората калия используют следующую схему:
КСl→ Сl2 →КСlO → КСlO3 → КСlO4.
Приведите возможные уравнения реакций.
В каком газообразном соединении азот проявляет свою низшую степень окисления? Напишите уравнения реакций получения этого соединения:
а) при взаимодействии хлорида аммония с гидроксидом кальция;
б) разложением нитрида магния с водой.
Составьте уравнения реакций, протекающих при нагревании твердых реагентов:
a)KClO3+S8→
б)КСlO3+ Р4→
в) КСlO3+ КОН + МnO2→
г)KClO3+ K2S208→
В каком газообразном соединении фосфор проявляет свою низшую степень окисления? Напишите уравнения реакций:
а) получения этого соединения при взаимодействии фосфида кальция с хлороводородной (соляной) кислотой;
б) горения его в кислороде.
Составьте уравнения возможных реакций в соответствии со схемой:
Sn →Sn(NО3)2 → SnS → [SnCl3]- → [Sn(OH)3] - → Sn(OH)2.
Почему фосфористая кислота способна к реакциям самоокисления-самовосстановления (диспропорционирования)? На основании электронных уравнений составьте уравнения процесса разложения Н3РО3, учитывая, что при этом фосфор приобретает низшую и высшую степень окисления.
Оптимальная для здоровья человека массовая концентрация ионов F- в питьевой воде составляет 1,25 мг/л. Установите, будет ли при 250С годной для питья вода, прошедшая очистку от фторид-ионов осаждением фторида кальция (без применения избытка катионов кальция) (ПРCaF2=4·10-11).
Ответ: m(F) = 8,2 мг/л.
Сопоставьте окислительные свойства О2, О3 и Н2О2 в щелочной среде. Докажите, что йодид калия в щелочном растворе реагирует с О3 и Н2О2, но не взаимодействует с О2.
Чем можно объяснить восстановительные свойства соединений олова (II) и окислительные свинца (IV)? На основании электронных уравнений составьте уравнения реакций:
а) SnCl2 с HgCl2;
б) РbO2 с HC1 конц.
Какая степень окисления наиболее характерна для олова и какая для свинца? Составьте электронные и молекулярные уравнения реакций олова и свинца с конц. азотной кислотой.
2.70 На образец стали массой 4,00 г, содержащий сульфидную серу, действуют избытком разбавленной серной кислоты. Образующийся сероводород полностью реагирует с 1,6 мл 0,05 н. раствор К[J3]. Определите массовую долю (%) серы в стали.
Ответ: 0,032%.
Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? На основании электронных уравнений составьте уравнения реакций HN02:
а) с бромной водой;
б) с HJ.
Образец пиролюзита массой 1,00 г, состоящий из МпO2 и инертных примесей, вносят в конц. НС1. Выделяющийся газ полностью поглощается раствором избытка йодида калия, который окрашивается в коричневый цвет. Для полного обесцвечивания раствора расходуют 200 мл 0,1 н. раствора тиосульфата натрия. По этим данным рассчитайте массовую долю (%) Мп02 в исходном минерале.
Ответ: 86,94%.
Определите значение объемной доли (%) сероводорода в техническом газе, если 5 л (н. у.) этого газа затрачено на реакцию с 0,048 моль дихромата калия в кислой среде (остальные компоненты газа в реакцию не вступают).
Ответ: 64,5%.
Гидроксиламин в конц. щелочном растворе под действием катализатора (Pt) разлагается на три газа. Один из них химики-практики называют инертным, другой содержит азот в низшей степени окисления, а третий - азот с условной степенью окисления (+1). Составьте уравнения реакций, укажите их тип, определите общий объем (л, н. у.) образующихся газов при разложении 8,26 г исходного вещества. Ответ: 4л.
На основании электронных уравнений составьте уравнение реакции фосфора с азотной кислотой, учитывая, что фосфор приобретает высшую, а азот степень окисления +4.
Определите массу (г) твердого продукта реакции между 9,8 л сероводорода и 17,5 л диоксида серы (н. у.). Ответ: 21 г.
Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
Al → Al2(SO4)3→ Na[Al(OH)4] → А1(NО3)3.
Составьте уравнения термического разложения следующих солей аммония: карбоната, хлорида, сульфата, дихромата.
Составьте электронные и молекулярные уравнения реакций:
а) алюминия с раствором щелочи;
б) бора с конц. азотной кислотой.
2.80 Для получения белого фосфора прокаливают в электропечи 1т фосфоритной руды, содержащей 64,5% (по массе) ортофосфата кальция, в смеси с избытком кварцевого песка и угля. Рассчитайте массу (кг) продукта, если практический выход равен 85%.
Ответ 109,65 кг.
Как можно получить карбид кальция? Что образуется при его взаимодействии с водой? Напишите уравнения соответствующих реакций.
Жидкий трихлорид фосфора объемом 2 мл смешивают с избытком воды и добавляют избыток гидроксида бария. Выпадает осадок средней соли, его отделяют и обезвоживают в сушильном шкафу. Определите массу (г) полученной соли. При прокаливании соли получаются фосфин, водяной пар, а также дифосфат и ортафосфат бария. Составьте уравнения реакций.
Составьте уравнения реакций, которые нужно провести для осуществления следующих реакций:
В → H3BO3 →Na2B4O7→ Н3ВO3
Уравнение окислительно-восстановительной реакции составьте на основании электронных уравнений.
:К 250 мл 0,012 н раствора сульфата меди (II) добавляют раствор йодида калия до прекращения образования осадка, состоящего из двух веществ - «А» и «В», а затем раствор тиосульфата натрия до полного перехода осадка в раствор. При этом первым химически растворяется вещество «В» (его можно было бы также растворить в избытке раствора KJ), а затем вещество «А». Рассчитайте массу (г) вещества «А» и «В» в осадке.
Ответ: m(I2) = 0,381 г; m(CuI) = 0,571 г.
Обработка As2О3 цинком в кислой среде приводит к образованию арсина. Этот газ можно поджечь в воздухе, но можно пропустить через раскаленную кварцевую трубку, где в холодной зоне образуется «черное зеркало» (что это такое?), которое исчезает при смачивании его раствором NaClO. Если же арсин пропустить через раствор нитрата серебра (I), то осаждается благородный металл. Составьте уравнения всех реакций.
Для получения хлора в лаборатории смешивают оксид марганца (IV) с хлоридом натрия в присутствии конц. серной кислоты. Составьте электронные полууравнения и молекулярное уравнения этой реакции.
Какой процесс называют алюминотермией? Составьте электронные полууранения и молекулярные уравнения реакции, на которых основано применение термита (смесь А1 и Fe3O4).
Составьте уравнения следующих реакций:
a) NaBiO3(т) + HNO3 + Mn(NO3)2 →
б) NaBiO3(т) + HNO3 +Cr2(SO4)3→
в) Bi(OH)3 + OH-+ [Sn(OH)3] - →
Какие соединения называют карбидами и силицидами? Напишите уравнения реакций:
а) карбида алюминия с водой;
б) силицида магния с хлороводородной (соляной) кислотой.Являются ли эти реакции окислительно-восстановительными? Почему?
2.90 Химически растворяют 2,84 г Р4О10 в воде и добавляют 25,24 г Ba(OH)2·8H2O. Выпадает осадок - рассчитать его массу (г).
Ответ: 12 г.
На примере соединений PCl3 и BiCl3 сравните следующие свойства Э (Ш): а) взаимодействие с водой (назовите продукты, укажите среду конечного раствора); б) переход Э (III) → Э (V) (укажите условия проведения реакций и их уравнения, назовите продукты. охарактеризуйте окислительно-восстановительную устойчивость.
Почему атомы большинства р-элементов способны к реакциям диспропорционирования (самоокисления-самовосстановления)? На основании электронных уравнений напишите уравнение реакции растворения серы в концентрир. растворе щелочи. Один из продуктов содержит серу в степени окисления +4.
При растворении нитрата висмута (III) в воде раствор становится мутным. Почему? Приведите уравнение реакции, назовите твердый продукт и укажите условия приготовления прозрачного раствора, содержащего Bi (III), Bi (V).
Какие реакции нужно провести для осуществления следующих превращений:
NaCl → НCl → С12→ КСlO3?
Уравнения окислительно-восстановительных реакций составьте на основании электронных уравнений.
Определите, какой объем (л, н. у.) диоксида углерода собран после окончания реакции между 2,14 моль перманганата калия в сернокислой среде и избытком щавелевой кислоты, если практический выход составляет 88%. Ответы: 9,42 моль; 210,9 л.
Составьте электронные и молекулярные уравнения реакции, происходящей при пропускании хлора через горячий раствор гидроксида калия. К какому типу окислительно-восстановительных процессов относится данная реакция?
Через насыщенный раствор хлорида натрия пропускают газообразный аммиак, а затем - углекислый газ. Выпавший осадок гидрокарбоната натрия отфильтровывают и прокаливают при 5000С. Получают твердое вещество «А». Перешел ли гидрокарбонат натрия полностью в вещество «А», если масса осадка до прокаливания была 43,69 г, а после прокаливания 27,97 г? Как практически наиболее просто убедиться, что последняя реакция закончилась?
Какую степень окисления может проявить кремний в своих соединениях? Составьте уравнения, которые надо провести для осуществления следующих превращений:
Mg2Si → SiH4→ SiO2 → K2SiO3 → H2SiO3.
При каком превращении происходит окислительно-восстановительная реакция?
Взаимодействие 24,74 г алюминия с избытком графита при 1500 °С приводит к образованию трикарбида тетраалюминия. Покажите расчетом, что эта реакция термодинамически выгодна в закрытой системе. Определите объем газа, выделяющегося при гидролизе указанного продукта, если практический выход газа составляет 80%. Ответ: 12,3 л;
2.100 При сжигании 8,71 г некоторого газообразного вещества SixНy на воздухе образовалось 16,82 г SiO2. Найдите химическую формулу этого вещества, если плотность его по аргону равна 1,558.
К раствору, содержащему SbCl3 и BiCl3, добавили избыток раствора гидроксида калия. Напишите молекулярные и ионнo-молекулярные уравнения происходящих реакций. Какое вещество находится в осадке?
Для получения аморфного кремния нагревают смесь диоксида кремния и магния. После окончания реакции и охлаждения стекла к нему добавляют соляную кислоту. Наблюдают самовоспламенение выделяющейся газовой смеси. Составьте уравнение реакции. Аморфный кремний, полученный в этом опыте, химически растворяют в конц. растворе NaOH и собирают 8,20 л (н. у.) газа. Какова была масса (г) кремния? Ответ: 5,18 г.
Необходимо сравнить чувствительность следующих реактивов на катион свинца (II):
а) хромат калия;
б) сульфид натрия;
в) сульфат натрия.
Предложите схему перевода катионов свинца (II) из раствора нитрата свинца (II) последовательно в указанные соли, используя Пр продуктов реакций.
Кусок латуни обработали азотной кислотой. Раствор разделили на две части. К одной из них прибавили избыток раствора аммиака, к другой - избыток раствора щелочи. Какие соединения цинка и меди образуется при этом? Составьте уравнения соответствующих реакций.
Составьте уравнения следующих реакций:
a)Sn + О2→
б) Sn + ОН- + Н2О→
в) Sn + HNО3 (конц.) →
г) Sn + HNO3 (разб.) →
Составьте уравнения следующих реакций:
а) РЬ + О2 →
б) РЬ + ОН + Н2О →
в) Pb + HNOa (конц.) →
г) Pb + НNО3 (разб.) →
Составьте уравнения возможных реакций в соответствии со следующей схемой:
Рb→ [Pb(H2O)4]2→ Pb(OH)2→ [Pb(OH)4]+2→ Pb(NO3)2 → Pb.
Как изменяются окислительные свойства галогенов при переходе от фтора - к йоду и восстановительные свойства их отрицательно заряженных ионов? Почему? Составьте электронные и молекулярные уравнения реакций:
a)Cl2 + J2+H2O;
б)KJ + Вг2.
Укажите окислитель и восстановитель.
Рассчитайте энергию Гиббса реакций (кДж) в водном растворе:
а) 2KNO2 + 2Н2O + 2KJ ->2NO (г) + J2 (г) + 4КОН;
б) 2HNO2 + H2SO4 + 2KJ→2NO (г) +J2 + K2SO4 + 2H2O.
2.110 Предельно допустимая концентрация ионов свинца (II) в промышленных сточных водах равна 0,1 мг/л. Установите, обеспечивается ли очистка сточных вод от свинца осаждением при 250С в виде:
а) хлорида свинца (II);
б) сульфата свинца (II);
в) ортофосфата свинца (II).
Составьте уравнение реакций между Pb2PbO4 в азотнокислой среде и:
а) нитритом калия;
б) конц. НС1;
в) йодидом калия;
г) нитратом марганца (II);
д) перхлоратом железа (II).
К раствору, содержащему SbCl3 и BiCl3, добавили избыток раствора гидроксида калия. Напишите молекулярные и ионно-молекулярные уравнения происходящих реакций. Какое вещество находится в осадке?
Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Напишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной с медью. Укажите окислитель и восстановитель.
Определите объем (л, н. у.) газа, который образуется при взаимодействии избытка пероксида водорода в кислой среде с пермангана-ионами, содержащимися в 100 мл 0,45 моль/л раствора?
Ответ: 2,52 л.
Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Напишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной - с медью. Укажите окислитель и восстановитель.
Определите, какой объем (л, н. у.) молекулярного хлора вступает в реакцию с гидроксидом калия в горячем водном растворе, если среди продуктов обнаружено 0,46 моль КС1.
Ответ: 6,18 л.
Составьте молекулярные и ионно-молскулярные уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeCl2 → Fe(CN)2 → K4[Fe(CN)6] → K3[Fe(CN)6]
К окислительно-восстановительным реакциям составьте электронные уравнения.
Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeSO4 →Fe(OH)2 → Fe(OH)3→ FeCl3.
Цинковая руда содержит 20% сульфида цинка. Какой газ и в каком объеме можно получить из 1,5 т такой руды при ее обжиге?
2.120 Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Ag → AgNO3 → AgCl → [Ag(NH3)2]Cl→ AgCl.
Рассчитайте, сколько золота можно получить цианидным способом, если израсходовано 20 г цинка? Ответ: 121 г.
При постепенном прибавлении раствора KI к раствору Hg(NO3)2 образующийся вначале осадок растворяется. Какое комплексное соединение при этом получается? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
Какой объем кислорода можно получить при взаимодействии 20 г хлорида Аu (III) с перекисью водорода в щелочной среде? Каким окислительно-восстановительным свойством обладает Au(III), переходящий в свободный атом золота?
Ответ: 2,2 л.
Феррат калия K2FeO4 образуется при сплавлении Fe2O3 с калийной селитрой KNO-5 в присутствии КОН. Составьте электронное и молекулярное уравнения реакций.
Соединения Ir(VI) неустойчивы. IrF6 энергично разлагается водой с образованием гидроксида Iг (IV) и свободного кислорода. Определите объём в (мл) н.у. выделившегося кислорода, если гидролизуется 0,612 г IrF6?
Ответ: 22,4 мл.
При сплавлении хромита железа Fe(CrО2)2 с карбонатом натрия в присутствии кислорода хром (III) и железо (II) окисляются и приобретают соответственно степени окисления +6 и +3. Составьте электронные и молекулярные уравнения реакции.
Составьте электронные и молекулярные уравнения реакций:
а) растворения молибдена в азотной кислоте;
б) растворения вольфрама в щелочи в присутствии кислорода.
Учтите, что молибден и вольфрам приобретают высшую степень окисления.
Иодид меди (II) при высокой восстановительной активности иона I- разлагается при обычной температуре с образованием йодида меди (I) и свободного йода. Определите, какое количество (г) йода и йодида Сu (I) можно получить при действии избытка KI на 5 г CuSO4. Каким окислительно-восстановительным свойством обладает Cu(II)?
Ответы: m(CuI) = 6 г; m(I2) ~ 4 г.
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Ni → Ni(NО3)2 → Ni(ОН)2 → Ni(ОН)3 → NiС12.
Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
Составьте уравнения реакций в водном растворе:
1) KMnO4 + K2SO3 + Н2O→
2) КМпO4 + H2C2O4 + Н2O→
Используя табличные значения φ0(250С), докажите, что данные реакции самопроизвольно протекают в стандартных условиях. Для реакции 2) рассчитайте объем (л, н. у.) выделившегося газа, если прореагировало 0,036 моль окислителя.
Ответ: 2,42 л.
Составьте электронные и молекулярные уравнения реакций: а) растворения платины в царской водке; б) взаимодействия осмия со фтором. Платина окисляется до степени окисления +4, а осмий - до +8.
При сплавлении М2О5, где М-Nb или Та, с K2CO3 образуется K2MO4 (приведите их названия). После растворения сплава в воде и подкисления раствора выпадает осадок полигидрата соответствующего М2О5. Составьте уравнения реакций.
Ванадий в свободном виде может быть получен термическим разложением хлорида или йодида ванадия (II) на соответствующие простые вещества. На основе термодинамического расчета для закрытой системы при стандартных условиях (Т = 298К) определите, какой из указанных галогенидов выгоднее использовать для получения ванадия.
Растворяют дихромат калия в воде, добавляют серную кислоту, смесь охлаждают и насыщают диоксидом серы. При комнатной температуре кристаллизуется продукт. Составьте уравнения реакций. Определите массу (г) продукта, если в реакцию вступило 108,85 г дихромата калия (образуются хромокалиевые квасцы).
Ответ: 371,3 г.
Могут ли в растворе существовать совместно следующие вещества:
а) FeCl3 и SnCl2;
б) FeSO4 и NaOН;
в) FeCl3 и K3[Fe(CN)6].
Для взаимодействующих веществ составьте уравнение реакций.
В фиолетовый раствор, содержащий катионы гексаакватитана (III), вносят хлорид меди (II). Образуется бесцветный раствор и выпадает белый осадок, который можно перевести в раствор с добавлением НС1 (конц.). Составьте уравнения реакций.
На гидроксиды цинка и кадмия подействовали избытком растворов серной кислоты, гидроксида натрия и аммиака. Какие соединения цинка и кадмия образуются в каждой из этих реакций? Составьте молекулярные и ионно-молекулярные уравнения реакций.
При кипячении лантана в воде собрано 14,83 л (н. у.) газа. Определить массу (г) лантана, вступившего в реакцию.
Ответ: 61,26 г.
Диоксиды титана и циркония при сплавлении взаимодействуют со щелочами. О каких свойствах оксидов говорят эти реакции? Напишите уравнения реакций между:
а)ТiO2 и ВаO;
б)ZrO2 и NaOH.
В первой реакции образуется метатитанат, а во второй –ортоцирконат.
2.140 Какой объем газа (л. н. у.) можно собрать при обработке 44,58 г гидрида лантана (III) избытком воды? Ответ: 21,1 л.
При растворении титана в конц. серной кислоте последняя восстанавливается минимально, а титан переходит в катион с высшей степенью окисления. Составьте электронные молекулярные уравнения реакций.
К 5,88 г дихромата калия добавляют избыток конц. HCI. Рассчитайте, какой объем (л, н. у.) газа при этом выделится.
Ответ: 1,35 л.
К какому классу соединений относятся вещества, полученные при действии избытка гидроксида натрия на растворы ZnCl2, CdCl2, HgCl2? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций.
Составьте уравнения реакций по следующей схеме.
Сr2O3 → К2СrОА →К2Сr2O7 → [Cr(H2O)6]3+ → [Cr(OH) 6]3-→CrO42-
Какую степень окисления проявляет железо в соединениях? Как можно обнаружить ионы Fe2+ и Fe3+ в растворе? Составьте молекулярные и ионно-молекулярные уравнения реакций.
Проведено термическое разложение 54,29 г дихромата аммония, содержащего инертные примеси. После окончания реакции собрано 4,45 л газа при н. у. Определите массовую долю (%) дихромата аммония в техническом продукте.
Ответ: 92,3%.
Какую степень окисления проявляют медь, серебро и золото в соединениях? Какая степень окисления наиболее характерна для каждого из них? Йодид калия восстанавливает ионы меди (II) в соединениях меди со степенью окисления +1. Составьте электронные и молекулярные уравнения взаимодействия KJ с сульфатом меди.
При восстановлении 1 г минерала хромата (CrFe+2)O4 коксом образуется сплав железа с хромом (феррохром) и СО. Составьте уравнения реакции и рассчитайте массовый состав (%) и массу (кг) полученного феррохрома, если практический выход его составляет 55%.
Ответ: 392,7 кг феррохрома.
Составьте уравнения реакций по следующей схеме:
![]() .
.
2.150 Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Cd → Cd(NO3)2 → Cd(OH)2 → [Cd(NH3)6](OH)2 → CdSO4
Получение марганца из Мп02 восстановлением графитом возможно только при прокаливании указанной смеси (образуется также СО). Подтвердите это термодинамическими расчетами для закрытой системы при стандартных условиях и при Т = 1200К.
Почему оксид марганца (IV) может проявлять и окислительные и восстановительные свойства? Исходя из электронных уравнений, составьте уравнения реакции:
a)MnO2+ KJ + H2SO4 =
б)MnO2+ KN()3+ KOH=
Составьте уравнения реакций по следующей схеме:
![]() .
.
Нa основании электронных уравнений составьте уравнение реакции получения манганата калия К2МnO4 сплавлением оксида марганца (IV) с хлоратом калия КСlO3 в присутствии гидроксида калия. Окислитель восстанавливается максимально, приобретая низшую степень окисления.
Пропускание газообразного хлора через 125 мл 0,2 н раствора гексацианоферрата (II) калия приводит к окислению комплекса. Определите объем (л, н. у.) исходного газа, необходимого для полного реакции.
Ответ: 0,28 л.
Составьте уравнение реакций, которые надо провести для осуществления превращений:
Na2Cr2O7 → Na2CrOA→ Na2Cr2O7 → СrС13 → Cr(OH)3.
Уравнение окислительно-восстановительной реакции напишите на основании электронных уравнений.
Образец серебряного сплава (серебро + медь) массой 0,5081 г обработали избытком азотной кислоты (конц.) до его полного перехода в раствор, а затем избытком хлорида калия. Выпавший осадок промыли, высушили, взвесили. Его масса равна 0,5907 г. Определите массовую долю (%) меди в сплаве.
Ответ: 12,5%.
Марганец азотной кислотой окисляется до степени окисления (II), а рений приобретают высшую степень окисления. Какие соединения при этом получаются? Составьте электронные и молекулярные уравнения соответствующих реакций.
Составьте уравнения реакций по следующей схеме:
![]() .
.
2.160 Хром получают методом алюминотермии из его оксида (III), а вольфрам - восстановлением оксида вольфрама (IV) водородом. Составьте электронные и молекулярные уравнения соответствующих реакций.
2.161 Смешивают 800 мл 0,1 моль/л раствора гидроксида калия и 200 мл 0,1 моль/л раствора сульфата меди (II). Осадок отфильтровали и нагрели. Получили твердый продукт «А». Составьте уравнения реакций. Определите массу продукта «А».
Ответ: 1,6 г.
2.162 Хлор окисляет манганат калия К2Мп04. Какое соединение при этом получается? Как меняется окраска раствора в результате этой реакции? Составьте электронные и молекулярные уравнения реакции.
Предложите способы переводы в раствор образцов сплавов - латуни (массовая доля меди 69,5%, остальное - цинк) и бронзы (меди 89,5%, остальное - олово), а также способы разделения элементов.
Как меняется степень окисления марганца при восстановлении в кислой, нейтральной и щелочной средах? Составьте электронные и молекулярные уравнения реакции между K2MnO4 и KNО2 в нейтральной среде.
Медная пластинка массой 101,87 г опущена в раствор нитрата серебра (I). Через некоторое время масса пластинки стала равной 118,61 г. Определите массу меди в г., а также количество меди (моль), перешедший в раствор. Ответы: 6,98 г.; 0,11 моль.
Чем отличается взаимодействие гидроксидов кобальта (III) и никеля (III) с кислотами от взаимодействия гидроксида железа (III) с кислотами? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
Железная пластинка опущена в раствор сульфата меди (II). Через некоторое время масса пластинки изменилась на 2,14 г. Рассчитайте массу (г), а также эквивалентное количество вещества (моль), выделившегося на пластинке.
Ответы: 17,65 г; 0,556 моль экв-ов.
Образец ртути массой 24,08 г реагирует с азотной кислотой (разб.), в растворе образуется соединения ртути (I). Этот раствор делят пополам. К первой половине добавляют избыток соляной кислоты - выпадает осадок «А». Ко второй части вначале приливают избыток азотной кислоты (конц.), а затем избыток соляной кислоты - образуется ртуть содержащее вещество «В». Определите массу (г) осадка «A» и вещества «В», считая протекания всех реакций полными.
Ответы: m(А) = 14,17 г; m(В) = 16,30 г.
Смешивают 100 мл 0,1 моль/л раствора гидроксида нтрия и:
а) 100 мл 0,1 моль/л раствора нитрата ртути (I);
б) 100 мл 0,02 моль/л раствора нитрата ртути (II). Составьте уравнения реакций. Определите, в каком случае масса (г) осадка будет больше?
Ответ: m(Hg2О) = 0,4172 г; m(НgO) = 0,4332 г.
2.170 Определите эквивалентное количество (моль) цинка, вступившего в реакцию с избытком гидроксида натрия в водном растворе, если в результате образовался прозрачный раствор и выделилось 2,81 л (н. у.) газа. Ответ: 0,25 моль экв.
Составьте электронные полууравнения и молекулярные уравнения реакций:
а) растворение платины в царской водке;
б) взаимодействия осмия со фтором.
Платина окисляется до степени окисления +4, а осмий - до +8.
Определите, будут ли (да, нет) самостоятельно протекать при стандартных условиях в изолированной и закрытой системах реакции:
СuО (т) + Н2 (г) = Сu (т) + Н2O (ж) (Т = 298 К);
СuО (т) + Н2 (г) = Сu (т) + Н2O (г) (Т = 1000 К).
К 100 мл 0,02 моль/л раствора нитрата ртути (II) добавляют избыток НС1, а затем постепенно - трихлоростаннат (II) водорода до образования вначале белого, а в конце темного осадка. Составьте уравнение всех реакций. Определите массу (г) темного осадка, считая протекание реакции полным. Ответ:-0,401 г.
В присутствии влаги и диоксида углерода медь окисляется и покрывается зеленым налетом. Как называется и каков состав образующегося соединения? Что произойдет, если на него подействовать хлороводородной (соляной) кислотой? Напишите уравнения соответствующих реакций. Окислительно-восстановительную реакцию составьте на основании электронных уравнений.
Составьте уравнения реакций в водном растворе:
1)Мn2+ + Н+ + РbO2→
2) Мn2+ + МnО-4 →
Для реакции (1) рассчитайте массу соединения свинца, необходимую для полного протекания реакции с ионами Мn2+, содержащимися в 300 мл 0,05 моль/л раствора. Докажите, что реакция (2) протекает самопроизвольно в стандартных условиях при 250С.
Ответ: 8,97 г.
Расплавили смесь избытка калия с гидроксидом калия и внесли в нее 1,7388 оксида марганца (IV). После окончания реакции охлажденный сплав растворили в небольшом количестве воды. Определите молярную концентрацию (моль/л) соединения марганца в конечном растворе объемом 20 мл. Этот раствор разделили на две пробирки. В одну прилили избыток воды, а в другую - избыток хлорной воды. Происходящее явление опишите уравнениями реакций.
Ванадий получают алюминотермически или кальций термическим восстановлением оксида ванадия (V) V2O5. Последний легко растворяется в щелочах с образованием метаванадатов. Напишите уравнения соответствующих реакций. Уравнения окислительно-восстановительных реакций составьте на основании электронных уравнений.
Через 18,94 г суспензии гидрокарбоната марганца (II) пропускают воздух. При этом Мn+2 полностью переходит в Мn+. Рассчитайте объем (л, н. у.) воздуха, прошедшего через реактор, если объемная доля кислорода воздухе равна 20,95%, а степень его участия в реакции составляет 15%. Ответ: 73,3 л.
Азотистая кислота окисляет ванадий до метаванадиевой кислоты. Составьте электронные и молекулярные уравнения реакций.
2.180 К раствору, соединяющему сульфаты железа (II) и никеля (II), добавляют избыток гидроксида натрия, а затем избыток бромной воды. Образовавшийся осадок промывают водой и обрабатывают конц. НС1 до растворения осадка. Наблюдают выделения газа, его объем составляет 7,28 л (н. у.). Определите количество (в молях) сульфата никеля (II) в исходном растворе. Ответ: 0,65 моль.
Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Си → Cu(NO3)2 → Си(ОН)2 → СиС12 → [Cu(NH3)4]Cl2.
К 400 мл 0,05 моль/л раствора сульфата никеля (II) приливают раствор гидроксида калия до прекращения образования осадка вещества «А», который отфильтровывают и делят пополам. Первую половину осадка «А» обрабатывают избытком HCl. Что происходит? Вторую половину осадка «А» обрабатывают избытком бромной воды (осадок не исчезает, не меняет свой состав), а затем конц. HCl до полного растворения осадка. Одновременно наблюдают выделение газа. Каков его объем (л, н. у.)? Ответ: 0,112 л.
Какую степень окисления проявляет ванадий в соединениях? Составьте формулы оксидов ванадия, отвечающих этим степеням окисления. Как меняются кислотно-основные свойства оксидов ванадия при переходе от низшей к высшей степени окисления? Составьте уравнения реакций:
а) V203 с H2SO4;
б)V2O5 c NaOH.
Поведение Ru (VI) и Ru (VII) в водном растворе аналогично поведению Мn (VI) и Мn (VII). Составьте уравнения реакций:
a)K2RuO4 + Cl2 →
б)K2RuO4 + H+ →
в)K2RuO4 (т), t0С →
г)K2RuO4 (т) + OH-+ SO32- →
При внесении цинка в подкисленный серной кислотой раствор метаванадата аммония NH4VO3 желтая окраска постепенно переходит в фиолетовую за счет образования сульфата ванадия (II). Составьте электронные и молекулярные уравнения реакции.
Проводятся следующие реакции в водном растворе:
1) хлорид кобальта (II) + гидроксид калия + пероксид водорода;
2) хлорид кобальта (II) + гидроксид аммония (изб.) + воздух. Составьте уравнения этих реакций. Определите молярность исходного раствора Н2O2 в реакции (1), если для ее полного протекания потребовалось 135 мл этого раствора, а в результате реакции образовалось 1,2412 г осадка.
Ответ: 0,0418 моль/л.
Хромит калия окисляется бромом в щелочной среде. Зеленая окраска раствора переходит в желтую. Составьте электронные и молекулярные уравнения реакции. Какие ионы обусловливают начальную и конечную окраску раствора?
Образец некоторого железосодержащего минерала массой 0,7108 г химически переведен в раствор в инертной атмосфере, все железо находится в виде ионов Fe2+. На реакцию с этим раствором израсходовано 48 мл 0,1 н раствора перманганата калия. Определите массовую долю (%) железа в исходном образце.
Ответ: 37,8%.
Составьте электронные полууравнения и молекулярные уравнения реакций цинка:
а)с раствором гидроксида натрия;
б)с концентрированной серной кислотой, учитывая восстановление серы до нулевой степени окисления.
Составьте уравнение реакций по следующей схеме:
![]()
2.191 Составьте электронные полууравнения и молекулярные уравнения реакций:
а) растворение золота в царской водке;
б) взаимодействия осмия с фтором.
Золото окисляется до степени окисления +3, а осмий +8.
Предложите способы обнаружения и разделения катионов цинка (II) и кадмия (II) при их одновременном присутствии в водном растворе. Напишите уравнения реакций.
Серебро не взаимодействует с разбавленной серной кислотой, тогда как в концентрированной оно растворяется. Чем это можно объяснить? Составьте электронные и молекулярные уравнения реакции.
Составьте уравнения реакций по схеме:
![]()
К подкисленному серной кислотой раствору дихромата калия прибавили порошок алюминия. Через некоторое время оранжевая окраска раствора перешла в зеленую. Составьте электронные и молекулярные уравнения реакции.
Составьте уравнения всевозможных реакций по схеме:

При действии на титан конц. хлороводородной кислоты образуется трихлорид титана, а при действии азотной кислоты -осадок метатитановой кислоты. Составьте электронные полууравнения и молекулярные уравнения соответствующих реакций.
Составьте уравнения возможных реакций по следующей схеме:
![]()
Золото растворяется в царской водке и селеновой кислоте, приобретая при этом высшую степень окисления. Составьте электронные полууравнения и молекулярные уравнения соответствующих реакций.
2.200 Какое количество 5%-ного раствора сульфида аммония требуется для полного осаждения меди в виде сульфида из 120 мл 0,2 М раствора [Cu(NH3)4]SO4? Какое количество комплексной соли потребуется?
Ответ: 32,64 г.
2.201 В 1 л воды содержится ионов магния 36,47 мг и ионов кальция 50,1 мг. Чему равна жесткость этой воды? Ответ: 5,5 мэкв/л.
В 1 м3 воды содержится 140 г сульфата магния. Вычислите жесткость этой воды. Ответ: 2,33 мэкв/л.
Какие ионы надо удалить из природной воды, чтобы сделать ее мягче? Введением каких ионов можно умягчить воду? Составьте уравнение соответствующих реакций. Какую массу Са(ОН)2 надо прибавить к 2,5 л воды, чтобы устранить ее жесткость, равную 4,43 мэкв/л? Ответ: 0,406 г.
К 100 л жесткой воды прибавили 12,95 г гидроксида кальция. Насколько понизилась карбонатная жесткость воды? Ответ: на 3,5 мэкв/л.
Чему равна карбонатная жесткость воды, если 1 л ее содержит 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция?
Ответ: 6,5 мэкв/л.
Какая масса CaSO4 содержится в 200 л воды, если жесткость, обусловливаемая этой солью, равна 8 мэкв/л? Ответ: 108,8 г.
Какую массу Na3PO4 надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 мэкв/л? Ответ: 136,6 г.
В 220 л воды содержится 11 г сульфата магния. Чему равна жесткость этой воды? Ответ: 0,83 мэкв/л.
Какую массу карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость равную 3 мэкв/л. Ответ: 63,6 г.
2.210 Вода, содержащая только гидрокарбонат магния, имеет жесткость 3,5мэкв/л. Какая масса гидрокарбоната магния содержится в 200 л этой воды? Ответ: 51,1 г.
2.211 Вода, содержащая только сульфат магния, имеет жесткость 7 мэкв/л. Какая масса сульфата магния содержится в 300 л этой воды?
Ответ: 126,3 г.
Вычислите жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбоната магния и 61,2 г сульфата кальция.
Ответ: 3,0 мэкв/л.
К 1 м3 жесткой воды прибавили 132,5 г карбоната натрия. Насколько понизилась жесткость?
Ответ: на 2 мэкв/л.
Какую массу гидроксида кальция надо прибавить к 275 л воды, чтобы устранить ее карбонатную жесткость, равную 5,5 мэкв/л?
Ответ: 56,06 г.
Какую массу карбоната натрия надо прибавить к 0,1 м3 воды, чтобы устранить жесткость, равную 4 мэкв/л?
Ответ: 21,2 г.
Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,2 г карбоната натрия?
Ответ: 8 мэкв/л.
Вода, содержащая только гидрокарбонат кальция, имеет жесткость 9 мэкв/л. Какая масса гидрокарбоната кальция содержится в 500 л воды?
Ответ: 364,5 г.
Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4мэкв/л. Какой объем 0,1 н. раствора НС1 требуется для реакции с гидрокарбонатом кальция, содержащимся в 75 мл этой воды?
Ответ: 3 см3.
Какие соли обусловливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. Чему равна жесткость воды, в 100 л которой содержится 14,632 г гидрокарбоната магния?
Ответ: 2 мэкв/л.
2.220 Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 200 см3 воды, требуется 15 см3 0,08 н раствора НС1.
Ответ: 6 мэкв/л.
2.221 Вода, содержащая только гидрокарбонат магния, имеет жесткость 3,5мэкв/л. Какая масса гидрокарбоната магния содержится в 200 л этой воды?
Ответ: 51,1 г.
К 1 м3 жесткой воды прибавили 132,5 г карбоната натрия. Насколько понизилась жесткость?
Ответ: на 2,5 мэкв/л.
Жесткость воды равна 4,5 мэкв/л. Какую массу соды в граммах нужно внести для устранения жесткости в 1 м3 такой воды?
Ответ: 238,5 л.
Какую массу карбоната натрия в граммах надо добавить к 5 л воды, чтобы устранить общую жесткость, равную 4,6 мэкв/л?
Ответ: 1,22 г.
Некарбонатная жесткость воды равна 2,48 мэкв/л. Сколько граммов Na3P04 надо взять, чтобы умягчить 10 м3 такой воды?
Ответ: 1355,7 г.
Сколько граммов гашеной извести надо прибавить к 2,5 л воды, чтобы устранить ее временную жесткость, равную 4,43 мэкв/л?
Ответ: 0,41 г.
Некарбонатная жесткость воды равна 5,18 мэкв/л. Сколько граммов Na3P04 надо взять, чтобы умягчить 4 м3 такой воды?
Ответ: 1133,4 г.
Жесткость воды равна 4,35 мэкв/л. Сколько соды (в граммах) нужно прибавить к 1 м3 этой воды для устранения жесткости?
Ответ: 230,55 г.
Жесткость некоторого образца воды обусловливается только нитратом кальция. При обработке 0,25 л образца воды карбонатом натрия в осадок выпало 37,8 мг CaCOs. Чему равна жесткость воды?
Ответ: 3,024 мэкв/л.
2.230 Какую массу соды в граммах Na2CO3 надо прибавить к 30 л воды, чтобы устранить общую жесткость воды, равную 4,64 мэкв/л?
Ответ: 7,38 г.
