
- •Сборник заданий
- •Задание 1 по теме "строение вещества"
- •1 Задание 1 по теме: «строение атома»
- •2.1 Опишите строение предложенных в варианте задания молекул и молекулярных ионов по методу валентных связей (мвс).
- •2.2 Строение молекул и ионов по методу молекулярных орбиталей (мо)
- •Раздел 3.1
- •3.1 Проанализируйте влияние сил межмолекулярного взаимодействия на свойства веществ (решите задачу с указанным номером).
- •Список рекомендуемой литературы
- •Задание 2 по теме: «термохимия. Направление химических реакций»
- •Примеры решения задач
- •2 Рекомендации для самостоятельной работы студентов и варианты заданий
- •3 Задачи для самостоятельного решения
- •4. Варианты заданий
- •1 Примеры решения задач
- •1.3 Вычисление константы химического равновесия
- •1.4 Вычисление равновесных концентраций
- •1.5 Направление смещения равновесия
- •Задачи для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание 4 по теме «Растворы»
- •Примеры решения задач
- •1.1 Процентная концентрация
- •1.3 Моляльная концентрация (моляльность) , мольная доля, титр
- •1.4 Осмотическое давление. Закон вант- гоффа
- •1.5 Давление насыщенного пара растворов. Тонометрический закон рауля
- •1.6 Температуры кипения и замерзания растворов.
- •2.Задачи для самостоятельного решения
- •3. Варианты заданий для самостоятельной работы
- •Список рекомендуемой литературы
- •Задание 5 по теме "растворы электролитов"
- •Примеры решения задач
- •1.1 Вычисление степени диссоциации слабых электролитов
- •1.2 Сильные электролиты. Вычисление степени электролитической диссоциации
- •1.3 Произведение растворимости
- •1.5 Обменные реакции в растворах электролитов
- •Задачи для самостоятельного решения
- •Варианты домашних заданий
- •Приложение а
- •Список рекомендуемой литературы
- •Задание 6 по теме «гидролиз солей»
- •Примеры решения задач
- •Варианты контрольных заданий
- •Приложение а
- •Список рекомендуемой литературы
- •Задание 7 по теме «Окислительно–восстановительные реакции. Электрохимия»
- •Примеры решения задач
- •2 Задания для самостоятельного решения
- •Список рекомендуемой литературы
- •Задание 8 по теме «Классификация и свойства неорганических веществ»
- •Примеры решения задач
- •Пример 5. С какими из перечисленных веществ вступит в реакцию серная кислота:koh,CuO,Ba(oh)2,Fe2o3,Al2o3,co2,SiO2,h3po4, o2,h2o? Составьте уравнения возможных реакций.
- •Задания для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание 9 по теме "Комплексные соединения"
- •Примеры решения задач
- •2 Задачи для самостоятельного решения
- •3 Варианты заданий
- •Список рекомендуемой литературы
- •Задание 10 по теме «свойства элементов и их соединений»
- •ПримерЫ решения задач
- •3 Варианты заданий
- •Список рекомендуемой литературы
- •Сборник заданий для самостоятельной работы студентов по дисциплине «Общая и неорганическая химия»
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов,1
Варианты заданий
|
Ва-ри-ант |
Номер задачи |
Ва ри- ант |
Номер задачи | ||||||||
|
1 |
2.1 |
2.22 а |
2.24 |
2.54 |
2.84 а |
16 |
2.16 |
2.23 а |
2.39 |
2.69 |
2.85 а |
|
2 |
2.2 |
2.22 б |
2.25 |
2.55 |
2.84 б |
17 |
2.17 а |
2.23 б |
2.40 |
2.70 |
2.85 б |
|
3 |
2.3 |
2.22 в |
2.26 |
2.56 |
2.84 в |
18 |
2.17 б |
2.23 в |
2.41 |
2.71 |
2.85 в |
|
4 |
2.4 |
2.22 г |
2.27 |
2.57 |
2.84 г |
19 |
2.17 в |
2.23 г |
2.42 |
2.72 |
2.86 а |
|
5 |
2.5 |
2.22 д |
2.28 |
2.58 |
2.84 д |
20 |
2.18 |
2.23 д |
2.43 |
2.73 |
2.86 б |
|
6 |
2.6 |
2.22 е |
2.29 |
2.59 |
2.84 е |
21 |
2.19 а |
2.23 е |
2.44 |
2.74 |
2.86 в |
|
7 |
2.7 |
2.22 ж |
2.30 |
2.60 |
2.84 ж |
22 |
2.19 б |
2.23 ж |
2.45 |
2.75 |
2.87 а |
|
8 |
2.8 |
2.22 и |
2.31 |
2.61 |
2.84 и |
23 |
2.19 в |
2.23 и |
2.46 |
2.76 |
2.87 б |
|
9 |
2.9 |
2.22 к |
2.32 |
2.62 |
2.84 к |
24 |
2.19 г |
2.23 к |
2.47 |
2.77 |
2.87 в |
|
10 |
2.10 |
2.22 л |
2.33 |
2.63 |
2.84 л |
25 |
2.19 д |
2.23 л |
2.48 |
2.78 |
2.88 а |
|
11 |
2.11 |
2.22 м |
2.34 |
2.64 |
2.84 м |
26 |
2.19 е |
2.23 м |
2.49 |
2.79 |
2.88 б |
|
12 |
2.12 |
2.22 н |
2.35 |
2.65 |
2.84 н |
27 |
2.19 ж |
2.23 н |
2.50 |
2.80 |
2.88 в |
|
13 |
2.13 |
2.22 п |
2.36 |
2.66 |
2.84 п |
28 |
2.20 |
2.23 п |
2.51 |
2.81 |
2.89 а |
|
14 |
2.14 |
2.22 р |
2.37 |
2.67 |
2.84 р |
29 |
2.21 а |
2.23 р |
2.52 |
2.82 |
2.89 б |
|
15 |
2.15 |
2.22 с |
2.38 |
2.68 |
2.84 с |
30 |
2.21 б |
2.23 с |
2.53 |
2.83 |
2.89 в |
Список рекомендуемой литературы
1 Глинка Н.Л. Общая химия.–М.: Интегралл-пресс, 2004.
2 Ерохин Ю.М., Фролов В.И. Сборник задач и упражнений по химии.–М.: Высшая школа, 2005.
3 Сыркин А.М., Зорина Л.Н. Классификация и номенклатура неорганических веществ: учеб. пособие.- Уфа: УГНТУ, 2006.
4 Курс общей химии /под ред. Н.В.Коровина-М.:Высшая школа, 1999.
Задание 9 по теме "Комплексные соединения"
Примеры решения задач
Пример 1. Для соединений Na[Co(SCN)4(H2O)2] и [Fe(NH3)5(NO2)]Cl2 определить тип комплекса, степени окисления всех составляющих и указать комплексообразователь, лиганды, ионы внешней и внутренней сферы и координационное число. Записать уравнения диссоциации комплексных соединений и константу нестойкости для комплексных ионов.
Решение
Сначала
проанализируем состав комплексного
соединения. В комплексном соединении
содержится сложный комплексный ион,
который показан в квадратных скобках.
Комплексный ион состоит из
комплексообразователя
и лигандов.
Комплексообразователь записывается
первым в квадратной скобке, а далее
следуют лиганды. Лигандами могут быть
как заряженные частицы: I![]() ,Cl
,Cl![]() ,F
,F![]() ,NO
,NO![]() ,NO
,NO![]() ,
OH
,
OH![]() ,CN
,CN![]() ,SCN
,SCN![]() ,
так и нейтральные молекулы: Н2О,
NH3.
Количество лигандов вокруг
комплексообразователя называется его
координационным
числом.
Чаще
всего лиганд бывает связан с
комплексообразователем через один из
своих атомов одной
двухцентровой химической связью. Такого
рода лиганды получили название
монодентатных.
К числу монодентатных лигандов относятся
все галогенид-ионы, цианид-ион, аммиак,
вода и другие. Существует целый ряд
лигандов, которые в комплексах являются
практически всегда бидентатными.
Это - этилендиамин, карбонат-ион,
оксалат-ион и т.п. Каждая молекула или
ион бидентатного лиганда образует с
комплексообразователем две химические
связи в соответствии с особенностями
своего строения:
,
так и нейтральные молекулы: Н2О,
NH3.
Количество лигандов вокруг
комплексообразователя называется его
координационным
числом.
Чаще
всего лиганд бывает связан с
комплексообразователем через один из
своих атомов одной
двухцентровой химической связью. Такого
рода лиганды получили название
монодентатных.
К числу монодентатных лигандов относятся
все галогенид-ионы, цианид-ион, аммиак,
вода и другие. Существует целый ряд
лигандов, которые в комплексах являются
практически всегда бидентатными.
Это - этилендиамин, карбонат-ион,
оксалат-ион и т.п. Каждая молекула или
ион бидентатного лиганда образует с
комплексообразователем две химические
связи в соответствии с особенностями
своего строения:

Комплексообразователь и лиганды связаны прочной ковалентной связью донорно-акцепторного типа. Комплексный ион является ионом внутренней сферы. Снаружи располагаются ионы внешней сферы. Ионы внешней и внутренней сферы связаны ионной связью.
Заряд комплексообразователя определяют исходя из зарядов ионов внешней сферы, лигандов, их количества и нейтральности молекулы в целом. Определим заряд комплексообразователя для рассматриваемых комплексных соединений.
Na+[Cox(SCN)![]() (H2O)
(H2O)![]() ]
[Fex(NH3)
]
[Fex(NH3)![]() (NO
(NO![]() )–]Cl
)–]Cl![]()
1+ х + 4(-1) + 2·0 = 0 х + 0·5 + (-1) + (-1)·2 = 0
х = +3 х = +3
Следовательно комплексообразователем в первом соединении является Со3+, а во втором – Fe3+.
В
приведенном примере вокруг
комплексообразователя Со3+
расположены лиганды: (SCN)![]() и (Н2О)0,
их число равно 6, а вокруг Fe3+
– лиганды (NH3)0
и (NO2)–,
их число также равно 6. Заряд комплексного
иона [Fe(NH3)5NO2]2+
равен +2. Ионами внешней сферы в указанном
соединении являются ионы Cl
и (Н2О)0,
их число равно 6, а вокруг Fe3+
– лиганды (NH3)0
и (NO2)–,
их число также равно 6. Заряд комплексного
иона [Fe(NH3)5NO2]2+
равен +2. Ионами внешней сферы в указанном
соединении являются ионы Cl![]() .Заряд
комплексного иона [Co(SCN)4(H2O)2]-
равен -1. Ионами внешней сферы в указанном
соединении являются ионы Na+.
Исходя из вышесказанного данные
комплексные соединения могут быть
представлены следующими схемами (рисунки
1а и 1б):
.Заряд
комплексного иона [Co(SCN)4(H2O)2]-
равен -1. Ионами внешней сферы в указанном
соединении являются ионы Na+.
Исходя из вышесказанного данные
комплексные соединения могут быть
представлены следующими схемами (рисунки
1а и 1б):
Далее определим тип приведенных комплексных соединений. Классификацию комплексных соединений можно провести
1) по заряду комплекса. По этому признаку комплексные соединения делятся на катионные (например, [Zn(NH3)4]Cl2), анионные (K3[Fe(CN)6]), катионно-анионные ([Cu(NH3)4][PtCl6]), нейтральные ([Pd(NH3)2Cl2]0).
2) по виду лигандов комплексные соединения подразделяются на аквакомплексы ([Cr(H2O)6](NO3)3]), гидроксокомплексы (Na[Al(OH)4]), аммиакаты ([Ag(NH3)2]Cl), ацидокомплексы (K2[PtCl6]), гидридные комплексы (Na[BH4]), карбонильные комплексы ([Fe(CO)5]), π-комплексы ([Fe(C5H5)2]), хелаты ([Cu(NH2CH2COO)2]) и смешанные комплексы ([Co(NH3)4Cl2]NO3).
Л
Комплексо-образователь







 иганды
иганды
Ион
внешней сферы
Ион
внутренней
сферы
(комплекс-
ный
ион)
Лиганды











 Рисунок
1а Схема комплексного соединения
Na[Co(SCN)4(H2O)2]
Рисунок
1а Схема комплексного соединения
Na[Co(SCN)4(H2O)2]
Лиганды
Комплексо-образователь
Ион
внешней
сферы
Ион
внешней
сферы
Ион
внутрен-ней сферы
(комплексный
ион)
Лиганды











Рисунок 1б Схема комплексного соединения [Fe(NH3)5 NO2]Cl2
3) по составу внешней сферы среди комплексных соединений выделяют кислоты (Н2[PtCl6]), основания ([Ag(NH3)2]ОН), соли (KFe[Fe(CN)6]), неэлектролиты ([Cr(NH3)3(NCS)3]).
Используя
приведенную классификацию, комплексное
соединение Na[Co(SCN)4(H2O)2]
относится
к анионным комплексам, так как комплексная
частица [Co(SCN)4(H2O)2]¯
является анионом. По виду лигандов –
это смешанный комплекс, так как во
внутреннюю координационную сферу входят
различные лиганды - (SCN)![]() и (Н2О)0,
их число равно 6. По составу
внешней сферы данное соединение является
комплексной солью.
и (Н2О)0,
их число равно 6. По составу
внешней сферы данное соединение является
комплексной солью.
[Fe(NH3)5(NO2)]Cl2 относится к катионным комплексам, так как комплексная частица [Fe(NH3)5NO2]2+ является катионом. По виду лигандов – это смешанный комплекс, так как во внутреннюю координационную сферу входят различные лиганды - (NH3)0 и (NO2)–, их число равно 6. По составу внешней сферы данное соединение является комплексной солью.
Комплексные соединения, имеющие ионную внешнюю сферу, в растворе подвергаются диссоциации на комплексный ион и ионы внешней сферы. Они ведут себя в разбавленных растворах как сильные электролиты: диссоциация протекает моментально и практически нацело. Комплексные соединения при диссоциации образуют комплексные ионы:
Na[Co(SCN)4(H2O)2]
→ Na+
+ [Co(SCN)4(H2O)2]![]() ;
;
[Fe(NH3)5NO2]Cl2
→ [Fe(NH3)5NO2]2+
+ 2Cl![]() .
.
Если во внешней сфере комплексного соединения находятся гидроксид-ионы, то это соединение – сильное основание (диссоциация идет нацело, рН>>7). Пример соединения этого типа – гидроксид тетраамминцинка (II):
[Zn(NH3)4](OH)2 → [Zn(NH3)4]2+ + 2OH-.
Комплексные соединения с внешнесферными катионами водорода (типа гексафторосиликата водорода или тетрафторобората водорода) в водном растворе нацело подвергаются протолизу. Они являются сильными кислотами:
H[BF4] + H2O → [BF4]- + H3O+.
Однако на отщеплении внешнесферных ионов процесс электролитической диссоциации не заканчивается. Комплексные ионы, в свою очередь, подвергаются обратимой электролитической диссоциации, уже как слабые электролиты, по схеме:
[Co(SCN)4(H2O)2]![]()
![]() Со3+
+ 4 SCN
Со3+
+ 4 SCN![]() +
2 H2O
+
2 H2O
[Fe(NH3)5(NO2)]2+
![]() Fe2+
+5 NH3
+ NO2–.
Fe2+
+5 NH3
+ NO2–.
Такая диссоциация протекает ступенчато: лиганды удаляются из внутренней сферы постепенно, один за другим (точнее, происходит реакция замещения лиганда на молекулы растворителя - воды). Применяя закон действующих масс к обратимым процессам, получим выражения констант нестойкости комплексных ионов:


Пример 2. Назвать комплексные соединения [Co2(CO)8], H[Sb(OH)6], Li[AuBr4], [Co(H2O)5NH3]Br3.
Решение:
Современная номенклатура комплексных соединений основана на рекомендациях ИЮПАК (Международный союз общей и прикладной химии) и адаптирована к традициям русского химического языка.
Правила изображения формул комплексных соединений следующие. При составлении формулы одноядерного комплекса (ионного или нейтрального) слева ставят символ центрального атома (комплексообразователя), а затем перечисляют лиганды в порядке уменьшения их зарядов от положительных значений к отрицательным: [M(L1)+(L2)0(L3)ˉ]. При равенстве зарядов лигандов пользуются практическим рядом элементов. Например, H2O записывают левее NH3, C5H5N – левее CO. Более простые лиганды в формулах указывают левее более сложных: так, N2 пишут левее NH3, NH3 – левее N2H4, N2H4 – левее NH2OH. В формулах многоядерных комплексов указывают число центральных атомов, например [MxLy].
Названия веществ строят из названий лигандов с предшествующей числовой приставкой (греческое числительное), указывающей число лигандов каждого типа в формуле, и названия комплексообразователя в определенной форме. Если название лиганда уже содержит числовую приставку, а также в тех случаях, когда такая приставка создает неясность в строении лиганда, используют умножающие приставки, такие как бис-, трис-, тетракис-, пентакис- и др. Например: (SO42-)2 - бис(сульфато-), (NH2CH2CH2NH2)4 – тетракис(этиленди-амин).
Порядок перечисления лигандов. Перечисление лигандов ведут от отрицательного заряда лиганда к нейтральному и затем положительному, т.е. справа налево по формуле соединения:
[M(L1)+(L2)0(L3)-].
Названия анионных лигандов получают, добавляя концевую гласную -о, которой сопровождается название соответствующего аниона (или корня названия аниона):
CN‾ - циано NO‾ - нитрозо O22‾ - пероксо
NO2‾ - нитро C2O42‾ - оксалато OH‾ - гидроксо
Cl‾ - хлоро SO32‾ - сульфито CH3COO‾ - ацетато
H‾ - гидридо SO3S2‾ - тиосульфато
Иногда анионные лиганды имеют специальные названия, например O2- - оксо, S2- - тио, HS- - меркапто. Анионы углеводородов в качестве лигандов называют так: CH3- - метил, C5H5- - циклопентадиенил.
Для нейтральных лигандов используют номенклатурные названия веществ без изменений (N2 - диазот, N2H4 - гидразин, C2H4 - этилен и т.д.), кроме веществ, которые, выступая в роли лигандов, получают следующие специальные названия:
H2O - аква NH3 – аммин NO - нитрозил
CO – карбонил SO2 - диоксосера PF3 - трифторофосфор
Громоздкие по написанию формулы органических лигандов заменяют полностью или частично буквенными обозначениями, например:
NH2CH2CH2NH2 (этилендиамин) – en
P(C2H5)3 (триэтилфосфин) – PEt3
(NH2)2CO (карбамид) – ur
C5H5N (пиридин) – py
Для катионных лигандов применяют следующие названия:
N2H5+ - гидразиний NO2+ - нитроилий
NO+ - нитрозилий H+ - гидро
Нейтральные комплексы. Названия комплексов без внешней сферы состоят из одного слова. Вначале указывается число и названия лигандов (для лигандов каждого вида отдельно), затем название центрального атома в именительном падеже (в случае многоядерных комплексов – с указанием числа центральных атомов). Например:
[Al2Cl6] – гексахлородиалюминий
[Ni(CO)4] – тетракарбонилникель.
Комплексные катионы. Названия соединений с комплексными катионами строятся так же, как и названия простых соединений, состоящих из катиона и аниона (т.е. "анион катиона", например NaCl - хлорид натрия, BaCrO4 - хромат бария, H2O2 - пероксид водорода и т.п.). Однако в рассматриваемом случае катион не простой, а комплексный.
Названия комплексных катионов состоят из числа и названия лигандов и названия комплексообразователя (для многоядерных комплексов – с указанием их числа). Обозначение степени окисления комплексообразователя дают римскими цифрами в скобках после названия (по способу Штока), например:
[Ag(NH3)2]+ - катион диамминсеребра (I)
[Cr2(NH3)9(OH)2]4+ - катион дигидроксононаамминдихрома (III).
Названия соединений, включающих комплексный катион, строятся следующим образом:
[Mn(H2O)6] SO4 - сульфат гексааквамарганца(II)
[Ag(NH3)2]OH - гидроксид диамминсеребра(I)
[Cr2(NH3)9(OH)2]Cl4 - хлорид дигидроксононаамминдихрома(III).
Комплексные анионы. Названия соединений с комплексными анионами строятся так же, как названия простых соединений, состоящих из катиона и аниона. Однако в рассматриваемом случае анион не простой, а комплексный.
Название комплексного аниона строится из числа и названия лигандов, корня названия элемента-комплексообразователя, суффикса -ат и указания степени окисления комплексообразователя:
[BF4]- - тетрафтороборат(III)-ион
[Al(H2O)2(OH)4]- - тетрагидроксодиакваалюминат(III)-ион
[VS4]3- - тетратиованадат(V)-ион
Для целого ряда элементов-комплексообразователей вместо русских используются корни их латинских названий:
Ag - аргент- ; Au - аур- ; Cu - купр- ; Fe - ферр- ; Hg - меркур- ; Mn - манган- ; Ni - никкол- ; Pb - плюмб- ; Sb - стиб- ; Sn - станн-.
Примеры названий комплексных анионов:
[Fe(CN)6]3- - гексацианоферрат(III)-ион
[Ag(SO3S)2]3- - дитиосульфатоаргентат(I)-ион.
Названия соединений, включающих комплексный анион, строятся следующим образом:
(NH4)2[PtCl6] - тетрахлороплатинат(IV) аммония
K3[AlF6] – гексафтороалюминат калия
Таким образом, искомые названия комплексных соединений:
[Co2(CO)8] – октакарбонилдикобальт
H[Sb(OH)6] - гексагидроксостибат(V) водорода
Li[AuBr4] – тетрабромоаурат(III) лития
[Co(H2O)5NH3]Br3 – бромид амминпентаквакобальта(III).
Пример 3. По названию комплексного соединения напишите его эмпирическую формулу: трироданотрицианоферрат (III) аммония; фосфатотриаквахром; тетрабромородат (II) диаквадиамминхрома (III)
Решение:
В соединении трироданотрицианоферрат (III) аммония, очевидно, комплексным является анион. Комплексная частица записывается в квадратных скобках, ее формулу записываем справа налево в порядке перечисления лигандов с указанием их числа, левее всех лигандов записываем комплексообразователь, а слева от квадратной скобки записываем катион. После этого проставляем заряды всех частиц и, используя принцип электронейтральности молекулы, находим индексы при катионе и анионе:
+1 +3 3(-1) 3(-1)
(NH4+)3[Fe(CN)3(SCN)6]3-.
Название комплексного соединения фосфатотриаквахром сразу указывает на нейтральный комплекс, следовательно, формула соединения заключена в квадратные скобки. Далее, как и в предыдущем примере, лиганды записываем справа налево в порядке перечисления с указанием их числа, левее всех лигандов записываем комплексообразователь: [Cr(H2O)3PO4].
Название тетрабромородат (II) диамминдиаквахрома (III) указывает на то, что в этом соединении комплексными являются и катион и анион. Следовательно, и правую (анион) и левую (катион) части формулы мы заключаем в квадратные скобки. Нельзя забывать, что название аниона записывается первым (слева), а в формуле анион указывают вторым (справа). Далее действуем по обычному алгоритму:
+3 0 0 +2 4(-1)
[Cr+3(H2O)2(NH3)2]23+[Rh+2Br4]32-
Пример 4. Определить тип гибридизации атомных орбиталей иона-комплексообразователя и магнитные свойства комплексных ионов [CoF6]3- и [Co(NH3)6]3+.
Решение:
В теории кристаллического поля химическая связь комплексообразователь – лиганд считается электростатической. В соответствии с этой теорией лиганды располагаются вокруг комплексообразователя в вершинах правильных многогранников (полиэдров) в виде точечных зарядов. Реальный объем лиганда теорией во внимание не принимается. Лиганды, как точечные заряды, создают вокруг комплексообразователя электростатическое поле (“кристаллическое поле”, если рассматривать кристалл комплексного соединения, или поле лигандов), в котором энергетические уровни комплексообразователя и, прежде всего, d-подуровни расщепляются и их энергия изменяется. Характер расщепления, энергия новых энергетических уровней зависит от симметрии расположения лигандов (октаэдрическое, тетраэдрическое или иное кристаллическое поле). Когда в качестве лигандов координируются молекулы H2O, NH3, CO и другие, их рассматривают как диполи, ориентированные отрицательным зарядом к комплексообразователю.
Рассмотрим случай октаэдрического расположения лигандов (например, [CoF6]3- или [Co(NH3)6]3+). В центре октаэдра находится атом-комплексообразователь М(+n) с электронами на d-атомных орбиталях, а в его вершинах – лиганды в виде точечных отрицательных зарядов (например, ионы F- или полярные молекулы типа NH3). В условном ионе М(+n), не связанном с лигандами, энергии всех пяти d-АО одинаковы (т.е. атомные орбитали вырожденные).
Однако в октаэдрическом поле лигандов d-АО комплексообразователя попадают в неравноценное положение. Атомные орбитали d(z2) и d(x2- y2), вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между этими орбиталями и лигандами, находящимися в вершинах октаэдра, возникают значительные силы отталкивания, приводящие к увеличению энергии орбиталей. Иначе говоря, данные атомные орбитали подвергаются максимальному воздействию поля лигандов.
Другие три d-АО – d(xy), d(xz) и d(yz), расположенные между осями координат и между лигандами, находятся на более значительном расстоянии от них. Взаимодействие таких d-АО с лигандами минимально, а следовательно – энергия d(xy), d(xz) и d(yz)-АО понижается по сравнению с исходной.
Таким образом, пятикратно вырожденные d-АО комплексообразователя, попадая в октаэдрическое поле лигандов, подвергаются расщеплению на две группы новых орбиталей – трехкратно вырожденные орбитали с более низкой энергией, d(xy), d(xz) и d(yz), и двукратно вырожденные орбитали с более высокой энергией, d(z2) и d(x2-y2). Эти новые группы d-орбиталей с более низкой и более высокой энергией обозначают de и dg:

Разность энергий двух новых подуровней de и dg получила название параметра расщепления Δ0:
E2 – E1 = Δ0 .
Выигрыш энергии за счет преимущественного заселения электронами de-атомных орбиталей называют энергией стабилизации комплекса полем лигандов.
Специфика каждого из лигандов сказывается в том, какое поле данный лиганд создает – сильное или слабое. Чем сильнее поле лигандов, чем больше значение параметра расщепления Δ0. Изучение параметра расщепления, как правило, основано на спектроскопических исследованиях.
Наиболее распространенные лиганды можно расположить в следующий спектрохимический ряд, вдоль которого значение Δ0 монотонно растет:
I- <Br- <Cl- ≈NCS- << NO3- < F- < OH- < H2O ≈ H- < NH3 < NO2- < CN- ≈ NO ≈ CO.
Рассмотрим распределение электронов по de- и dg-орбиталям в октаэдрическом поле лигандов. Заселение de- и dg-орбиталей происходит в полном соответствии с правилом Гунда и принципом Паули. При этом независимо от значения параметра расщепления первые три электрона занимают квантовые ячейки de-подуровня:
Если число электронов на d-подуровне комплексообразователя больше трех, для размещения их по расщепленным подуровням появляется две возможности. При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают энергетический барьер, разделяющий de- и dg-орбитали; четвертый, а затем и пятый электроны заселяют квантовые ячейки dg-подуровня. При сильном поле лигандов и высоком значении D0 заселение четвертым и пятым электроном dg-подуровня исключено; происходит заполнение de-орбиталей.
При слабом поле лигандов заселяющие квантовые ячейки 4 или 5 электронов имеют параллельные спины, поэтому получаемый комплекс оказывается сильно парамагнитен. В сильном поле лигандов образуются одна, а затем две электронные пары на de-подуровне, так что парамагнетизм комплекса оказывается гораздо слабее.
Вернемся к рассмотрению электронного строения октаэдрических комплексных ионов [Co(NH3)6]3+ и [CoF6]3-. В соответствии с расположением в спектрохимическом ряду, аммиак NH3 относится к числу лигандов сильного поля, а фторид-ион F- – слабого поля. Следовательно, заселение электронами атомных орбиталей в данных комплексах будет происходит по схеме:

В анионе [CoF6]3- лиганды F- создают слабое кристаллическое поле (Δ0 = 13000 см-1), и все электроны исходной 3d6-АО размещаются на de- и dg-орбиталях без какого-либо спаривания. Комплексный ион является высокоспиновым и содержит четыре неспаренных электрона, поэтому он парамагнитен. При образовании этого комплекса реализуется тип гибридизации sp3d2 .

В ионе [Co(NH3)6]3+ лиганды NH3 создают сильное кристаллическое поле (Δ0 = 22900 см-1), все 3d6-электроны размещаются на более энергетически выгодной de-орбитали. Переход электронов с de- на dg-орбитали невозможен из-за слишком высокого энергетического барьера. Поэтому данный комплексный катион является низкоспиновым, он не содержит неспаренных электронов и диамагнитен. При образовании этого комплекса реализуется тип гибридизации d2sp3.
Пример 5. Константа нестойкости иона [Ag(CN)2]- составляет 1∙10-21. Вычислить концентрацию ионов серебра в 0,05 М растворе К[Ag(CN)2], содержащем, кроме того, 0,01 моль/л KCN.
Решение:
Вторичная диссоциация комплексного иона протекает по уравнению:
[Ag(CN)2]- ↔ Ag+ + 2CN-.
В присутствии избытка ионов CN-, создаваемого в результате диссоциации KCN (которую можно считать полной), это равновесие смещено влево настолько, что количеством ионов CN- , образующимся при вторичной диссоциации, можно пренебречь. Тогда [CN-] = C KCN = 0,01 моль/л. По той же причине равновесная концентрация ионов [Ag(CN)2]- может быть приравнена к общей концентрации комплексной соли (0,05 моль/л).
По условию задачи:
 .
.
Отсюда выражаем концентрацию ионов Ag+.
 .
.
Подставив значения концентраций ионов CN- и [[Ag(CN)2]-], получим:
![]() .
.
Пример 6. Растворы простых солей кадмия образуют со щелочами осадок гидроксида кадмия Cd(OH)2, а с сероводородом – осадок сульфида кадмия CdS. Чем объяснить, что при добавлении щелочи к 0,05М раствору K2[Cd(CN)4], содержащему 0,1 моль/л KCN, осадок не образуется, тогда как при пропускании через этот раствор сероводорода выпадает осадок CdS? Константу нестойкости иона [Cd(CN)4]2- принять равной 7.8∙10-18.
Решение:
Условия образования осадков Cd(OH)2 и CdS могут быть записаны следующим образом:
[Cd2+][OH-]2 > ПР Cd(OH)2 = 4,5 ∙ 10-15
[Cd2+][S2-] > ПР CdS = 8 ∙ 10-27.
В растворе комплексной соли при заданных условиях концентрация ионов Cd2+ вычисляется по уравнению (см. пример 1):
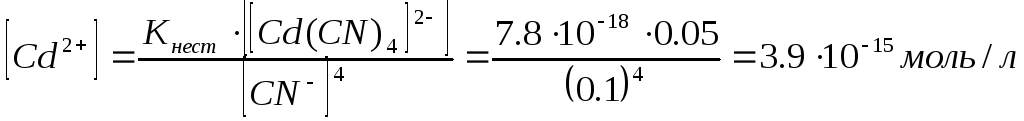 .
.
Тогда концентрация ионов ОН-, достаточная для осаждения гидроксида кадмия, найдется из неравенства
 .
.
Таким образом, в рассматриваемой системе при концентрациях ионов ОН- меньших, чем 1 моль/л, равновесие [Cd(CN)4]2- + 2ОН-↔ Cd(OH)2 + 4CN- смещено в сторону образования комплексного иона.
Условие образования осадка сульфида кадмия из заданного раствора тетрацианокадмата калия выразится неравенством:
![]() .
.
Следовательно, даже при малых концентрациях сульфид-иона равновесие [Cd(CN)4]2- + S2-↔ CdS + 4CN- практически полностью смещено в сторону образования сульфида кадмия.
Пример 7. Произойдет ли образование осадка Cu(OH)2 при сливании равных объемов 1.0 М растворов КОН и [Cu(NH3)4]Cl2 , содержащего избыток 0.5 моль аммиака. Кн([Cu(NH3)4]2+)=9.33∙10-13; ПРCu(OH)2 =5.6∙10-20; степень диссоциации [Cu(NH3)4]Cl2 и КОН принять равной 1.
Решение:
При сливании равных объемов растворов концентрация каждого из компонентов уменьшается в 2 раза, т.е. станет равной С([Cu(NH3)4]Cl2)=0.5 моль/л; СКОН=0.5 моль/л; С(NH3) =0.25 моль/л.
В присутствии избытка аммиака равновесие диссоциации иона
[Cu(NH3)4]2+↔ Cu2+ + 4NH3
сильно смещено влево. Поэтому концентрацией аммиака, получающегося при диссоциации этого иона, можно пренебречь, а концентрацию NH3 в растворе можно считать равной 0.25 моль/л. Отсюда
![]()
![]() .
.
Так как раствор гидроксида калия – сильный электролит: КОН↔К+ + ОН- , то
СК+= СОН-=0.5 моль/л.
Тогда [Cu2+]∙[OH-]2=1.17∙10-10∙(0.5)2=2.9∙10-11,
т.е. [Cu2+]∙[OH-]2 > ПРCu(OH)2.
Следовательно, осадок Cu(OH)2 образуется.
