
- •Введение
- •Обзор литературы
- •Денатурация и ренатурация
- •Результаты и обсуждения
- •Выделение gfp из е. Coli
- •Проверка наличия телец включения в е. Coli
- •Очистка gfp от примесных продуктов после выделения
- •Метод а
- •Метод b
- •Определение концентрации с использованием реактива Брэдфорда
- •Анализ спектров поглощения и испускания полученных растворов gfp
- •Анализ фракций после очистки aceGfp с помощью электрофореза
- •Материалы и методы
- •Биомасса
- •Приборы
- •Материалы
- •Методики приготовления буферных растворов.
- •Приготовление Буфера с
- •Насыщенный раствор сульфата аммония
- •Приготовление геля для электрофореза полиакриламидном геле
- •Экстракция образца в трет-бутаноле (Метод в)
- •Количественное определение белков методом Брэдфорда
- •Электрофорез в полиакриламидном геле в присутствие додецилсульфата натрия
- •Спектральный анализ
- •Перебуферивание образцов методом ультрафильтрации
- •Список литературы
Проверка наличия телец включения в е. Coli
Так как при экспрессии рекомбинантных белков в E. coli возможно образование телец включения, то было принято решение провести процесс разрушения телец включения GFP, для увеличения выхода целевого продукта.
При добавлении к осадку 8М раствора мочевины и при последующем разбавлении, разрушения телец включения не произошло. Как видно из Рис. 6, в супернатанте флуоресценции, при возбуждении образца лазерным лучом, не наблюдается, что свидетельствует об отсутствии телец включения после разрушения клеточной структуры биомассы.

Рисунок 6. Анализ наличия телец включения в образце.
Очистка gfp от примесных продуктов после выделения
Поскольку существует множество вариантов очистки белка нами выделены две методики основанные на экстракции с применением n-бутанола или трет-бутанола (далее метод А и метод В [6,7]), было принято решение проверить эффективность обеих и сравнить степень очистки белков, а так же их воспроизводимость.
Метод а
Экстракции проводили последовательно по методике [6]. Схема метода и результат экстрагирования представлены на Рис. 7, 8, соответственно.
Контролировали наличие флуоресценции в целевой фазе с дальнейшим анализом интересующих фракций методом ВЭЖХ (Рис.9).
Так как метод очистки был основан на поэтапном переходе GFP из водной фазы в этанольную, а затем при добавлении n-бутанола, должно было произойти выпадание примесных белков в качестве интерфазы и переход GFP в спиртовую, а затем чистого белка обратно в водную. Но из-за недостаточного растворения GFP, белок был размыт во всех фазах. Небольшое количество белка удалось ресуспендировать в водную фазу, но флуоресценции данного образца была неудовлетворительна по сравнению с методом В.
Анализ фаз при помощи синего лазерного луча показал наличие флуоресценции во всех образцах. Дополнительная очистка (повторное воспроизведения метода В) для водных фаз, не дала существенного результата, сконцентрировать белок не удалось.
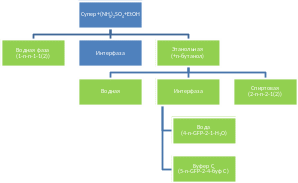
Рисунок 7. Схема процесса экстракции GFP с использованием н-бутанола.

Рисунок 8. А. Первый этап экстракции GFP в этанольную фазу. В. Второй этап перехода GFP после добавления н-бутанола после предварительного отделения этанольной фракции.
На Рис. 9 представлены результаты анализа целевого образца (объединенная водная фаза 4-n-GFP-2-1-H2O, 5-n-GFP-2-4-буфС) после очистки по методу А с использованием ВЭЖХ и UV-детекции. Детекцию проводили на двух длинах волны: 395 нм, чтобы отследить время выхода GFP из колонки - целевое соединение выходит из колонки на 9 минуте; 280 нм, чтобы проанализировать долю GFP в образце - содержание GFP среди других белков составляет около 1%.
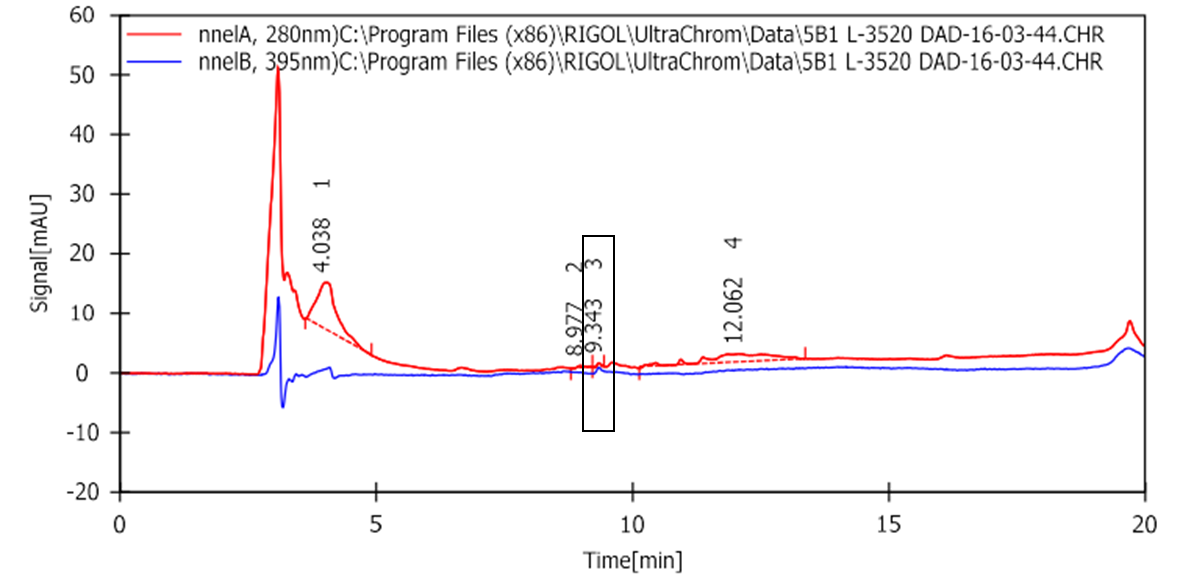
Рисунок 9. Хроматограмма целевой фракции (5А).
Метод b
Процесс экстракции проводили еще одним методом, параллельно методике обсуждаемой в п 3.1, для сравнения эффективности очистки целевого белка от примесных продуктов [5]. Метод очистки основан на переходе GFP из водной фазы в трет-бутанольную, а затем при повышении концентрации соли и трет-бутанола выпадения GFP в интерфазу. Данный метод очистки был более эффективен, так как в интерфазу удалось перенести значительное количество целевого белка и подтвердить его присутствие по флуоресценции, а также удалось определить его концентрацию.
Схема процесса и результаты экстракции представлены на Рис. 10 и 11 соответственно.
При анализе образцов на наличие флуоресценции, с помощью синего лазера, наблюдалось присутствие зеленого свечения во всех фракциях, причем наибольшая интенсивность наблюдалась в целевом осадке. Финальный образец 5В был проанализирован с использованием ВЭЖХ с UV-детекцией (Рис. 12).
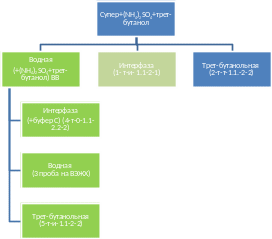
Рисунок 10. Схема процесса экстракции GFP с использованием трет-бутанола.

Рисунок 11. А. GFP оставался в нижней водной фазе после первого этапа экстракции. В. Интерфаза, содержащая целевой белок после второго этапа экстрагирования, была растворена в буфере С.
На Рис. 12 представлены результаты анализа целевого образца после очистки по методу В с использованием ВЭЖХ и UV-детекции. Детекцию проводили на двух длинах волны: 395 нм, чтобы отследить время выхода GFP из колонки - целевое соединение выходит из колонки на 9 минуте; 280 нм, чтобы проанализировать долю GFP в образце - содержание GFP среди других белков составляет около 2%.
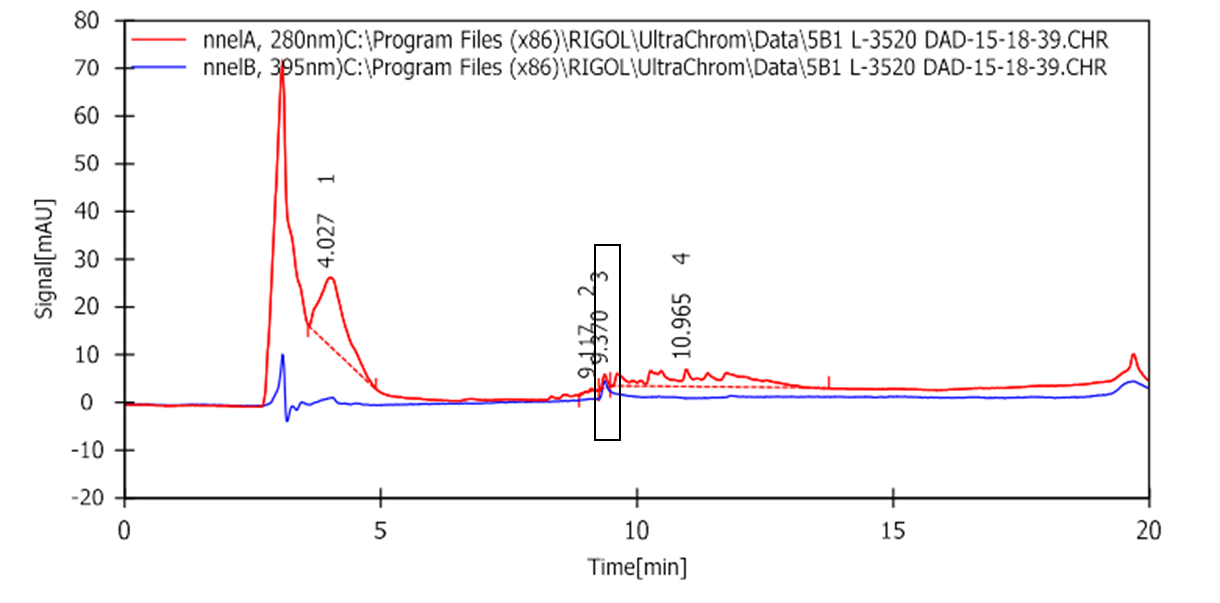
Рисунок 12. Хроматограмма целевой фракции (5В).
Данный метод экстракции имеет ряд преимуществ из-за более низкого расхода реагентов, простоты реализации, а также в качестве продукта, поскольку целевой белок сохраняет флуоресценцию и не размывается в различные фракции, что позволяет сконцентрировать его в водной фазе.
