
- •Введение
- •Обзор литературы
- •Денатурация и ренатурация
- •Результаты и обсуждения
- •Выделение gfp из е. Coli
- •Проверка наличия телец включения в е. Coli
- •Очистка gfp от примесных продуктов после выделения
- •Метод а
- •Метод b
- •Определение концентрации с использованием реактива Брэдфорда
- •Анализ спектров поглощения и испускания полученных растворов gfp
- •Анализ фракций после очистки aceGfp с помощью электрофореза
- •Материалы и методы
- •Биомасса
- •Приборы
- •Материалы
- •Методики приготовления буферных растворов.
- •Приготовление Буфера с
- •Насыщенный раствор сульфата аммония
- •Приготовление геля для электрофореза полиакриламидном геле
- •Экстракция образца в трет-бутаноле (Метод в)
- •Количественное определение белков методом Брэдфорда
- •Электрофорез в полиакриламидном геле в присутствие додецилсульфата натрия
- •Спектральный анализ
- •Перебуферивание образцов методом ультрафильтрации
- •Список литературы

МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«МИРЭА – Российский технологический университет»
РТУ МИРЭА
Институт тонких химических технологий имени М.В. Ломоносова
Кафедра биотехнологии и промышленной фармации
Отчет по лабораторной практике
по дисциплине:
«Методы исследования биологически активных соединений»
по теме:
«Выделение GFP из биомассы E. coli»
Выполнил: студенты группы ХБМО-01-24
Смирнова М.А., Ельмеева О.С., Гусева А.А., Денискин Д.А., Кондратович В.В., Фролова С.Е., Лапшинов О.О., Бурыкин А.И., Урбина Э.В., Ломтатидзе А.Ш., Розин Г.Д., Тутаев К.С., Сорокина К.А., Левшина К.П., Шитова А.А., Нестеркова Е.В.
Проверил: доц., к.х.н.
Матвеев А.В.
Москва 2024
Оглавление
Введение 3
Обзор литературы 4
Результаты и обсуждения 8
1. Выделение GFP из Е. coli 8
2. Проверка наличия телец включения в Е. coli 10
3. Очистка GFP от примесных продуктов после выделения 11
3.1. Метод А 11
3.2. Метод B 13
4. Определение концентрации с использованием реактива Брэдфорда 16
5. Анализ спектров поглощения и испускания полученных растворов GFP 17
6. Анализ фракций после очистки aceGFP с помощью электрофореза 19
Материалы и методы 22
1. Биомасса 22
2. Приборы 22
3. Материалы 22
4. Методики приготовления буферных растворов. 23
4.1. Приготовление Буфера С 23
4.2. Насыщенный раствор сульфата аммония 23
4.3. 5М р-р NaCl 23
4.4. Буфер хранения: PBS + 20% глицерина 24
4.5. Приготовление геля для электрофореза полиакриламидном геле 24
5. «Заморозка -оттаивание» клеточной биомассы 25
6. Анализ образца в микроскопе 25
7. Разрушение телец включения 25
8. Экстракция образца в n-бутаноле (Метод А) 25
9. Экстракция образца в трет-бутаноле (Метод В) 26
10. ВЭЖХ 27
11. Количественное определение белков методом Брэдфорда 27
12. Электрофорез в полиакриламидном геле в присутствие додецилсульфата натрия 27
13. Спектральный анализ 28
14. Перебуферивание образцов методом ультрафильтрации 28
Вывод 29
Список литературы 30
Введение
Зелёный флуоресцентный белок (GFP) — это революционный инструмент в биологии, обеспечивающий визуализацию биологических процессов in vivo, открытый в медузе Aequorea victoria. Этот белок способен к самопроизвольной флуоресценции, излучая яркий зеленый свет при возбуждении ультрафиолетовым или синим светом. Эта уникальная способность сделала GFP незаменимым инструментом в различных областях биологических исследований, от клеточной биологии и нейронаук до генетики и разработки лекарственных препаратов.
Благодаря относительно простой структуре и способности к генетической модификации, GFP и его многочисленные мутанты с измененными спектральными характеристиками стали основой для создания широкого спектра флуоресцентных меток, позволяющих наблюдать за динамикой белков, клеток и целых организмов в реальном времени.
Поиск методов выделения GFP и его очистки из биологической смеси даст возможность понять и изучить биотехнологические методы получения и исследования ценных коммерческих, производственных и научных агентов.
Целью работы является выделение GFP из биомассы Е. coli. Для достижения поставленной цели необходимо решить следующие задачи:
Изучить литературные источники, позволяющие понять структуру и функции зеленого флуоресцентного белка.
Подбор методики выделения, очистки и подтверждения полученных результатов в литературных источниках.
Проведение экспериментальных исследований на основе найденных методов.
Оценка и анализ полученных результатов.
Обзор литературы
Зеленый
флуоресцентный белок имеет структуру,
состоящую из одиннадцати β-цепей и
 -спирали,
содержащей ковалентно связанный хромофор
4-(п-гидроксибензилиден)имидазолидин-5-он
(HBI). Модель строения GFP и его хромофор
представлены на рис. 1.
-спирали,
содержащей ковалентно связанный хромофор
4-(п-гидроксибензилиден)имидазолидин-5-он
(HBI). Модель строения GFP и его хромофор
представлены на рис. 1.
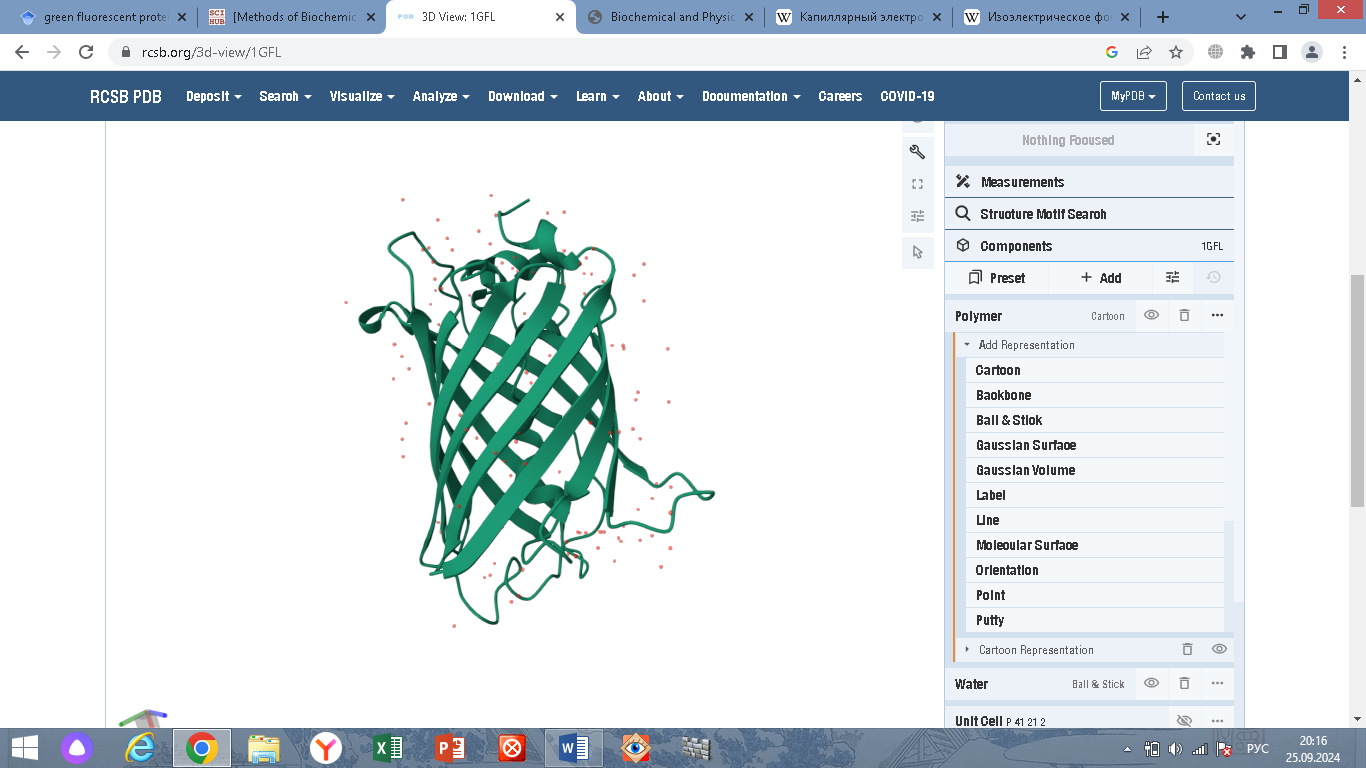
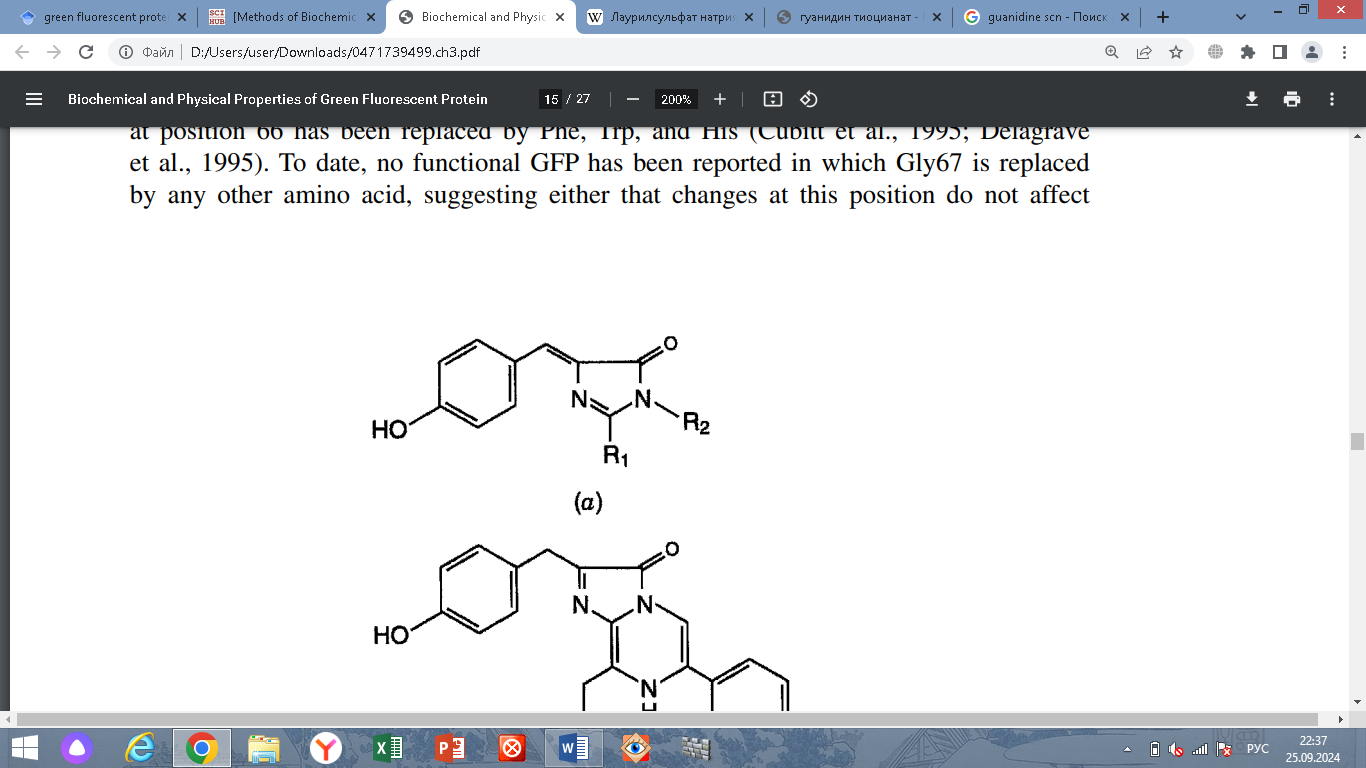
Рисунок 1. Структура GFP и его хромофора.
В составе данного белка преобладают аминокислоты с анионными заместителями, более подробный состав представлен в табл. 1 [7]. В разбавленном растворе существует в виде мономера.
Таблица 1. Аминокислотный состав GFP из Renilla и Aequorea.

Белок флуоресцирует в зеленом диапазоне при освещении его светом от синего до ультрафиолетового диапазона. Зелёный флуоресцентный белок характеризуется двумя пиками поглощения при длинах волн 395 нм (основной) и 475 нм (минорный) и пиком флуоресценции на 498 нм. Спектр поглощения и испускания GFP представлены на рис. 2. Основные свойства зеленого флуоресцентного белка представлены в табл. 2.
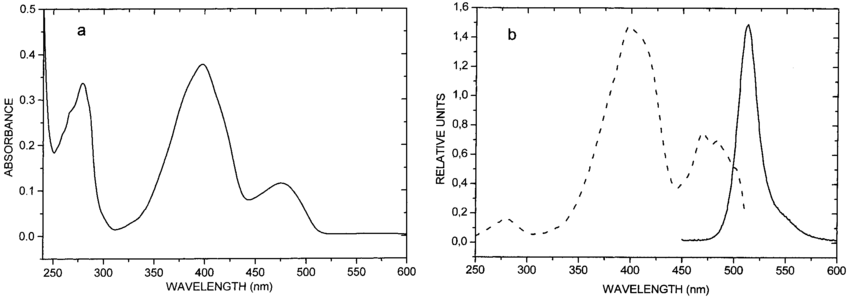
Рисунок 2. a. Спектр поглощения GFP. b. Спектр испускания флуоресценции, возбуждение при 395 нм. Спектр возбуждения флуоресценции, испускание при 500 нм.
Таблица 2. Свойства GFP.
Свойства |
Описание |
Флуоресценция |
GFP белок который флуоресцирует в зеленом диапазоне при освещении его светом от синего до ультрафиолетового диапазона. |
Пики поглощения и флуоресценции |
Зелёный флуоресцентный белок характеризуется двумя пиками поглощения при длинах волн 395 нм (основной) и 475 нм (минорный) и пиком флуоресценции на 498 нм. |
Состав |
Белок состоит из 238 аминокислот |
Молекулярная масса |
26,9 кДа |
Плотность |
Плотность GFP белка примерно равна 1,3 г/мл |
Коэффициент экстинкции ε |
55 000 М-1см -1 |
Квантовый выход флуоресценции (QY) |
0,60 |
Относительная яркость, выраженная в виде ε• QY |
33 000 М-1см-1 |
рI |
5,0 |
