
- •Упаковка днк в хромосомах. Хромосомы эукариот. Гистоны, нуклеосомы, негистоновые белки. Хромосомы прокариот.
- •2. Репликация днк. Схема репликации днк. Днк-полимеразы. Типы днк-полимераз, активности днк-полимераз, инициация синтеза днк, днк-полимеразы про- и эукариот.
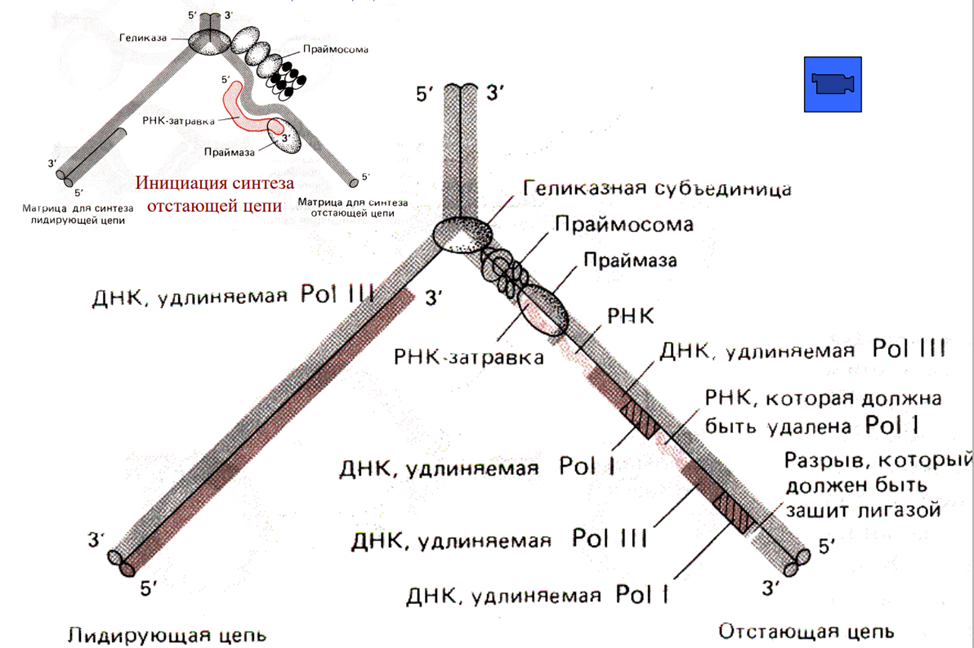
- •Инициация синтеза днк у прокариот (например, Escherichia coli)
- •Распознавание и связывание с origin (oriC):
- •Образование репликационной вилки:
- •Синтез рнк-праймера:
- •Присоединение днк-полимеразы III:
- •Инициация синтеза днк у эукариот
- •Распознавание репликационного начала:
- •Загрузка геликаз:
- •Синтез рнк-праймера:
- •Присоединение днк-полимераз:
- •4. Репликация днк. Схема репликации днк. Точки начала репликации (origin). Инициация образования новых цепей днк. Рнк-праймеры, праймаза (праймосома), необычные случаи инициации.
- •5. Репликация днк. Схема репликации днк. Терминация репликации. Теломерная днк и теломераза.
- •6. Репликация рнк. Репликация геномов ретровирусов. Обратная транскриптаза. Репликация рнк с образованием рнк.
- •7. Репарация днк. Повреждения в структуре днк. Репарация путем прямого восстановления исходной структуры. Репарация путем замены модифицированных остатков. Значение репарации днк.
- •12. Трансляция мРнк у прокариот. Условия инициации. Элонгация полипептидной цепи. Терминация элонгации полипептидной цепи.
- •13. Регуляция экспрессии лактозного оперона.
- •14. Регуляция экспрессии триптофанового оперона.
- •15. Рнк интерференция.
- •16. Доставка эукариотических белков к клеточным мембранам и проникновение через них. Транспорт белков в эукариотические клеточные органеллы. Транспорт белков в клетках прокариот.
- •Основные этапы везикулярного транспорта:
- •Два основных механизма везикулярного переноса:
- •Роль сигнального (лидерного) пептида
- •Ядерный транспорт
- •Транспорт в митохондрии и хлоропласты
- •Транспорт в эндоплазматический ретикулум (эр)
- •Транспорт через Гольджи аппарат и лизосомы
- •Транспорт белков в клетках прокариот
- •1. Система Sec (общий секреторный путь):
- •2. Система Tat (путь протонного градиента):
- •18. Транскрипция у эукариот. Регуляторные участки гена эукариот: инициация транскрипции, энхансеры, сайленсеры и инсуляторы. Терминация транскрипции с участием рнк-полимераз I, II и III.
- •19. Структурная часть гена эукариот. Мозаичные единицы транскрипции. Экзоны и интроны. Сплайсинг рнк: альтернативный сплайсинг, локализация генов в интронах.
- •1. Промотор
- •Конститутивный и альтернативный сплайсинг
- •Роль альтернативного сплайсинга в клетке
- •20. Сплайсинг рнк. Сплайсинг ядерной про-мРнк. Интроны, вырезаемые при помощи автокаталитического сплайсинга.
- •21. Строение эукариотического гена. Расположение генов в хромосомах эукариот. Структура генома эукариот.
- •22. Мобильные элементы генома. Классификация мобильных элементов.
- •1. Транспозоны:
- •2. Ретровирусы:
- •23. Мобильные элементы генома. Ретротранспозоны.
- •24. Мобильные элементы генома. Мобильные элементы прокариот: is-элементы, транспозоны. Is-элементы и транспозоны в плазмидах. Бактериофаг Mu.
- •Мобильные элементы прокариот
- •Бактериофаг Mu.
- •25. Функциональное значение мобильных элементов генома. (Васина)
- •26. Рибонуклеиновые кислоты. Структура рнк. Типы рнк и их распространённость. Минорные рнк. Рибозимы. Вирусные рнк. Мультифункциональность рнк. (Васина)
5. Репликация днк. Схема репликации днк. Терминация репликации. Теломерная днк и теломераза.
Терминация – завершение биосинтеза ДНК в результате считывания всей последовательности ДНК. ДНК-гиразы закручивают спираль ДНК и восстанавливают ее структуру. При каждом делении клеток происходит укорочение концевых – теломерных участков хромосом на 50 п.н. Теломеры в среднем имеют размеры 3-20 тыс. п.н., и после определенного количества клеточных делений репликация становится невозможной. Одноклеточные животные, эмбриональные, стволовые, а также опухолевые клетки содержат специальный фермент – теломеразу, способный наращивать концевые участки ДНК перед каждым процессом ее удвоения.
Непрерывный рост лидирующей и отстающей цепей вдоль кольцевой матрицы неизбежно приводит к совмещению 3'-гидрокси- и 5'-фосфорильного концов одной цепи либо в точке начала репликации, либо при двунаправленной репликации в середине кольца. Кольца в этих местах встречи соединяются ДНК-лигазой, при этом обычно они оказываются попарно сцепленными, и в дальнейшем должно произойти из разъединение на отдельные геномы. Это происходит с помощью топоизомеразы типа ІІ.


Терминация и завершение репликации в линейных ДНК. За исключением репликации аденовирусной ДНК, где синтез новых цепей ДНК инициируется белковым праймером и матричная цепь копируется полностью, во всех других случаях ДЛЯ репликации необходим РНК-праймер, что создает особые проблемы при завершении репликации линейной дуплексной ДНК. Дело в том, что после инициации синтеза новой цепи и последующего удаления РНК-праймера новосинтезированна цепь содержит пробел на 5'-конце. Поскольку ника ких способов удлинения 5'-концов цепей ДНК не существует, необходимы какие-то иные методы за вершения репликации.

Терминация репликации ДНК у прокариот
Большинство бактерий и архей имеют кольцевые хромосомы, в которых репликация ДНК начинается в месте, известном как начало репликации. Двухцепочечная ДНК, раскрученная в начале, создает две репликационные вилки, которые взаимодействуют с комплексами ДНК-полимеразы (реплисомами), которые продвигают каждую вилку и движутся в противоположных направлениях от начала, копируя исходные нити. Окончание репликации ДНК происходит, когда две вилки встречаются и сливаются, создавая две отдельные двухцепочечные молекулы ДНК. У хорошо изученных бактерий Escherichia coli и Bacillus subtilis это происходит в конечной области, которая расположена диаметрально противоположно началу. Неправильное окончание репликации хромосомы может привести к проблемам с функцией и стабильностью генома, включая сверхрепликацию ДНК. Напротив, некоторые археи имеют многоисточниковые хромосомы и, по-видимому, не регулируют специально место окончания.
Ключевые понятия
• Прекращение репликации ДНК происходит, когда две противоположно ориентированные репликационные вилки встречаются и сливаются, образуя две отдельные и полные двухцепочечные молекулы ДНК.
• В кольцевых бактериальных хромосомах прекращение ограничено областью, называемой терминальной областью, расположенной примерно напротив начала репликации.
• Ловушка репликационной вилки представляет собой противоположное расположение однонаправленных сайтов терминации репликации (Ter) в области ДНК, что позволяет репликационным вилкам входить в ловушку с любого направления, но не выходить из нее.
• Неспособность правильно завершить репликацию бактериальной хромосомы приводит к избыточной репликации хромосом и нестабильности генома.
• Белки-терминаторы связываются с асимметричными сайтами Ter ДНК, чтобы остановить репликационную вилку, приближающуюся к неразрешающей стороне, но разрешить проход вилки с разрешающей стороны.
Терминация репликации в Escherichia coli

(A) Изображение хромосомы Escherichia coli, включая начало репликации oriC и десять сайтов ter, показанных красными и синими наконечниками стрелок. Зона терминации подчеркнута красным. В рамке зеленая стрелка показывает репликационную вилку, проходящую через сайт ter в пермиссивной ориентации, а красная стрелка показывает вилку, останавливающуюся на сайте ter в непермиссивной ориентации. (B) Два сценария остановки вилки в зоне терминации. (a) Правая вилка (Вилка 1) приходит первой и останавливается на terC, за ней следует прибытие левой (Вилка 2). (b) Две вилки приходят в зону терминации одновременно и встречаются между terC и terA.

(C) Возможный механизм остановки репликации E. coli. (a) Вилки сходятся между тер сайтами с образованием пре-катенанов. (b) Два репликативных комплекса хеликазы белка синтеза ДНК B (DnaB) проходят друг мимо друга и сталкиваются с нисходящей ведущей цепью, образуя 3'-лоскут. DnaB диссоциирует, 3'-лоскут удаляется, пробелы заполняются, и конечный фрагмент Оказаки обрабатывается ДНК-полимеразой I (Pol I). (c) Ники лигируются, и конечный катенан, который образуется во время завершения синтеза ДНК, удаляется (не показано).

(D)Возможный механизм повторной инициации репликации. (a) Если 3'-лоскуты не удаляются или не ремоделируются, устанавливается новая репликативная вилка, которая предотвращает завершение терминации. (b) Свободный конец повторно проникает в сестринскую хроматиду, используя рекомбинационный белок A (RecA) и RecBCD, которые устанавливают новую репликативную вилку. (c) Соединение Холлидея разрешается, и DnaB повторно загружается на вилку примосомными белками A (PriA) и PriB.

Концы хромосом дрожжей, беспозвоночных, растений и позвоночных имеют сходное, весьма необычное строение: они содержат шпилькообразные структуры, в которых 3'- и 5'-концы дуплекса ДНК оказываются рядом, и много коротких тандемных повторов. Около петли в одной из цепей в области повторов имеются множественные одноцепочечные разрывы.
Концы хромосом реплицируются теломеразой


Синтез отстающей нити в репликационной вилке происходит прерывисто по механизму «обратных стежков» с образованием коротких фрагментов ДНК. Этот механизм сталкивается с особой проблемой, когда репликационная вилка достигает конца линейной хромосомы: на самом конце линейной молекулы ДНК нет места для размещения РНК-затравки, необходимой для начала последнего фрагмента Оказаки. Бактерии решают эту проблему «концов репликации», обзаведшись кольцевыми молекулами ДНК вместо хромосом. Эукариоты решают ее гениальным способом: на концах хромосом у них есть специализированные нуклеотидные последовательности, которые включены в структуры, названные теломерами. Теломеры содержат много тандемных повторов короткой последовательности, которая похожа у таких разных организмов, как протисты, грибы, растения и млекопитающие. У человека последовательность повторяющейся единицы имеет вид GGGTTA и повторяется примерно тысячу раз в каждой теломере. Последовательности теломерной ДНК узнают специфичные к такой последовательности ДНК-связывающие белки, которые привлекают фермент, названный теломеразой, который и пополняет запас этих последовательностей при каждом делении клетки. Теломераза распознает конец существующей повторяющейся последовательности теломерной ДНК и продолжает его в направлении 5' → 3', используя для синтеза новых копий повтора матрицу РНК, которая является компонентом самого фермента. Ферментативная часть теломеразы напоминает другие обратные транскриптазы — ферменты, которые синтезируют ДНК, используя матрицу РНК. После продления родительской цепи ДНК теломеразой репликация отстающей нити на конце хромосомы может быть довершена обычными ДНК-полимеразами, использующими эти продолжения в качестве матриц для синтеза комплементарной нити. Только что описанный механизм, прибегнув к помощи нуклеазы, которая съедает 5'-конец, гарантирует, что 3'-конец ДНК в каждой теломере всегда будет более длинным, чем 5'-конец, с которым он спарен так, что однонитевой конец выдается наружу. Этот выступающий конец, как было показано, загибается петлей назад, просовывает свой однонитевой конец в спираль ДНК теломерной повторяющейся последовательности и образует t-петлю. В самых общих чертах эта реакция напоминает встраивание цепи (strand invasion) во время гомологичной рекомбинации, обсуждаемой ниже, и она, возможно, эволюционировала из этих древних рекомбинационных систем. T-петли дают нормальные концы хромосом с уникальной структурой, которая защищает их от ферментативной деградации и четко отличает их от концов разорванных молекул ДНК, которые клетка быстро репарирует.


У дрозофилы комплекс концевой блокировки (синий квадрат) состоит из белков, которые в первую очередь связаны с гетерохроматином и связываются независимо от последовательности с концом массива ретротранспозонов (HTT), который заменяет повторы, генерируемые теломеразой, обнаруженные у других эукариот. Этот массив состоит из тандемных не-LTR ретротранспозонов нерегулярной длины с их олиго(A)-хвостами (обозначенными как A), обращенными к центромере. Он связан с белками, которые в противном случае обнаруживаются либо в гетерохроматине, либо в эухроматине (зеленый прямоугольник) и имеет эухроматические свойства. Субтеломерные (TAS) повторы (чередующиеся светло- и темно-синие маленькие прямоугольники) собирают отдельный комплекс подавления (оранжевый овал), который распространяется в проксимальную область массива HTT. Таким образом, функции кэпирования на конце хромосомы четко отделены от домена молчания TAS, который имеет гетерохроматиновые свойства. В человеческих клетках, генерируемые теломеразой повторы TTAGGG (чередующиеся черные и серые полосы) могут образовывать структуру t-петли, которая стабилизируется специфическими белками (красный овал). Белки, связывающиеся с теломерными повторами, собирают гетерохроматический комплекс молчания (телосому или шелтерин; фиолетовые овалы), который может распространяться в регион TAS. Таким образом, кэпирование и молчание сосредоточены на теломерных повторах. Ассоциированные белки показаны под каждой структурой.
