- •Упаковка днк в хромосомах. Хромосомы эукариот. Гистоны, нуклеосомы, негистоновые белки. Хромосомы прокариот.
- •2. Репликация днк. Схема репликации днк. Днк-полимеразы. Типы днк-полимераз, активности днк-полимераз, инициация синтеза днк, днк-полимеразы про- и эукариот.
- •Инициация синтеза днк у прокариот (например, Escherichia coli)
- •Распознавание и связывание с origin (oriC):
- •Образование репликационной вилки:
- •Синтез рнк-праймера:
- •Присоединение днк-полимеразы III:
- •Инициация синтеза днк у эукариот
- •Распознавание репликационного начала:
- •Загрузка геликаз:
- •Синтез рнк-праймера:
- •Присоединение днк-полимераз:
- •4. Репликация днк. Схема репликации днк. Точки начала репликации (origin). Инициация образования новых цепей днк. Рнк-праймеры, праймаза (праймосома), необычные случаи инициации.
- •5. Репликация днк. Схема репликации днк. Терминация репликации. Теломерная днк и теломераза.
- •6. Репликация рнк. Репликация геномов ретровирусов. Обратная транскриптаза. Репликация рнк с образованием рнк.
- •7. Репарация днк. Повреждения в структуре днк. Репарация путем прямого восстановления исходной структуры. Репарация путем замены модифицированных остатков. Значение репарации днк.
- •12. Трансляция мРнк у прокариот. Условия инициации. Элонгация полипептидной цепи. Терминация элонгации полипептидной цепи.
- •13. Регуляция экспрессии лактозного оперона.
- •14. Регуляция экспрессии триптофанового оперона.
- •15. Рнк интерференция.
- •16. Доставка эукариотических белков к клеточным мембранам и проникновение через них. Транспорт белков в эукариотические клеточные органеллы. Транспорт белков в клетках прокариот.
- •Основные этапы везикулярного транспорта:
- •Два основных механизма везикулярного переноса:
- •Роль сигнального (лидерного) пептида
- •Ядерный транспорт
- •Транспорт в митохондрии и хлоропласты
- •Транспорт в эндоплазматический ретикулум (эр)
- •Транспорт через Гольджи аппарат и лизосомы
- •Транспорт белков в клетках прокариот
- •1. Система Sec (общий секреторный путь):
- •2. Система Tat (путь протонного градиента):
- •18. Транскрипция у эукариот. Регуляторные участки гена эукариот: инициация транскрипции, энхансеры, сайленсеры и инсуляторы. Терминация транскрипции с участием рнк-полимераз I, II и III.
- •19. Структурная часть гена эукариот. Мозаичные единицы транскрипции. Экзоны и интроны. Сплайсинг рнк: альтернативный сплайсинг, локализация генов в интронах.
- •1. Промотор
- •Конститутивный и альтернативный сплайсинг
- •Роль альтернативного сплайсинга в клетке
- •20. Сплайсинг рнк. Сплайсинг ядерной про-мРнк. Интроны, вырезаемые при помощи автокаталитического сплайсинга.
- •21. Строение эукариотического гена. Расположение генов в хромосомах эукариот. Структура генома эукариот.
- •22. Мобильные элементы генома. Классификация мобильных элементов.
- •1. Транспозоны:
- •2. Ретровирусы:
- •23. Мобильные элементы генома. Ретротранспозоны.
- •24. Мобильные элементы генома. Мобильные элементы прокариот: is-элементы, транспозоны. Is-элементы и транспозоны в плазмидах. Бактериофаг Mu.
- •Мобильные элементы прокариот
- •Бактериофаг Mu.
- •25. Функциональное значение мобильных элементов генома. (Васина)
- •26. Рибонуклеиновые кислоты. Структура рнк. Типы рнк и их распространённость. Минорные рнк. Рибозимы. Вирусные рнк. Мультифункциональность рнк. (Васина)
20. Сплайсинг рнк. Сплайсинг ядерной про-мРнк. Интроны, вырезаемые при помощи автокаталитического сплайсинга.
Сплайсинг ядерной про-мРНК
Основную информацию о механизме сплайсинга ядерной про-мРНК удалось получит благодаря тому, что в распоряжении исследователей имелись клонированные прерывистые гены. Особенно полезным оказалось изучение модифицированных форм этих генов. При установлении структурных особенностей, необходимых для успешного сплайсинга, используют также специально сконструированные элементы, состоящие из соединенных специфических последовательностей экзонов и интронов. Но самым информативным оказался биохимический подход с использованием клеточных экстрактов, обеспечивающих сплайсинг, и последующей очисткой компонентов аппарата сплайсинга. Особенно важную роль сыграло применение кэпированных РНК-субстратов, полученных в результате транскрипции специальным образом сконструированных ДНК-матриц, встроенных справа от промотора фага SP6, при помощи специфической РНК-полимеразы SP6 (рис. 6.23)
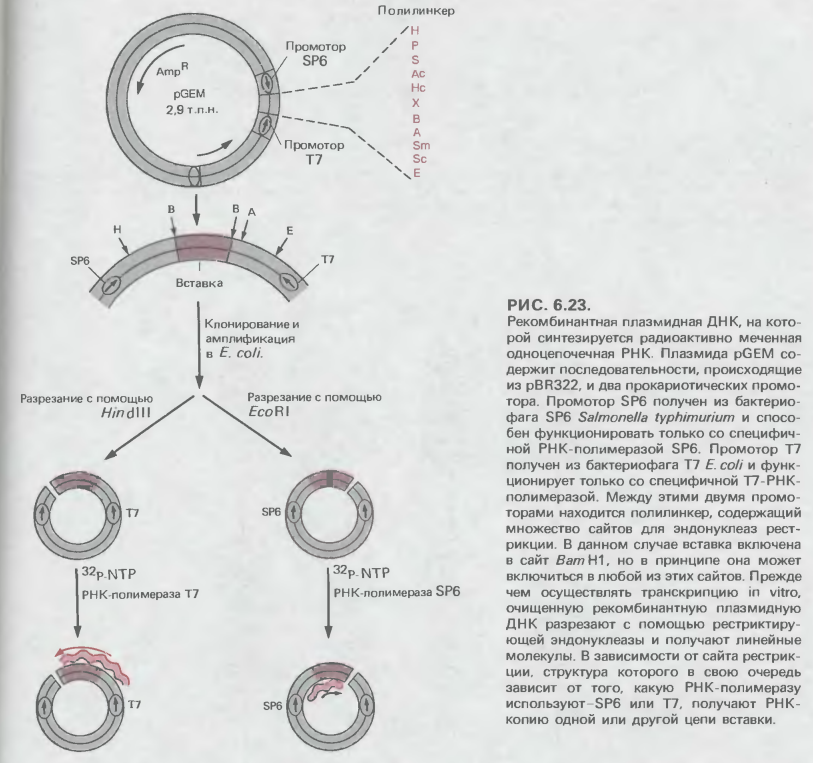
Общие свойства.
Сплайсинг ядерных про-мРНК осуществляется в ядре, возможно, одновременно с транскрипцией для одних генов и лишь после завершения транскрипции для других. Есть свидетельства в пользу того, что на этот процесс влияет кэпирование 5’-конца транскрипта, хотя неясно, почему: в полиаденилировании РНК явно нет необходимости. Главная проблема, и концептуальная, и практическая, состоит в том, каким образом происходит сплайсинг про-мРНК с множественными интронами, в результате которого соседние экзоны соединяются друг с другом. Поскольку известно, что 5’-сайт сплайсинга одного интрона может присоединяться к 3’-сайту сплайсинга другого, важно понять, каким образом это предотвращается в процессе нормального вырезания интронов и как стимулируется при альтернативных способах сплайсинга.
Последовательность этапов сплайсинга.
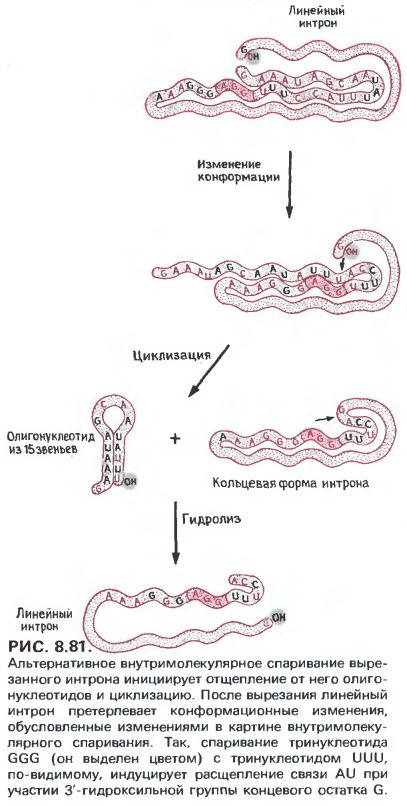
Сначала мы рассмотрим реакции расщепления и лигирования. Первым этапом сплайсинга является сборка комплекса сплайсинга. Самые ранние продукты, обнаруживаемые в процессе сплайсинга in vitro, образуются в результате точного расщепления в 5’-сайте сплайсинга; один из них содержит 5’-экзон, а другой – интрон и 3’-экзон (рис. 8.83). Поскольку никакие молекулы РНК с изменениями в 3’-сайте сплайсинга, кроме конечного продукта сплайсинга, не выявлены, расщепление в 5’-сайте должно предшествовать расщеплению в 3’-сайте. В ходе реакции накапливаются два продукта: правильно лигированные экзоны и свободный целый интрон. Как продукт начального расщепления, так и вырезанный интрон содержат структуры типа лассо, аналогичные описанным выше структурам митохондриальных интронов самосплайсинга группы II (рис. 8.83). Сначала вывод о лассообразности структуры интрона был сделан на основании данных об аномальной электрофоретической подвижности вырезанного интрона, о блокировании обратной транскрипции последовательности за точкой, находящейся у 3’-конца интрона, и об устойчивости интрона к полному расщеплению под действием некоторых рибонуклеаз. Позже существование этой структуры было подтверждено при выделении разветвленных нуклеотидных структур. Точка ветвления всегда содержала 5’-фосфат концевого гуанозина интрона, присоединенного диэфирной связью к 2’-гидроксильной группе остатка аденозина, независимо от последовательности вырезанного интрона. Тем самым наконец-то получил объяснение удивительный факт существования ядерных РНК с разветвлениями, отходящими от 2’-гидроксильных групп остатков адениловой кислоты.



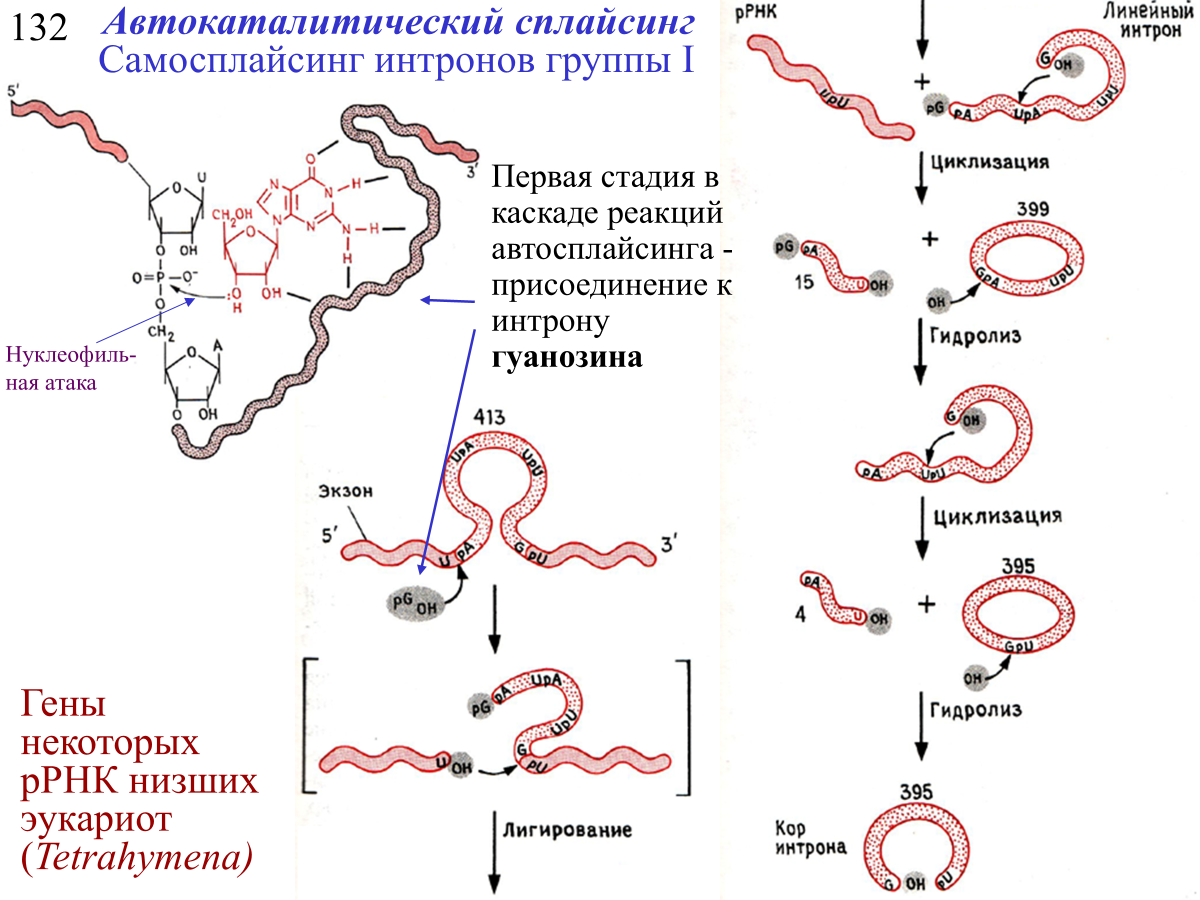
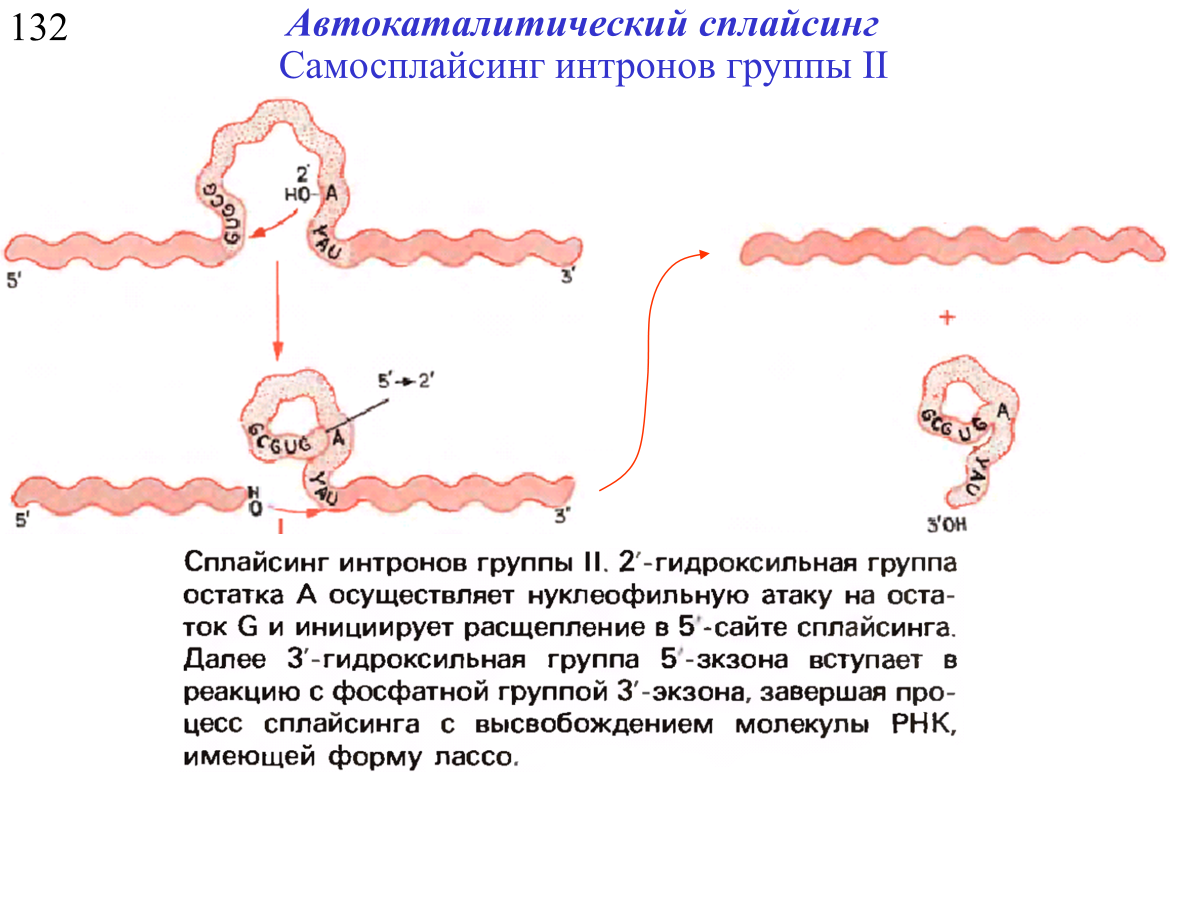
интроны, вырезаемые при помощи автокаталитического сплайсинга