
- •Лекция №1. Предмет коллоидной химии
- •Примеры дисперсных частиц
- •II. Классификация дисперсных систем по виду дисперсной фазы
- •III. Классификация по фракционному составу частиц дисперсной фазы, по однородности частиц или их разнородности все системы делятся на:
- •IV. Классификация по характеру взаимодействия частиц дисперсной фазы между собой или по подвижности част дисперсной фазы.
- •VI. Свободнодисперсные системы классифицируют по размеру частиц в дисперсных фазах
- •VII. Классификация по природе устойчивости или интенсивности межмолекулярных взаимодействий на уровне раздела фаз.
- •Лекция №3. Поверхностные явления.
- •Поверхностное натяжение
- •Правило Антонова (1907 г.)
- •Лекция №4. Капиллярные явления.
- •Вывод уравнения Лапласа:
- •Анализ уравнения Лапласа:
- •Поднятие и опускание жидкости в капиллярах.
- •Подставим (3) в (2)
- •Опускание жидкости в капиллярах:
- •Лекция №5. Продолжение
- •Вывод уравнения Кельвина
- •Правило Гиббса-Кюри –
- •Адсорбция
- •Процесс адсорбции с т.Зрения термодинамики Лекция №6. «Процесс адсорбции с т.Зрения термодинамики»
- •Количественные способы выражения адсорбции
- •Классификация адсорбционных процессов
- •2. Она специфична
- •Тогда принимает вид:
- •Анализ уравнения гиббса
- •Характеристика пав.
- •Изотерма адсорбции
- •Применение пав:
- •Классификация пав:
Вывод уравнения Кельвина
Искривление поверхности жидкости приводит к изменению её потенциала на (?) величину ΔМж

ΔМж = Мж – Мж = 2σ ж – г * Vм/r (1) ΔМж = 2σ ж – г * Vм/r (1)
Для того, чтобы в системе сохранилось сост-е равновесия химич.потенциал пара также должен измениться на величину ΔМп
При изменении ΔМп = ΔМж (2)
ΔМп = Мп-Мп (3); Мп=Мт+RTlnPr (4) – давление насыщенного пара над искривлённой поверхностью
Мп = Мт + RTlnP0 (5) – давление насыщенного пара над плоской поверхностью
(4) и (5) подставим в (3)
ΔМп = Мт + RTlnPr – Мт – RTlnP0 = RT (lnPr – lnP0) = RTln Pr/P0
Таким образом ΔМпара = RTln Pr/P0 (6)
В (2) подставляем формулы (1) и (6)
2σ ж – г * Vм/r= RTln Pr/P0 (7) – относительное давление пара, находящегося в равновесии с мениском жидкости у кот.радиус кривизны r.
Из (7) выразим величину относительного давления пара
 =2σ
ж – г * Vм/r
(RT)
(8) – уравнение Кельвина
=2σ
ж – г * Vм/r
(RT)
(8) – уравнение Кельвина
=2σ ж – г * Vм/r (RT) (9)
Если поверхность имеет неправильную форму, то уравнение Кельвина записывается в виде:
=2σ ж – г * Vм/r (RT) (1/г1+1/г2) (10)
Г1, г2 – главные радиусы кривизны поверхности, следовательно, при положительной кривизне Pr/P0>0, т.е.над каплей жидкости давление пара выше, чем над ровной поверхностью и тем выше, чем < радиус кривизны поверхности.
При отрицательной кривизне Pr/P0<0 и конденсация пара над искривлённой поверхностью в капилляре будет происходить при меньшем давлении, чем над ровной поверхностью.
Правило Гиббса-Кюри –
Устанавливает условия равновесной формы тела. Равновесной формой тела считается та, кот.соответствует минимуму поверхностной энергии Гиббса при V=const
ΔG= =min,
(1)
=min,
(1)
где
 удельная свободная поверхностная
энергии i-той
части тела
удельная свободная поверхностная
энергии i-той
части тела
Si – площадь i-той части тела
Правила Гиббса-Кюри для жидкости
Жидк.тела изотопные,
т.е.св-ва жидкости в любой т.тела
одинаковые, и, следовательно,
 =const
=const
Тогда (1) принимает
вид: ΔG= =min
(2)
=min
(2)
Условием равновесной формы жидк.тел является минимум площади поверхности вследствие чего жидкость принимает сферическую форму.
Принцип равновесной формы тела для кристалл (закон Бульора)
Тв.тела анизотропны, т.е.их св-ва в различ.т.тела не одинаковы. В этом случае минимуму энергии Гиббса равновесного кристалла отвечает условие пропорциональности свободной поверхностной энергии границ кристаллов, их расстоянием от центра кристалла.
 …
=const
…
=const
Зависимость т/д-ной реакционной способности от дисперсности. Реакционная способность в-ва определяется энергией Гиббса, которая характеризует способность в-ва перейти из 1-ой фазы в др., вступить в хим.реакцию и определить удалённость длинного состояния системы от равновесного.
Для установления зависимости т/д используют объединения уравнение 1-го и 2-го з.термодинамики.
dGр=-S*dT+V*dp (1)
Для индивидуального в-ва V=Vм, и если система находится при Т=const, то (1) принимает вид:
dGd = Vм*dp или ΔG= Vм*Δp (2)
В (2) вместо Δр представляем его выражение из уравнения Лапласа
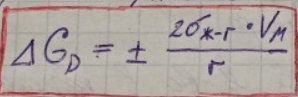 (3)
(3)
Уравнение (3) выражает зависимость т/д-ской реакцион.способности от дисперсности
D=1/2r
Чем выше дисперсность (т.е.<размер частиц), тем > энергия Гиббса и выше т/д-сная реакционная способность вещества.
Т/д-скую реакционная способность от дисперсности можно выразить для веществ через р-римость
![]()
где Ср – р-римость веществ в дисперсном состоянии
Cs – р-римость недисперсированного вещества
Зная это уравнение, можно вычислить размер частиц твёрдых веществ.
Влияние дисперсности на температуру фазового перехода
Уравнение (1) при V=const принимает вид:
![]() (5)
(5)
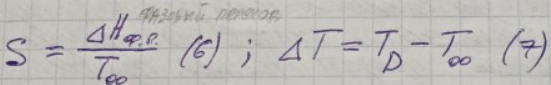

В (9) подставим ΔG из влияния дисперсности на т/д-скую реакционную способность.
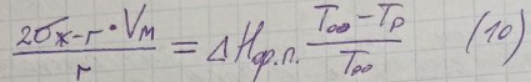
Из (10) выразим изменение температуры фазового перехода, обусловленного дисперсностью
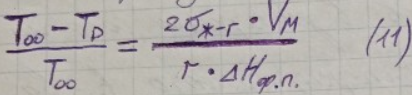
Из (11) видно, что с увеличением дисперсности в-ва температура фазового перехода уменьшается.
Вывод:
В производственных условиях с увеличением дисперсности происходит увеличением площади реакционной поверхности, что благоприятно сказывается на производительности, позволяет снизить температуру процесса и удельный расход энергии. Существует оптимальное значение дисперсности порошков, при кот.взаим-е происходит наиболее интенсивно. С целью определения оптимальной дисперсности и определяют удельную поверхность порошков.
