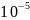- •2. Особенности адсорбции на поверхности твердого адсорбента. Уравнение Фрейндлиха, его анализ и определение констант уравнения.
- •3. Что понимается под поверхностным слоем, поверхностной энергией и поверхностными явлениями. Какие параметры относятся к количественным характеристикам дисперсности? Дайте их полную характеристику.
- •4. Представьте, что Вам необходимо сделать доклад по теме: “Суспензия”. Напишите план доклада и в соответствии с ним составьте тезисы доклада.
- •5. Что понимается под поверхностным натяжением и как оно зависит от природы веществ, образующих поверхность раздела фаз?
- •6. Что такое капиллярное давление? Каковы причины его возникновения? Вывод и анализ уравнения Лапласа.
- •8. Поверхностное натяжение: причины возникновения, его физический смысл с термодинамической и силовой точек зрения, определение и методы измерения.
- •9. Что такое агрегативная устойчивость? Факторы, обеспечивающие агрегативную устойчивость лиофобных золей.
- •10. Характеристика порошков как дисперсных систем. Какие порошки обладают более высокой текучестью – грубодисперсные или высокодисперсные? Какие порошки легче распылять гидрофильные или гидрофобные?
- •11. Влияние температуры на термодинамические параметры поверхностного слоя – Us , qs , σ, Ss. (Вывод и анализ уравнения Гиббса-Гельмгольца для поверхностного слоя).
- •12. Адгезия и когезия. Какими силами они обусловлены? Что понимается под работой адгезии и когезии? Вывод уравнений, используемых для вычисления работы адгезии (Дюпре) и работы когезии.
- •13. Что такое аэрозоли? Приведите примеры аэрозолей бытовых, атмосферных и промышленных.
- •14. Рассмотрите процесс смачивания в зависимости от соотношения работы адгезии и когезии (вывод и анализ уравнения Юнга-Дюпре).
- •15. Теория кинетики быстрой коагуляции м. Смолуховского: основные положения; вывод и анализ уравнения, представляющего кинетику изменения общего числа частиц в процессе коагуляции? (Схож с 74)
- •16. Каковы условия поднятия жидкостей в капиллярах? Какова роль этого явления в природе и технике?
- •19. Рассмотрите возможные механизмы возникновения двойного электрического слоя (дэс) на границе раздела твердое тело – раствор.
- •21. В чем заключается инверсия смачивания? Какое практическое значение имеет это явление?
- •22. Какие величины используют для количественного описания адсорбции? Дайте определение этих величин и покажите, как их можно вычислить в общем виде.
- •23. Почему в случае смачивания капилляра жидкость в нем поднимается, а при несмачивании, наоборот, опускается?
- •25. Какие поверхностные явления сопровождают технологические процессы? Перечислите и дайте их краткую характеристику.
- •26. Теория мономолекулярной адсорбции Ленгмюра: основные положения теории, вывод уравнения изотермы адсорбции и ее анализ.
- •29. Смачивание: покажите взаимосвязь между адгезией и способностью жидкости смачивать твердую поверхность. В чем состоит различие между явлениями адгезии и смачивания?
- •30. Чем объяснить, что концентрация кислорода в воздухе земной атмосферы уменьшается в два раза при удалении от поверхности Земли на 5 км, а суспензии гуммигута на высоте 30 мкм?
- •31. По каким признакам классифицируют дисперсные системы? Привести их классификацию по всем классификационным признакам.
- •32. В чем заключается сущность ионообменной адсорбции? Какое состояние называется ионообменным равновесием? Какая величина его характеризует?
- •33. Что такое расклинивающее давление и каковы причины его возникновения? Назовите составляющие расклинивающего давления и охарактеризуйте их.
- •34. Адсорбция на границе раздела раствор – газ (воздух). Вывод и анализ уравнения адсорбции Гиббса для разбавленных растворов бинарной системы.
- •35. Зависимость термодинамической реакционной способности от дисперсности.
- •37. Кинетическая устойчивость. Связь между кинетической устойчивостью и гипсометрическим законом.
- •38. Как, используя уравнение Шишковского, можно определить константы уравнения Ленгмюра (к и а).
- •40. Свойства поверхностей жидких и твердых тел. Каковы особенности адсорбции пав из растворов на поверхности твердого тела?
- •41. Дайте сравнительную характеристику мономолекулярной и полимолекулярной адсорбции. Приведите основные типы изотерм для полимолекулярной адсорбции.
- •42. Дайте характеристику двойного электрического слоя на границе раздела фаз твердое тело – раствор. Как изменяется потенциал в этом слое с расстоянием от поверхности твердой фазы?
- •43. Что понимается под термином “разрушение дисперсной системы”, какая устойчивость при этом теряется? Правила электролитной коагуляции лиофобных золей.
- •44. Капиллярные явления. Поднятия и опускания жидкости в капиллярах: уравнение Жюрена, его вывод и анализ.
- •46. Поверхностная энергия и равновесная форма тела: правило Гиббса-Кюри для твердых и жидких тел.
- •47. Электрокинетические явления 1-го рода, история их открытия и практическое приложение. Как по скорости электрофореза и электроосмоса можно вычислить электрокинетический потенциал?
- •48. Как объяснить зависимость, установленную правилом Дюкло-Траубе?
- •50. Дайте полную характеристику дисперсной системы. Классификационная характеристика этих систем по агрегатному состоянию дисперсной фазы и дисперсионной среды, по виду дисперсной фазы.
- •51. Представьте, что Вам необходимо сделать доклад по теме “Эмульсии”. Напишите план доклада и составьте к нему тезисы.
- •55. Каковы возможные механизмы образования на поверхности раздела фаз двойного электрического слоя.
- •57. Составьте задачу, для решения которой нужно использовать правило Панета-Фаянса.
- •58. Чем обусловлено светорассеяние в дисперсных системах и истинных растворах? Какими параметрами характеризуют рассеяние света в системе?
- •59. Электрокинетические явления 2-го рода: история их открытия, характеристика и практическое приложение.
- •61. Какова взаимосвязь давления насыщенного пара с кривизной поверхности: вывод и анализ уравнения Томсона-Кельвина.
- •63. Каков физический смысл термина “поверхностная активность”? к каким веществам применяется этот термин? Дайте их характеристику и приведите полную классификацию по всем классификационным признакам.
- •64. Дайте характеристику коллоидных растворов (золей) по всем классификационным признакам. Чем они отличаются от суспензий. Приведите примеры таких систем.
- •65. Что представляет собой релаксационный эффект, электрофоретическое торможение и поверхностная проводимость? Как их нужно учитывать при определении величины -потенциала?
- •70. Какая связь существует между уравнениями Гиббса и Ленгмюра? Напишите уравнение, выражающее эту взаимосвязь, и поясните физико-химический смысл входящих в него величин.
- •72. Что представляют собой потенциальные кривые взаимодействия между коллоидными частицами? Как на их основе объясняют явление коагуляции?
- •75. Что понимается под работой адсорбции? Как, используя это понятие, можно объяснить связь поверхностной активности пав с длиной углеводородного радикала в молекуле пав (правило Дюкло-Траубе).
1. Даны следующие суспензии: томатная паста, зубная паста, кофейный напиток и шоколадный напиток. Какие из перечисленных суспензий будут относиться к свободнодисперсным, а какие к связнодисперсным системам? Чем они отличаются между собой?
Томатная паста и зубная паста - связнодисперсные системы.
Кофейный напиток, шоколадный напиток - свободнодисперсные системы.
Связнодисперсные системы: в этих системах частицы дисперсной фазы могут взаимодействовать за счет межмолекулярных сил, образуя в объеме системы пространственную сетку, называемую каркасом(структурированная система), расстояние между частицами меньше их размеров. Они не могут свободно перемещаться в среде и совершать колебательные движения. По своим свойствам они близки к твердым телам, но их нельзя смешивать с дисперсными системами, в которых частицы не могут перемещаться из-за высокой вязкости среды. Концентрация частиц дисперсной фазы, при которой в системе начинается процесс структурообразования получил название концентрация перколяции.
Связнодисперсные системы классифицируют по размеру пор. Они делятся на микропористые(до 2нм), мезопористые(2-50нм) и макропористые(более 50нм). По размеру пор эти системы могут быть однородные или разнородные, по жесткости структуры - жесткие и набухающие.
Свободнодисперсные системы:это бесструктурные системы, между частицами дисперсной фазы отсутствует взаимодействие, т.к. они значительно отдалены друг от друга. Для них характерно то, что расстояние между частицами гораздо больше их радиуса. Частицы дисперсной фазы свободно перемещаются в дисперсионной среде в результате Броуновского движения или под действием силы тяжести. По своим молекулярно-кинетическим свойствам эти системы подобны истинным растворам. Они обладают текучестью. К ним относят все разбавленные дисперсные системы(золи, суспензии, пены, аэрозоли)
Свободнодисперсные системы классифицируют по размеру частиц дисперсной фазы.
Класс системы |
Размер частиц |
Дисперсность,
|
Пример системы |
|
мкм |
м |
|||
Молекулярные |
0,001 |
менее
|
- |
Истинные растворы |
Высокодисперсные (ультрамикрогетерогенные) |
0,001-0,1 |
|
|
истинно-коллоидные растворы, золи |
Микрогетерогенные (среднедисперсные) |
0,1-10,0 |
|
|
Эмульсии, суспензии, пены, аэрозоли, порошки |
Грубодисперсные |
более 10 |
более
|
менее |
Почва, грунт, порошки |
2. Особенности адсорбции на поверхности твердого адсорбента. Уравнение Фрейндлиха, его анализ и определение констант уравнения.
Адсорбция - самопроизвольное изменение концентрации компонента в поверхностном слое по сравнению с объемной фазой адсорбента. [моль/м^2, моль/кг]. Твердое тело, на поверхности которого происходит адсорбция - адсорбент, адсорбирующееся вещество - адсорбат, поглощаемое вещество, находящееся в объеме фазы - адсорбтив.
Адсорбция может быть:
На границе двух несмешивающихся жидкостей.
На границе раствор-газ.
На границе твердое тело-газ.
На границе твёрдое тело-раствор.
Ионообменная адсорбция из растворов сильных электролитов.
Молекулярная адсорбция из растворов неэлектролитов или слабых электролитов.
Межфазное взаимодействие твердой поверхности и чистой жидкой называется автоадсорбцией. Она приводит к изменению плотностей жидкости в граничных слоях, могут изменяться также вязкость, энтальпия, энтропия, температура замерзания и тд. Чем полярнее жидкость, тем сильнее изменяется ее структура в граничных слоях по сравнению с объемной фазой.
Явления адсорбции из растворов классифицируют по типу адсорбата(молекулярная или ионообменная).
При рассмотрении процесса адсорбции из растворов следует учитывать:
Силовое поле твердой фазы
Межмолекулярные взаимодействия в жидкой фазе
Наличие конкуренции за места в поверхностном слое между молекулами растворителя и растворенного вещества
Адсорбция органических веществ одного и того же гомологического ряда подчиняется правилу Траубе(с увеличением длины углеводородного радикала адсорбционная способность возрастает.
На пористых адсорбентах наблюдается обращение правила Траубе(крупные молекулы не могут попасть в узкие поры)
Процесс
адсорбции ПАВ из растворов происходит
в соответствии с правилом уравнивания
полярностей Ребиндера( процесс адсорбции
идет в сторону выравнивания полярностей
контактирующих фаз, и тем сильнее, чем
больше первоначальная разность
полярностей.
Мономолекулярная адсорбция - адсорбция толщиной адсорбционного слоя в одну молекулу. На поверхности адсорбента только один адсорбционный слой. (см. вопрос 26 теорию Ленгмюра, на ней основывается уравнение Фрейндлиха).
Одно
из основных положений теории Ленгмюра
-эквипотенциальность поверхности
твердого тела, но реальные твердые тела
не обладают таким свойством. Поэтому
пришлось ввести понятие об активных
центрах поверхности(неоднородности и
неэквипотенциальности) поверхности.
Для приближения к реальным условиям
нужно учитывать распределение
адсорбционных центров поверхности
адсорбента по энергиям. Модели
экспоненциального распределения
неоднородностей поверхности для средних
заполнений соответствует уравнение
Фрейндлиха:
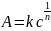 ,
1/n -константа, характеризующая степень
приближения изотермы адсорбции к прямой.
Или
,
1/n -константа, характеризующая степень
приближения изотермы адсорбции к прямой.
Или
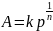
Величина 1/n позволяет судить о пределе насыщения поверхности - чем быстрее достигается предел насыщения,т.е. чем выше адсорбционная способность адсорбата, тем меньше значение 1/n. Эта постоянная характеризует взаимодействие адсорбата с адсорбентом. Она сравнительно мало меняется для различных адсорбатов и адсорбентов, обычно колеблется в пределах 0,2-1.0 при адсорбции газов и 0.1-0.5 при адсорбции из растворов.
Константа
k, характеризующая адсорбционную
способность вещества: с увеличение
адсорбционной способности вещества
она возрастает. По физическому смыслу
константа k представляет собой значение
адсорбции при равновесной концентрации
адсорбата 1М, т.е. характеризует ёмкость
адсорбента. Значение k зависит от природы
вещества и возрастает с увеличение
длины углеводородного радикала ПАВ,
т.к. при этом возрастает адсорбционная
способность вещества. Уравнение
Фрейндлиха описывает физическую
адсорбцию, которая уменьшается с ростом
температуры, поэтому при повышении
температуры k уменьшается, а 1/n -
увеличивается.

При малых концентрациях количество адсорбированного вещества прямо пропорционально равновесной концентрации в растворе(участок 1). Он может быть описан с помощью изотермы Фрейндлиха только в том случае, если постоянная 1/n=1. Горизонтальный участок изотермы(участок 3), отвечающий высоким концентрациям, может быть получен при 1/n=0, но 1/n - это постоянная величина. Таким образом уравнение Фрейндлиха применимо только в области средних концентраций или давлений(участок 2).
Это уравнение дает хорошие результаты при исследовании адсорбции разбавленных растворов недиссоциированных или слабо диссоциированных веществ в различных растворителях(вода, спирты, эфиры, бензол) на различных адсорбентах.
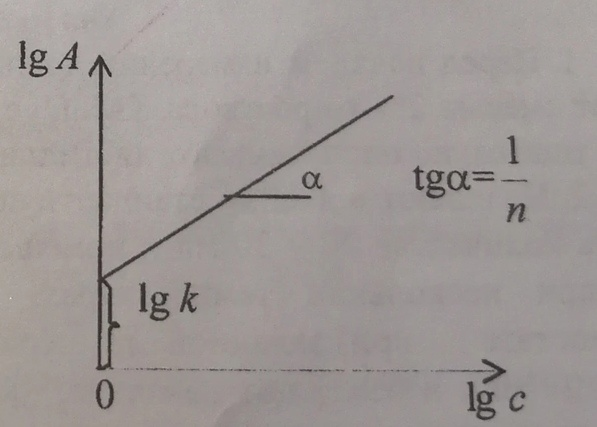
Константы
1/n и k находят путем логарифмирования
уравнений Фрейндлиха:
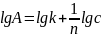 с последующим построением графика
зависимости lgA=f(lgc).
с последующим построением графика
зависимости lgA=f(lgc).

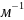
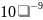
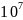 -
-
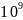
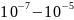
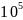 -
-