
- •Лекция №1. Предмет коллоидной химии
- •Примеры дисперсных частиц
- •II. Классификация дисперсных систем по виду дисперсной фазы
- •III. Классификация по фракционному составу частиц дисперсной фазы, по однородности частиц или их разнородности все системы делятся на:
- •IV. Классификация по характеру взаимодействия частиц дисперсной фазы между собой или по подвижности част дисперсной фазы.
- •VI. Свободнодисперсные системы классифицируют по размеру частиц в дисперсных фазах
- •VII. Классификация по природе устойчивости или интенсивности межмолекулярных взаимодействий на уровне раздела фаз.
- •Лекция №3. Поверхностные явления.
- •Поверхностное натяжение
- •Правило Антонова (1907 г.)
- •Лекция №4. Капиллярные явления.
- •Вывод уравнения Лапласа:
- •Анализ уравнения Лапласа:
- •Поднятие и опускание жидкости в капиллярах.
- •Подставим (3) в (2)
- •Опускание жидкости в капиллярах:
- •Лекция №5. Продолжение
- •Вывод уравнения Кельвина
- •Правило Гиббса-Кюри –
- •Адсорбция
- •Процесс адсорбции с т.Зрения термодинамики Лекция №6. «Процесс адсорбции с т.Зрения термодинамики»
- •Количественные способы выражения адсорбции
- •Классификация адсорбционных процессов
- •2. Она специфична
- •Тогда принимает вид:
- •Анализ уравнения гиббса
- •Характеристика пав.
- •Изотерма адсорбции
- •Применение пав:
- •Классификация пав:
IV. Классификация по характеру взаимодействия частиц дисперсной фазы между собой или по подвижности част дисперсной фазы.
По этому признаку все системы делятся на: свободно – и связнодисперсные.
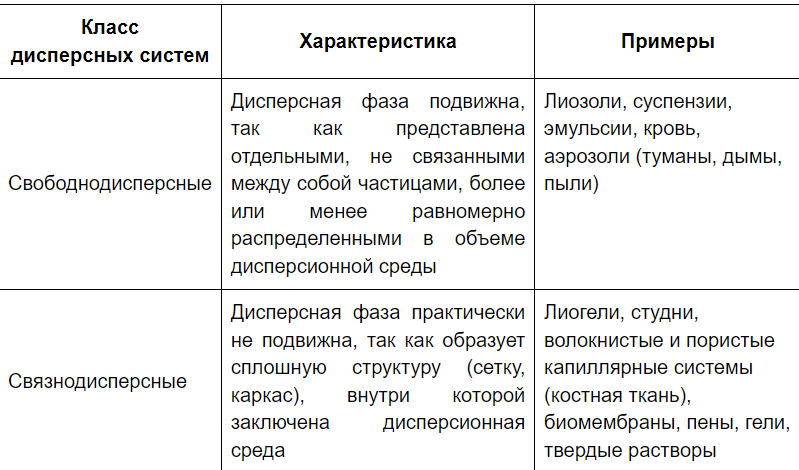
V. Связнодисперсные системы классифицируют по размеру пор. Они делятся на: микропористые (с размером до 2-х нанометров); мезопористые (переходно-пористые) (поры от 2 до 50 (или 20) нм); макропористые (размеры пор более 50 (20) нм)
По размеру пор эти системы могут быть однородными и разнородными. По жёсткости структуры могут быть жёсткие или набухающие.
VI. Свободнодисперсные системы классифицируют по размеру частиц в дисперсных фазах
Классификация системы |
Размер частицы дисперсной фазы |
Дисперсная м^-1 |
Пример системы |
|
мкм |
м |
|
||
Молекулярная степень дисперсности |
Менее 0,01 |
Менее 10^9 |
- |
Истинные растворы |
Высокодисперсная |
0,001-0,1 |
10^-9 – 10^-7 |
10^7-10^9 |
Истинно-коллоидные растворы (золи) |
Микрогетерогенные |
0,1-10,0 |
10^-7 – 10^-5 |
10^5-10^7 |
Эмульсии, суспензии, пены, аэрозоли, порошки |
Грубодисперсные |
Более 10,0 |
Более 10^-5 |
Менее 10^5 |
Почва, грунт, порошки, пыль |
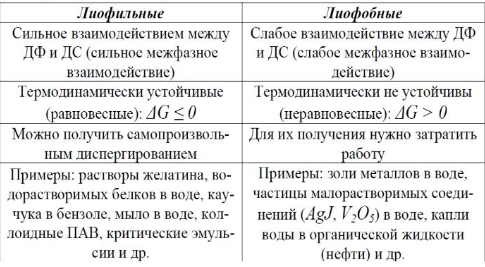
VII. Классификация по природе устойчивости или интенсивности межмолекулярных взаимодействий на уровне раздела фаз.
По этому признаку все системы делятся на лиофальные и лиофобные.
Курс начинается с изучения поверхностных явлений. Так как они могут рассматривать независимо от величины дисперсности, а затем изуч-ся св-ва дисп.систем, так как для их изучения необходимы знания о поверхностных явлениях.
Лекция №3. Поверхностные явления.
Они протекают на жидк.и тв.межфазных поверхностях и выражают особые свойства поверхностных слоёв, т.е. тонких слоёв в-ва у поверхности соприкосновения 2-х фаз.
Причиной возникновения поверхностных явлений является наличие избыточной поверхностной эмульсии в поверхностном слое, особенностями его структуры и составом.
Поверхностный слой
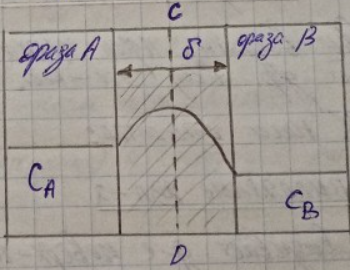
Рассмотрим плоскую поверхность раздела однокомпонентной системы, состоящей из 2-х фаз. Одна из них фаза А – индивидуальная жидкость – фаза В – насыщенный пар этой жидкости.
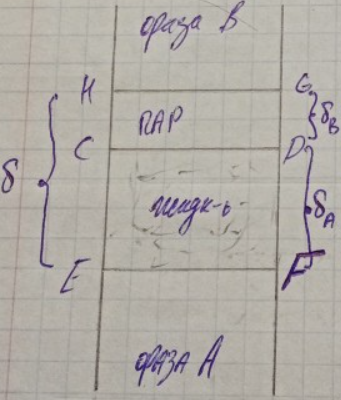 Тонкий
слой HEFG
в непосредственной близости от разделяющей
фазы поверхности CD
состоит из 2-х слоёв малой толщины. Один
из них – слой малой толщины, CEFD
– поверхностный слой жидкой фазы,
имеющий толщину
Тонкий
слой HEFG
в непосредственной близости от разделяющей
фазы поверхности CD
состоит из 2-х слоёв малой толщины. Один
из них – слой малой толщины, CEFD
– поверхностный слой жидкой фазы,
имеющий толщину
 .
.
Другой слой (CDGH) – поверхностный слой пара с толщиной δв
Слой HEFG,
толщина которого
 ,
равна
,
равна
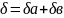 ,
называется поверхностным
слоем.
,
называется поверхностным
слоем.
Поверхностный слой имеет конечную толщину.
Величина называется эффективной толщиной поверхностного слоя.
В случае конденсирования систем поверхностный слой называется межфазным слоем.
Поверхностный слой существует при температурах, отличных от критической температуры.
Если T
– Tкр,
то
-
 система становится однофазной и
поверхностный слой отсутствует.
система становится однофазной и
поверхностный слой отсутствует.
С точки зрения т/д-ки по Гиббсу поверхностный слой следует рассматривать как конечный по толщине слой близ поверхностного соприкосновения фаз, где состав и т/д св-ва отличны от состава внутри объёмов соприкосновения фаз.
Понятие поверхности в геометрии и в КХ различны. В геометрии поверхность – общая часть 2-х смежных областей пространства, она не имеет толщины и характеризуется только площадью.
В КХ – это огранич.область меж 2-мя фазами, имеющая конечную толщину и площадь поверхности, в которой происходит изм-е св-в хар-рных для 1-ой фазы до знач-й, присущих св-вам др.фазы.
Поверхностная энтальпия – избыток эн-ии в-ва в тонком слое HEFG по сравнению с эн-ей этого вещества в объёмной фазе.
Поверхностная энтальпия выражается если система находится при P и T=const через энтальпию Гиббса.
Если система находится при V и T=const – через эн-ю Гельмгольца.
Если Gs (ΔGs) >0 – поверхностный слой существует
Если Gs (ΔGs) <0 – не существует
Gs= δ*S
где δ – удельная свободная поверхностная энтальпия; S – площадь поверхностного слоя, Дж.
Явление, возникающее в поверхностном слое и обусловл.наличие в нём избыточ.эн-ии получили название поверхностного явления.
Они возникают при переходе поверхностной энергии в любой другой вид энергии.
К ним относятся:
1) Капиллярные явл-я

Их вызывает д-е поверхностного натяжения и искривления жидких поверхностей. Gs V*dp (механическая энтальпия)
2) Адгезия, кагезия, смачивание, трение.
Они обусл.переходы
поверхностной энергии в теплоту Gs![]() S*dT
S*dT
Эти явления выраж.и опред.свойства поверхности контакта 2-х фаз:
тв.т. – жидкость ж1-ж2
тв.т. – тв.т
3) Адсорбция
Характеризует свойство поверхности с нанесёнными на неё мономолекулярными или полимолекулярными слоями.
Она возникает при переходе поверхностной энергии в хим.эн-ю
Gs Midni
4) Электрокинетические явления
Gs
 *dq
*dq
В зависимости от причин, вызывающих эти явления, они делятся на 2 группы:
1) явления, обусловленные д-ем на сист.внеш.разности потенциалов. К ним относят электрофорез и электроосмос.
2) явления, обусловленные относительным перемещением фаз. Потенциал течения (протекания) и потенциал оседания (седиментации).
5) Электрокапиллярные явления
Они обусл.наличием в поверхностном слое электрических зарядов.
При изучения т/д-ки поверхностных явлений используют 2 метода:
Метод избыточных величин Гиббса
Согласно этому методу, энтальпия Гиббса всей системы складывается из энергии Гиббса одной фазы + энергия Гиббса другой фазы + поверхностная энергия.
G системы = G (1 фазы) + G (2 фазы) + Gs = G1+G2+ δ*S
Метод слоя конечной толщины
Энергия Гиббса сист. = энергия Гиббса 1 фазы + энергия Гиббса 2 фазы + поверхностная энергия + энергия объёма поверхностного слоя
G системы = G (1 фазы) + G (2 фазы) + δ*S + G^v
При изучении поверхностной энергии будет использован метод избыточных величин Гиббса.

Поверхностный слой может возникать на сл.границах раздела фаз:
тв.т – тв.т.
тв.т. – жидкость неподвижные поверхности

тв.т – газ
ж1 – ж2
подвижные поверхности
г1 – г2
Т/д св-ва поверхностного слоя.
К ним относятся:
Внутр. (полная) поверхностная энергия Us
Поверхностное натяжение σ
Энтропия поверхностного слоя Ss
Теплота образования площади поверхности qs
