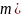- •1. Титриметрический метод анализа. Сущность метода. Классификация титриметрических методов анализа.
- •2. Международная система единиц (си). Основные физические величины и формулы для расчёта, применяемые в количественном анализе.
- •3. Способы титрования. Расчёты в титриметрическом методе по результатам титрования.
- •5 . Буферные растворы. Расчет рН буферных растворов.
- •6. Понятие гидролиза. Расчёт рН гидролизующихся солей.
- •Расчёт рН гидролизующихся солей (?):
- •7. Сущность метода кислотно-основного титрования. Рабочие растворы. Приготовление и стандартизация рабочих растворов.
- •3. Титрование слабого основания сильной кислотой
- •Выводы по кривым нейтрализации
- •9. Индикаторы (понятие). Требования, предъявляемые к индикаторам. Кислотно-основные индикаторы.
- •10. Интервал перехода окраски кислотно-основных индикаторов. Выбор индикатора.
- •11. Сущность методов комплексообразовательного титрования. Комплексонометрия.
- •12. Понятие о комплексонах. Механизм взаимодействия комплексона с ионами металлов.
- •14. Механизм действия металлохромных индикаторов (на примере эриохромчёрного т).
- •15. Расчёт кривых комплексонометрического титрования. Выбор индикатора.
- •16. Способы титрования, применяемые в комплексонометрии.
- •17. Повышение селективности комплексонометрических определений. (из тетради)
- •18. Оксидиметрия. Сущность метода. Окислительно-восстановительные потенциалы и направление реакции.
- •19. Индикаторы, применяемые в окислительно-восстановительном титровании. Выбор индикатора. (тетрадь)
- •20. Расчёт кривых окислительно-восстановительного титрования.
- •21. Перманганатометрия. Сущность метода. Рабочие растворы. (смотри тетрадь и лабу 3)
- •22. Перманганатометрическое определение восстановителей и окислителей.
- •23. Перманганатометрическое определение веществ, не обладающих окислительно-восстановительными свойствами.
- •24. Перманганатометрическое определение органических соединений.
- •25. Йодометрия. Сущность метода. Рабочие растворы. Способы фиксирования точки эквивалентности.
- •26. Йодометрическое определение окислителей и восстановителей. (см. Лабу 4)
- •Определение восстановителей
- •27. Йодометрическое определение веществ, не проявляющих окислительно-восстановительных свойств.
- •28. Йодометрическое определение органических веществ.
- •29. Особенности и области применения инструментальных методов анализа.
- •30. Сущность потенциометрических методов анализа.
- •31. Электроды сравнения. Устройство и уравнение потенциала для хлоридсеребряного электрода. (лаба 5)
- •32. Металлические индикаторные электроды.
- •33. Электроды с жесткой матрицей, с кристаллической мембраной.
- •34. Прямая потенциометрия. Общая характеристика метода. Приемы, используемые в прямой потенциометрии для определения концентрации вещества. (лаба 5)
- •35. Определение точки эквивалентности в потенциометрическом титровании.
- •36. Сущность кулонометрии; вывод уравнения для объединенного закона Фарадея, условия проведения прямой и косвенной кулонометрии.
- •37. Достоинства кулонометрического титрования перед другими титриметрическими методами.
- •39. Прямая потенциостатическая кулонометрия (применение, схема установки, теоретические основы).
- •40. Косвенная амперостатическая кулонометрия. Схема установки. Сущность метода.
- •Для тех, кто на «отлично»:
- •41. Спектроскопические методы анализа. Электромагнитное излучение и его взаимодействие с веществом.
- •42. Спектроскопические методы анализа. Электромагнитный спектр.
- •44. Молекулярно-абсорбционная спектроскопия. Основные узлы приборов для молекулярно-абсорбционных методов анализа.
- •45. Явление фотоэффекта. Основные законы Столетова.
- •48. Атомно-абсорбционная спектроскопия. Основные положения метода.
- •49. Схема атомно-абсорбционного спектрофотометра. Основные узлы.
- •50. Атомно-эмиссионная спектроскопия (пламенная эмиссионная спектроскопия). Основные положения метода.
19. Индикаторы, применяемые в окислительно-восстановительном титровании. Выбор индикатора. (тетрадь)
1) Безиндикаторное титрование. Возможно при окислении перманганатом в кислой среде. Когда весь восстановитель будет оттитрован одна лишняя капля KMnO4 окрасит р-р в розовый цвет.
Титровать без индикатора можно р-ром йода различные восстановители. Одна лишняя капля окрасит р-р в невидимый (?) цвет.
Безиндикаторное титрование затруднено если титруемый р-р окрашен и в нем трудно заметить окраску перманганата или йода.
2) Специфические индикаторы – индикаторы, которые вступают в специфическую реакцию с ок-телем или вос-телем, например крахмал в йодометрии и роданид калия/аммония при титровани железа в титанометрии.
3) Истинные окислительно-восстановительные индикаторы – органич. соединения, у кот. окисленная и восстановленнвя формы имеют различную окраску и изменяют свой цвет в зависимости от ОВ потенциала титруемой системы. При избытке ок-теля образуется окисленная форма индикатора, восстановителя – восстановленная форма.
Интервал перехода
окраски:
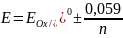
Подбирают такие индикаторы так, чтобы интервал перехода их окраски попадал в скачок титрования.
20. Расчёт кривых окислительно-восстановительного титрования.
https://studfile.net/preview/2608841/ + Смотри лабы, где строили графики (как минимум первые 2) + вопрос 8
21. Перманганатометрия. Сущность метода. Рабочие растворы. (смотри тетрадь и лабу 3)
Оксидиметрический метод анализа, в котором в качестве рабочего используют раствор перманганата калия, называют перманганатометрией.
В основе
метода лежит
реакция окисления раствором KMnO4:
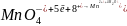
Из реакции видно,
что среда сильно кислая и так как в
реакции участвует 5 электронов, число
эквивалентов для
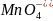 и
и
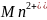 равно 5.
равно 5.
При окислении в нейтральной или щелочной среде Mn7+ восстанавливается до Mn4+ и образуется MnO2 - тёмно-бурый осадок, который загрязняет раствор и затрудняет определение конца реакции.
Кроме того,
стандартный потенциал пары
/
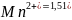 В
(в сильно кислом растворе ещё больше),
а у пары
/
В
(в сильно кислом растворе ещё больше),
а у пары
/
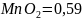 В.
Следовательно, окислительная способность
перманганата в кислой среде значительно
больше, чем в щелочной.
В.
Следовательно, окислительная способность
перманганата в кислой среде значительно
больше, чем в щелочной.
При титровании в сильно кислых средах чаще всего используют серную кислоту. Соляную и азотную применять не следует, так как в их присутствии могут идти конкурирующие окислительно-восстановительные реакции.
Конец титрования в перманганатометрии определяют без индикатора, т. к. обесцвечивавщийся до точки эквивалентности MnO4 - за счёт образования Mn2+, в точке эквивалентности окрашивает раствор в розовый цвет.
22. Перманганатометрическое определение восстановителей и окислителей.
Смотри лабу 3
23. Перманганатометрическое определение веществ, не обладающих окислительно-восстановительными свойствами.
К ним относятся ионы Ca2+, Zn2+, Cd2+, Ni2+, Co2+ и поэтому их определяют способом титрования заместителя. Для этого определяемый ион переводят в соединение, обладающее восстановительными или окислительными свойствами, а затем проводят окислительно-восстановительное титрование.
Например, ионы
Са2+
сначала осаждают оксалатом аммония:
 .
.
Полученный осадок
оксалата кальция отфильтровывают,
промывают и растворяют в серной кислоте:
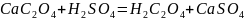 .
.
При растворении
выделяется щавелевая кислота в количестве
эквивалентном кальцию, которую затем
оттитровывают перманганатом калия в
присутствии серной кислоты:
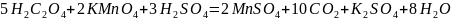 .
n(1/2
.
n(1/2
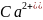 )
= n(1/2
)
= n(1/2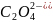 )
= n(1/5
)
= n(1/5
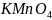 )
)
Содержание
в (г) вычисляют по формуле: