
- •1. Титриметрический метод анализа. Сущность метода. Классификация титриметрических методов анализа.
- •2. Международная система единиц (си). Основные физические величины и формулы для расчёта, применяемые в количественном анализе.
- •3. Способы титрования. Расчёты в титриметрическом методе по результатам титрования.
- •5 . Буферные растворы. Расчет рН буферных растворов.
- •6. Понятие гидролиза. Расчёт рН гидролизующихся солей.
- •Расчёт рН гидролизующихся солей (?):
- •7. Сущность метода кислотно-основного титрования. Рабочие растворы. Приготовление и стандартизация рабочих растворов.
- •3. Титрование слабого основания сильной кислотой
- •Выводы по кривым нейтрализации
- •9. Индикаторы (понятие). Требования, предъявляемые к индикаторам. Кислотно-основные индикаторы.
- •10. Интервал перехода окраски кислотно-основных индикаторов. Выбор индикатора.
- •11. Сущность методов комплексообразовательного титрования. Комплексонометрия.
- •12. Понятие о комплексонах. Механизм взаимодействия комплексона с ионами металлов.
- •14. Механизм действия металлохромных индикаторов (на примере эриохромчёрного т).
- •15. Расчёт кривых комплексонометрического титрования. Выбор индикатора.
- •16. Способы титрования, применяемые в комплексонометрии.
- •17. Повышение селективности комплексонометрических определений. (из тетради)
- •18. Оксидиметрия. Сущность метода. Окислительно-восстановительные потенциалы и направление реакции.
- •19. Индикаторы, применяемые в окислительно-восстановительном титровании. Выбор индикатора. (тетрадь)
- •20. Расчёт кривых окислительно-восстановительного титрования.
- •21. Перманганатометрия. Сущность метода. Рабочие растворы. (смотри тетрадь и лабу 3)
- •22. Перманганатометрическое определение восстановителей и окислителей.
- •23. Перманганатометрическое определение веществ, не обладающих окислительно-восстановительными свойствами.
- •24. Перманганатометрическое определение органических соединений.
- •25. Йодометрия. Сущность метода. Рабочие растворы. Способы фиксирования точки эквивалентности.
- •26. Йодометрическое определение окислителей и восстановителей. (см. Лабу 4)
- •Определение восстановителей
- •27. Йодометрическое определение веществ, не проявляющих окислительно-восстановительных свойств.
- •28. Йодометрическое определение органических веществ.
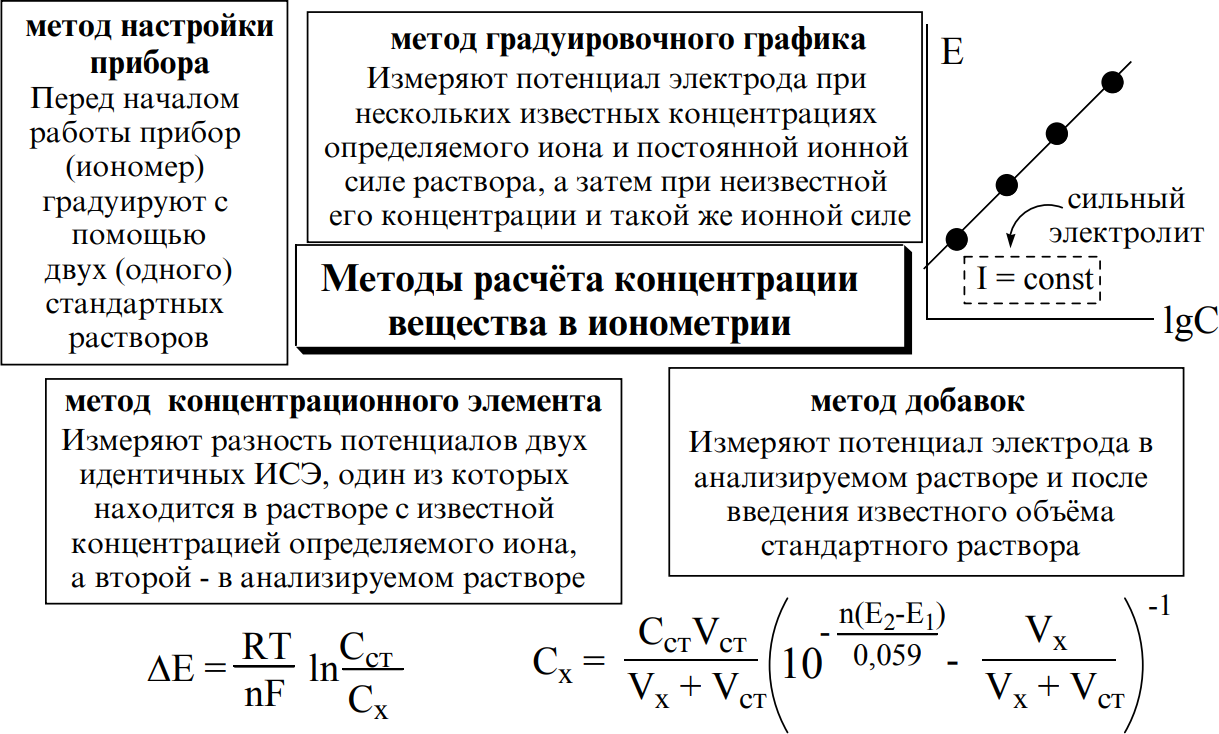
- •29. Особенности и области применения инструментальных методов анализа.
- •30. Сущность потенциометрических методов анализа.
- •31. Электроды сравнения. Устройство и уравнение потенциала для хлоридсеребряного электрода. (лаба 5)
- •32. Металлические индикаторные электроды.
- •33. Электроды с жесткой матрицей, с кристаллической мембраной.
- •34. Прямая потенциометрия. Общая характеристика метода. Приемы, используемые в прямой потенциометрии для определения концентрации вещества. (лаба 5)
- •35. Определение точки эквивалентности в потенциометрическом титровании.
- •36. Сущность кулонометрии; вывод уравнения для объединенного закона Фарадея, условия проведения прямой и косвенной кулонометрии.
- •37. Достоинства кулонометрического титрования перед другими титриметрическими методами.
- •39. Прямая потенциостатическая кулонометрия (применение, схема установки, теоретические основы).
- •40. Косвенная амперостатическая кулонометрия. Схема установки. Сущность метода.
- •Для тех, кто на «отлично»:
- •41. Спектроскопические методы анализа. Электромагнитное излучение и его взаимодействие с веществом.
- •42. Спектроскопические методы анализа. Электромагнитный спектр.
- •44. Молекулярно-абсорбционная спектроскопия. Основные узлы приборов для молекулярно-абсорбционных методов анализа.
- •45. Явление фотоэффекта. Основные законы Столетова.
- •48. Атомно-абсорбционная спектроскопия. Основные положения метода.
- •49. Схема атомно-абсорбционного спектрофотометра. Основные узлы.
- •50. Атомно-эмиссионная спектроскопия (пламенная эмиссионная спектроскопия). Основные положения метода.
33. Электроды с жесткой матрицей, с кристаллической мембраной.
По типу мембраны ионоселективные электроды подразделяют на следующие типы:
1) Электроды с кристаллическими мембранами — мембраны представляют собой монокристаллы или поликристаллы солей, труднорастворимых в воде. В таких мембранах, как правило, один из двух составляющих соль ионов может под действием электрического поля перемещаться в кристаллической решетке (галогенсеребряные, сульфидсеребряные, лантанфторидные электроды, электроды на основе сульфидов или халькогенидов).
2) Электроды с жесткой матрицей — к этому типу электродов относится стеклянный электрод, широко используемый при определении pH растворов. Применяемое для его изготовления стекло имеет определенный химический состав и обладает специальными физическими свойствами.
34. Прямая потенциометрия. Общая характеристика метода. Приемы, используемые в прямой потенциометрии для определения концентрации вещества. (лаба 5)
В прямой потенциометрии
концентрацию (активность) определяемого
вещества рассчитывают, исходя из величины
ЭДС гальванического элемента. Чаще
всего индикаторным в прямой потенциометрии
является ионоселективный электрод.
Прямые потенциометрические измерения,
в которых используется ионоселективный
электрод, называются ионометрией.
Данный метод анализа характеризуется
простотой и экспрессностью методик,
недорогой аппаратурой

35. Определение точки эквивалентности в потенциометрическом титровании.
Потенциометрическое титрование – метод анализа, основанный на регистрации изменения потенциала индикаторного электрода в процессе химической реакции между определяемым веществом и титрантом.
В основе потенциометрического титрования могут лежать различные протолитические, окислительно-восстановительные, осадительные реакции и реакции комплексообразования, протекающие количественно, стехиометрично и с приемлемой скоростью. Выбор индикаторного электрода для выполнения потенциометрического титрования зависит от используемой реакции.
Например, при кислотноосновном титровании обычно используют стеклянный рНчувствительный электрод, при окислительно-восстановительном может быть использован инертный платиновый электрод, при комплексонометрическом – электрод, чувствительный по отношению к ионам определяемого металла и т.д.
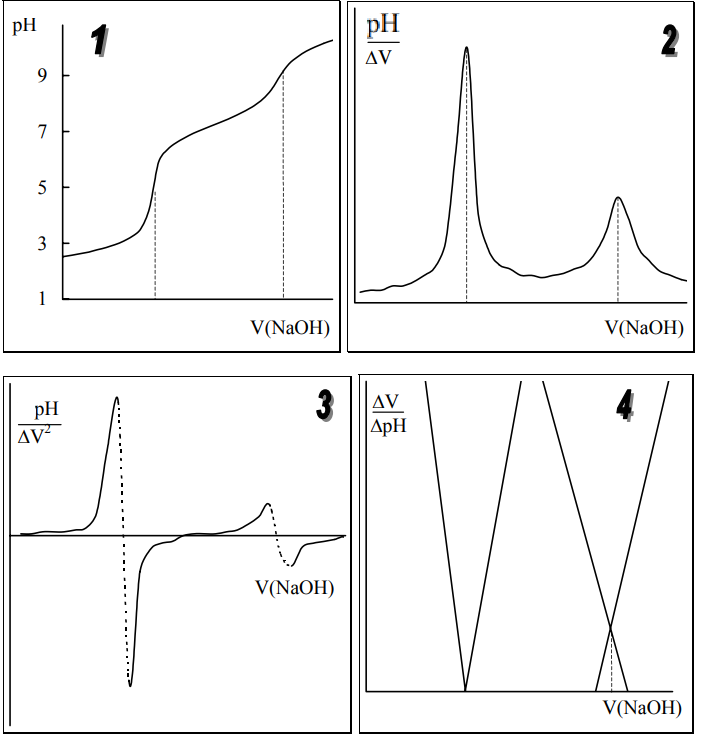
Конечную точку титрования обнаруживают с использованием кривой титрования, её производных, а также методом Грана.
На рис. 26.3 показаны различные варианты обнаружения конечной точки титрования фосфорной кислоты гидроксидом натрия. Конечной точке титрования на исходной кривой титрования соответствует точка максимального наклона (точка перегиба) кривой, на её первой производной – точка максимума, второй производной – точка пересечения прямой, соединяющей две ветви кривой, с осью абсцисс. При использовании метода Грана конечной точке титрования соответствует точка пересечения прямых.
Рис. 26.3. Кривая
потенциометрического титрования
фосфорной кислоты (1), её первая (2) и
вторая (3) производные, а также обнаружение
конечных точек титрования методом Грана
(4). 
Преимущества потенциометрического титрования перед титрованием с визуальным обнаружением конечной точки титрования заключаются в том, что:
1) отсутствует субъективная ошибка обнаружения конечной точки титрования;
2) определение веществ может проводиться в окрашенных и мутных растворах;
3) имеется возможность дифференцированного титрования компонентов смеси (в особенности, при использовании неводного титрования);
4) возможна автоматизации процесса титрования.
