
- •1. Титриметрический метод анализа. Сущность метода. Классификация титриметрических методов анализа.
- •2. Международная система единиц (си). Основные физические величины и формулы для расчёта, применяемые в количественном анализе.
- •3. Способы титрования. Расчёты в титриметрическом методе по результатам титрования.
- •5 . Буферные растворы. Расчет рН буферных растворов.
- •6. Понятие гидролиза. Расчёт рН гидролизующихся солей.
- •Расчёт рН гидролизующихся солей (?):
- •7. Сущность метода кислотно-основного титрования. Рабочие растворы. Приготовление и стандартизация рабочих растворов.
- •3. Титрование слабого основания сильной кислотой
- •Выводы по кривым нейтрализации
- •9. Индикаторы (понятие). Требования, предъявляемые к индикаторам. Кислотно-основные индикаторы.
- •10. Интервал перехода окраски кислотно-основных индикаторов. Выбор индикатора.
- •11. Сущность методов комплексообразовательного титрования. Комплексонометрия.
- •12. Понятие о комплексонах. Механизм взаимодействия комплексона с ионами металлов.
- •14. Механизм действия металлохромных индикаторов (на примере эриохромчёрного т).
- •15. Расчёт кривых комплексонометрического титрования. Выбор индикатора.
- •16. Способы титрования, применяемые в комплексонометрии.
- •17. Повышение селективности комплексонометрических определений. (из тетради)
- •18. Оксидиметрия. Сущность метода. Окислительно-восстановительные потенциалы и направление реакции.
- •19. Индикаторы, применяемые в окислительно-восстановительном титровании. Выбор индикатора. (тетрадь)
- •20. Расчёт кривых окислительно-восстановительного титрования.
- •21. Перманганатометрия. Сущность метода. Рабочие растворы. (смотри тетрадь и лабу 3)
- •22. Перманганатометрическое определение восстановителей и окислителей.
- •23. Перманганатометрическое определение веществ, не обладающих окислительно-восстановительными свойствами.
- •24. Перманганатометрическое определение органических соединений.
- •25. Йодометрия. Сущность метода. Рабочие растворы. Способы фиксирования точки эквивалентности.
- •26. Йодометрическое определение окислителей и восстановителей. (см. Лабу 4)
- •Определение восстановителей
- •27. Йодометрическое определение веществ, не проявляющих окислительно-восстановительных свойств.
- •28. Йодометрическое определение органических веществ.
- •29. Особенности и области применения инструментальных методов анализа.
- •30. Сущность потенциометрических методов анализа.
- •31. Электроды сравнения. Устройство и уравнение потенциала для хлоридсеребряного электрода. (лаба 5)
- •32. Металлические индикаторные электроды.
- •33. Электроды с жесткой матрицей, с кристаллической мембраной.
- •34. Прямая потенциометрия. Общая характеристика метода. Приемы, используемые в прямой потенциометрии для определения концентрации вещества. (лаба 5)
- •35. Определение точки эквивалентности в потенциометрическом титровании.
- •36. Сущность кулонометрии; вывод уравнения для объединенного закона Фарадея, условия проведения прямой и косвенной кулонометрии.
- •37. Достоинства кулонометрического титрования перед другими титриметрическими методами.
- •39. Прямая потенциостатическая кулонометрия (применение, схема установки, теоретические основы).
- •40. Косвенная амперостатическая кулонометрия. Схема установки. Сущность метода.
- •Для тех, кто на «отлично»:
- •41. Спектроскопические методы анализа. Электромагнитное излучение и его взаимодействие с веществом.
- •42. Спектроскопические методы анализа. Электромагнитный спектр.
- •44. Молекулярно-абсорбционная спектроскопия. Основные узлы приборов для молекулярно-абсорбционных методов анализа.
- •45. Явление фотоэффекта. Основные законы Столетова.
- •48. Атомно-абсорбционная спектроскопия. Основные положения метода.
- •49. Схема атомно-абсорбционного спектрофотометра. Основные узлы.
- •50. Атомно-эмиссионная спектроскопия (пламенная эмиссионная спектроскопия). Основные положения метода.
18. Оксидиметрия. Сущность метода. Окислительно-восстановительные потенциалы и направление реакции.
Методы объёмного анализа, основанные на окислительно-восстановительных реакциях, называются оксидиметрией или методами окислительно-восстановительного титрования.
В оксидиметрии применяют титрованные растворы окислителей (KMnO4, K2Cr2O7, I2, KBrO3) и восстановителей (FeSO4, CrSO4, TiCl3, SnCl2).
Все методы классифицируются в зависимости от применяемого рабочего раствора окислителя или восстановителя:
– перманганатометрия (KMnO4), – йодометрия (I2, Na2S2O3),
– хроматометрия (K2Cr2O7), – броматометрия (KBrO3) и т.д.
Окислительно-восстановительные потенциалы и направление реакции.
С точки зрения электронной теории окислительно-восстановительные процессы включают перенос электронов от одного реагирующего вещества к другому. Окислитель, присоединяя электроны, восстанавливается, а восстановитель, отдавая электроны, окисляется. Например,
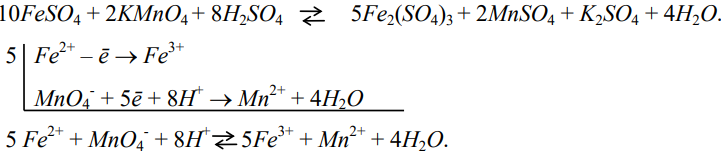
Окислители и восстановители различают между собой по силе, т.е. по химической активности. Величиной, количественно характеризующей окислительные или восстановительные способности атомов или ионов, является величина окислительно-восстановительного потенциала.
В чистом виде ни окислитель, ни восстановитель в растворе не существуют. Обязательно присутствуют продукты их окисления (восстановления). Поэтому говорят об окислительно-восстановительном потенциале окислительно-восстановительной пары (Fe3+/ Fe2+, MnO4- / Mn2+).
Величина окислительно-восстановительного потенциала зависит не только от входящих в её состав окислителя и восстановителя, но и от отношения их концентраций. Если концентрации окисленной и восстановленной форм элемента равны и определяются как 1 моль/л, то такие окислительно-восстановительные потенциалы называются нормальными (стандартными) окислительно-восстановительными потенциалами (Е0).
Величины стандартных окислительно-восстановительных потенциалов определены относительно стандартного (нормального) водородного электрода, потенциал которого принят за нуль.
Чем больше нормальный
окислительный потенциал данной пары,
тем более сильным окислителем является
его окисленная форма и тем более слабым
восстановителем – восстановленная
форма. Например,
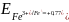 B,
a
B,
a
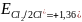 B. Следовательно, Сl2
более сильный окислитель, чем Fe3+,
a Fe2+
более сильный восстановитель, чем Сl-.
B. Следовательно, Сl2
более сильный окислитель, чем Fe3+,
a Fe2+
более сильный восстановитель, чем Сl-.
Если
измерить потенциал индифферентного
электрода, опущенного в раствор
окислительно-восстановительной пары
в нестандартных условиях, то такой
потенциал называется реальным
потенциалом пары
(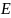 )
и рассчитывается по уравнению
Нернста:
)
и рассчитывается по уравнению
Нернста:
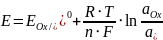
где  – универсальная
газовая постоянная, 8,314 Дж;
– универсальная
газовая постоянная, 8,314 Дж; 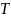 – температура, К;
– температура, К;
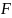 – число Фарадея, 96500 Кл;
– число Фарадея, 96500 Кл;  ,
,
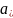 – активности окисленной и восстановленной
форм.
– активности окисленной и восстановленной
форм.
Подставив все значения и, перейдя от натурального к десятичному логарифму, получим:
 , при 25 °C.
, при 25 °C.
Чем больше концентрация окисленной формы и меньше концентрация восстановленной, тем больше потенциал системы. Если взять сложную систему, например, кислородсодержащую:
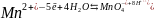 ,
,
то в этом случае потенциал будет зависеть и от кислотности среды
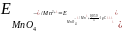
Чем больше
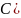 ,
тем больше потенциал.
,
тем больше потенциал.
Т.о., изменяя концентрацию окисленной и восстановленной форм за счёт процессов осаждения или комплексо-образования, а также регулируя рН, можно управлять окислительно-восстановительной реакцией.
