
- •1. Титриметрический метод анализа. Сущность метода. Классификация титриметрических методов анализа.
- •2. Международная система единиц (си). Основные физические величины и формулы для расчёта, применяемые в количественном анализе.
- •3. Способы титрования. Расчёты в титриметрическом методе по результатам титрования.
- •5 . Буферные растворы. Расчет рН буферных растворов.
- •6. Понятие гидролиза. Расчёт рН гидролизующихся солей.
- •Расчёт рН гидролизующихся солей (?):
- •7. Сущность метода кислотно-основного титрования. Рабочие растворы. Приготовление и стандартизация рабочих растворов.
- •3. Титрование слабого основания сильной кислотой
- •Выводы по кривым нейтрализации
- •9. Индикаторы (понятие). Требования, предъявляемые к индикаторам. Кислотно-основные индикаторы.
- •10. Интервал перехода окраски кислотно-основных индикаторов. Выбор индикатора.
- •11. Сущность методов комплексообразовательного титрования. Комплексонометрия.
- •12. Понятие о комплексонах. Механизм взаимодействия комплексона с ионами металлов.
- •14. Механизм действия металлохромных индикаторов (на примере эриохромчёрного т).
- •15. Расчёт кривых комплексонометрического титрования. Выбор индикатора.
- •16. Способы титрования, применяемые в комплексонометрии.
- •17. Повышение селективности комплексонометрических определений. (из тетради)
- •18. Оксидиметрия. Сущность метода. Окислительно-восстановительные потенциалы и направление реакции.
- •19. Индикаторы, применяемые в окислительно-восстановительном титровании. Выбор индикатора. (тетрадь)
- •20. Расчёт кривых окислительно-восстановительного титрования.
- •21. Перманганатометрия. Сущность метода. Рабочие растворы. (смотри тетрадь и лабу 3)
- •22. Перманганатометрическое определение восстановителей и окислителей.
- •23. Перманганатометрическое определение веществ, не обладающих окислительно-восстановительными свойствами.
- •24. Перманганатометрическое определение органических соединений.
- •25. Йодометрия. Сущность метода. Рабочие растворы. Способы фиксирования точки эквивалентности.
- •26. Йодометрическое определение окислителей и восстановителей. (см. Лабу 4)
- •Определение восстановителей
- •27. Йодометрическое определение веществ, не проявляющих окислительно-восстановительных свойств.
- •28. Йодометрическое определение органических веществ.
- •29. Особенности и области применения инструментальных методов анализа.
- •30. Сущность потенциометрических методов анализа.
- •31. Электроды сравнения. Устройство и уравнение потенциала для хлоридсеребряного электрода. (лаба 5)
- •32. Металлические индикаторные электроды.
- •33. Электроды с жесткой матрицей, с кристаллической мембраной.
- •34. Прямая потенциометрия. Общая характеристика метода. Приемы, используемые в прямой потенциометрии для определения концентрации вещества. (лаба 5)
- •35. Определение точки эквивалентности в потенциометрическом титровании.
- •36. Сущность кулонометрии; вывод уравнения для объединенного закона Фарадея, условия проведения прямой и косвенной кулонометрии.
- •37. Достоинства кулонометрического титрования перед другими титриметрическими методами.
- •39. Прямая потенциостатическая кулонометрия (применение, схема установки, теоретические основы).
- •40. Косвенная амперостатическая кулонометрия. Схема установки. Сущность метода.
- •Для тех, кто на «отлично»:
- •41. Спектроскопические методы анализа. Электромагнитное излучение и его взаимодействие с веществом.
- •42. Спектроскопические методы анализа. Электромагнитный спектр.
- •44. Молекулярно-абсорбционная спектроскопия. Основные узлы приборов для молекулярно-абсорбционных методов анализа.
- •45. Явление фотоэффекта. Основные законы Столетова.
- •48. Атомно-абсорбционная спектроскопия. Основные положения метода.
- •49. Схема атомно-абсорбционного спектрофотометра. Основные узлы.
- •50. Атомно-эмиссионная спектроскопия (пламенная эмиссионная спектроскопия). Основные положения метода.
14. Механизм действия металлохромных индикаторов (на примере эриохромчёрного т).
Чаще всего точку эквивалентности в комплексонометрии устанавливают с помощью металлоиндикаторов (металлохромных индикаторов) - органических красителей, образующих с ионами металлов интенсивно окрашенные комплексы, менее прочные, чем комплексы металлов с комплексоном III.
Механизм изменения окраски металлохромных индикаторов рассмотрим на примере индикатора эриохром чёрный Т (ЭХЧТ, хромоген чёрный, ЕТ-00).
Окраска
раствора индикатора меняется с изменением
рН:
![]()
При
взаимодействии металла с индикатором
протекает следующая реакция:
![]()
Окраска раствора при титровании комплексоном III изменяется от виннокрасной (окраска комплекса) до синей (окраска индикаторного вещества):
![]()
15. Расчёт кривых комплексонометрического титрования. Выбор индикатора.
Смотри вопрос 8 и 10 + лабу 2
16. Способы титрования, применяемые в комплексонометрии.
Смотри вопрос 3
Дополнение из тетради:
1) Прямое титрование: после установления необходимого значения pH подходящими буферными р-ром определяемый ион оттитровывают р-ром комплексона III. Так определяют Zn, Ca, Mg, Ni, Pb, Cu2+, Cd2+, Fe3+, Al3+, Ba, Sr.
2) Обратное титрование: к определяемому иону Ме добавляют точно изм. объем стандартного р-ра комплексона, затем оттитровывают избыток комплексона стандартным р-ром ZnSO4 или MgSO4. Применяют способ, когда в р-ре катионы обр. осадок или реакция комплексообразования протекает медленно, когда образуется неустойч. комплексы с комплексоном III. Так определяют Co2+, Mn2+, Al3+, Cr3+, Ca и Mg в осадках, не р-римых в H2O, Pb2+ в осадке.
3) Заместительное
титрование:
к анализируемому р-ру прибавл. избыток
комплексоната магния (MgY2-).
Если определяемый ион обр. более
устойчивые комплексонаты, чем Mg2+,
что характерно для большинства ионов
Ме, то протекает р-ия:
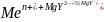
В результате освобождается эквивалентное определяемому иону Ме кол-во Mg2+, кот. можно оттитровать комплексоном III.
Таким методом титруют Ме для кот. отсутствует подходящий индикатор.
17. Повышение селективности комплексонометрических определений. (из тетради)
Комплексон III явл. универсальным реагентом, т.к. реагирует со многими разнозарядными катионами. Поэтому определение 1-го катиона в присутствии других явл. весьма сложной задачей.
Повысить селективность определения (избирательность) одного иона Ме в смеси других можно несколькими способами:
1) Изменяя pH раствора.
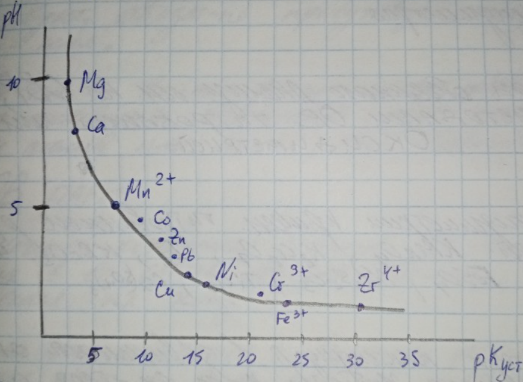
Образование комплексонов различных катионов находится в большой зависимости от pH р-ра.
Некоторые 4-хвалентные ионы Ме обр. комплексоны в относительно сильно-кислых р-рах, pH < 1.
Например, Ti и Zr, катионы тяжелых двухвалентных Ме: pH 3-6, щелочно-земельных Ме: pH 7-10.
Изменяя pH раствора, можно последовательно оттитровать несколько ионов.
2) Маскируя ионы.
Маскирование – химическое связывание какого-либо компонента прибавленным маскирующим в-вом так, что данный компонент не принимает участия в реакции.
Различают осадительное, комплексообразовательное и окислительно-восстановительное маскирование.
