
- •1. Титриметрический метод анализа. Сущность метода. Классификация титриметрических методов анализа.
- •2. Международная система единиц (си). Основные физические величины и формулы для расчёта, применяемые в количественном анализе.
- •3. Способы титрования. Расчёты в титриметрическом методе по результатам титрования.
- •5 . Буферные растворы. Расчет рН буферных растворов.
- •6. Понятие гидролиза. Расчёт рН гидролизующихся солей.
- •Расчёт рН гидролизующихся солей (?):
- •7. Сущность метода кислотно-основного титрования. Рабочие растворы. Приготовление и стандартизация рабочих растворов.
- •3. Титрование слабого основания сильной кислотой
- •Выводы по кривым нейтрализации
- •9. Индикаторы (понятие). Требования, предъявляемые к индикаторам. Кислотно-основные индикаторы.
- •10. Интервал перехода окраски кислотно-основных индикаторов. Выбор индикатора.
- •11. Сущность методов комплексообразовательного титрования. Комплексонометрия.
- •12. Понятие о комплексонах. Механизм взаимодействия комплексона с ионами металлов.
- •14. Механизм действия металлохромных индикаторов (на примере эриохромчёрного т).
- •15. Расчёт кривых комплексонометрического титрования. Выбор индикатора.
- •16. Способы титрования, применяемые в комплексонометрии.
- •17. Повышение селективности комплексонометрических определений. (из тетради)
- •18. Оксидиметрия. Сущность метода. Окислительно-восстановительные потенциалы и направление реакции.
- •19. Индикаторы, применяемые в окислительно-восстановительном титровании. Выбор индикатора. (тетрадь)
- •20. Расчёт кривых окислительно-восстановительного титрования.
- •21. Перманганатометрия. Сущность метода. Рабочие растворы. (смотри тетрадь и лабу 3)
- •22. Перманганатометрическое определение восстановителей и окислителей.
- •23. Перманганатометрическое определение веществ, не обладающих окислительно-восстановительными свойствами.
- •24. Перманганатометрическое определение органических соединений.
- •25. Йодометрия. Сущность метода. Рабочие растворы. Способы фиксирования точки эквивалентности.
- •26. Йодометрическое определение окислителей и восстановителей. (см. Лабу 4)
- •Определение восстановителей
- •27. Йодометрическое определение веществ, не проявляющих окислительно-восстановительных свойств.
- •28. Йодометрическое определение органических веществ.
- •29. Особенности и области применения инструментальных методов анализа.
- •30. Сущность потенциометрических методов анализа.
- •31. Электроды сравнения. Устройство и уравнение потенциала для хлоридсеребряного электрода. (лаба 5)
- •32. Металлические индикаторные электроды.
- •33. Электроды с жесткой матрицей, с кристаллической мембраной.
- •34. Прямая потенциометрия. Общая характеристика метода. Приемы, используемые в прямой потенциометрии для определения концентрации вещества. (лаба 5)
- •35. Определение точки эквивалентности в потенциометрическом титровании.
- •36. Сущность кулонометрии; вывод уравнения для объединенного закона Фарадея, условия проведения прямой и косвенной кулонометрии.
- •37. Достоинства кулонометрического титрования перед другими титриметрическими методами.
- •39. Прямая потенциостатическая кулонометрия (применение, схема установки, теоретические основы).
- •40. Косвенная амперостатическая кулонометрия. Схема установки. Сущность метода.
- •Для тех, кто на «отлично»:
- •41. Спектроскопические методы анализа. Электромагнитное излучение и его взаимодействие с веществом.
- •42. Спектроскопические методы анализа. Электромагнитный спектр.
- •44. Молекулярно-абсорбционная спектроскопия. Основные узлы приборов для молекулярно-абсорбционных методов анализа.
- •45. Явление фотоэффекта. Основные законы Столетова.
- •48. Атомно-абсорбционная спектроскопия. Основные положения метода.
- •49. Схема атомно-абсорбционного спектрофотометра. Основные узлы.
- •50. Атомно-эмиссионная спектроскопия (пламенная эмиссионная спектроскопия). Основные положения метода.
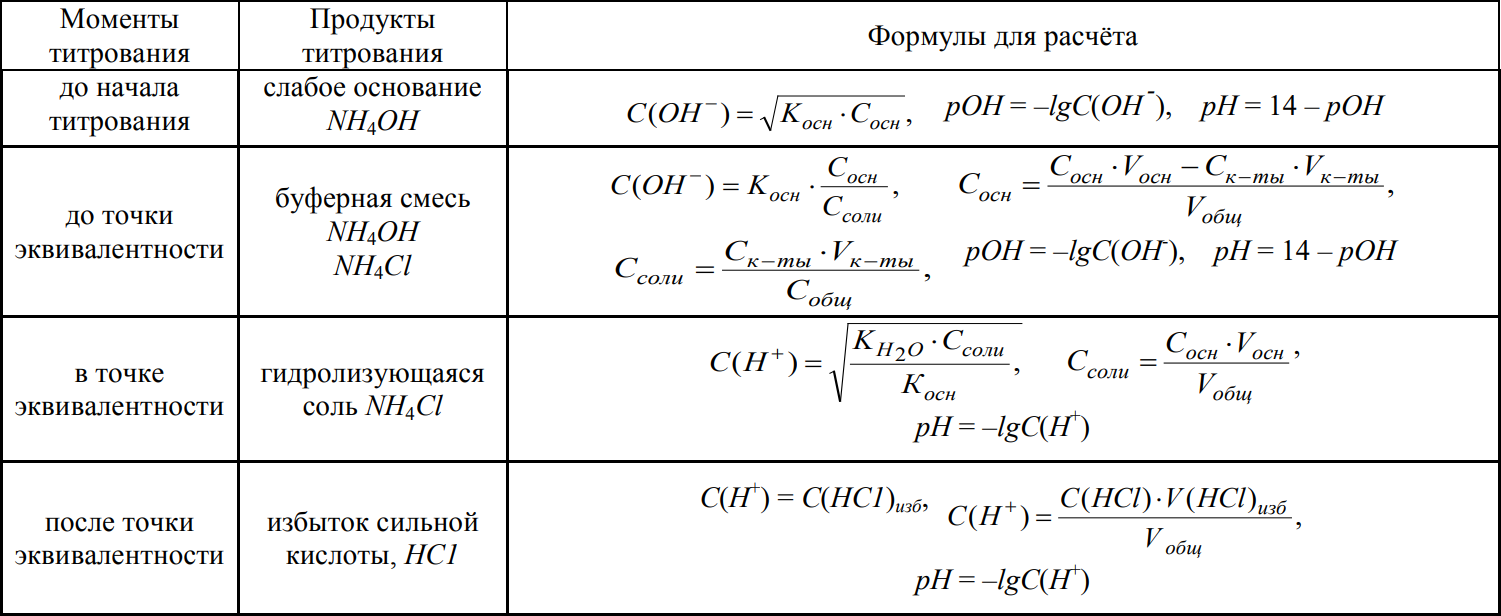
3. Титрование слабого основания сильной кислотой
Предположим, что для определения взято слабое основание NH4OH и его титруют сильной кислотой НСl.
При этом будет протекать следующая реакция:
NH4OH + HCl = NH4Cl + H2O.
Таблица для расчёта кривой титрования будет иметь следующий вид:
Таблица 3 - Расчёт рН при титровании слабого основания сильной кислотой
Выводы по кривым нейтрализации
1. Чем слабее кислота (или основание), т. е. меньше их константа диссоциации, тем меньше величина скачка титрования.
2. Чем больше концентрация кислоты (или основания), тем больше скачок титрования и тем более резко изменяется рН вблизи точки эквивалентности.
3. Точка эквивалентности и нейтральности совпадает только в случае титрования сильной кислоты сильным основанием и наоборот.
9. Индикаторы (понятие). Требования, предъявляемые к индикаторам. Кислотно-основные индикаторы.
Индикаторами называют такие вещества, которые дают возможность с известной степенью достоверности установить конечную точку титрования.
Требования, предъявляемые к индикаторам:
1. Изменение окраски индикатора должно проходить в узком интервале рН.
2. Окраска должна изменяться резко и близи точки стехиометричности.
3. Окраска должна быть интенсивной.
4. Изменение окраски должно быть обратимым.
Кислотно-основными индикаторами – слабые органические к-ты и основания, изменение окраски которых зависит от кислотности среды (pH).
10. Интервал перехода окраски кислотно-основных индикаторов. Выбор индикатора.
Интервал перехода индикатора – диапазон рН, в которой индикатор меняет свою окраску.
рН в точке эквивалентности должен попадать в интервал перехода окраски индикатора. На него влияют температура, ионная сила раствора, присутствие органических растворителей и коллоидных частиц.
Выбор индикатора:
Различают одноцветные и двухцветные кислотно-основные индикаторы. У одноцветных индикаторов одна форма окрашена, другая – нет.
Правило выбора индикатора — при титровании используется такой индикатор, который изменяет свою окраску около точки эквивалентности, то есть интервал перехода окраски индикатора должен по возможности совпадать со скачком титрования.
Например, фенолфталеин-молекулярная бесцветная, ионная красная. Метиловый оранжевый имеет обе формы окрашенных, молекулярную красную, ионную жёлтую.
Главной количественной характеристикой индикатора является константа диссоциации.
Значение рН, при котором проявляется окраска одноцветного индикатора, зависит от концентрации индикатора в растворе. У двухцветного индикатора переход цвета происходит, когда концентрация одной формы превышает концентрацию другой формы.
Изменение цвета индикатора связано с существенным изменением молекулярной структуры. В соответствии с хромофорной теорией окраска соединения связана с наличием в его молекуле так называемых хромофорных групп и ауксохромных, влияющих на цвет в присутствии хромофорных. Идёт так называемое присоединение или отщепление протона.
11. Сущность методов комплексообразовательного титрования. Комплексонометрия.
Методы
комплексообразовательного титрования
основаны на использовании реакций
комплексообразования между определяемым
компонентом и титрантом, например:

Методами комплексообразовательного титрования можно количественно определять разнообразные катионы (Ag+, Hg2+, Al3+ и др.) и анионы (CN-, F-, Cl- и др.), склонные вступать в реакции комплексообразования.
Реакции, используемые в комплексообразовании, должны отвечать общим требованиям объёмного анализа: 1. Реакции процесса комплексообразования должны протекать наиболее полно, для этого образующийся комплекс должен отличаться высокой устойчивостью.
2. Реакции должны протекать с большой скоростью – это условие выполняется только для ионов переходных металлов с частично заполненными d- орбиталями (Ni2+, Co2+, Co3+, Cu2+, Mo4+, W4+, Au3+, Mn2+, Fe2+, Fe3+, Re4+, Os2+, In2+, Rh2+, Pd2+), а также для катионов с конфигурацией благородного газа (Li+, Na+, K+, Pd2+, Be2+, Mg2+, Ca2+, Sn2+, Ba2+, Al3+, La3+, Ce3+, Ti4+, Zr4+, Hf4+, Nb5+, Ta5+).
3. Реакции
комплексообразования должны приводить
к образованию комплекса с минимальным
количеством лигандов, например 2, как в
реакции
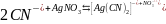 ,
или ещё лучше, если образуется только
один комплекс, в котором к каждому иону
металла присоединён только один лиганд.
Для этого лиганд должен быть полидентатным
и содержать донорные группы, способные
занимать несколько мест в координационной
сфере комплексообразователя. В подобных
случаях благодаря хелатному эффекту
образующиеся комплексы обладают высокой
устойчивостью, которая обуславливает
полное связывание иона металла при
титровании.
,
или ещё лучше, если образуется только
один комплекс, в котором к каждому иону
металла присоединён только один лиганд.
Для этого лиганд должен быть полидентатным
и содержать донорные группы, способные
занимать несколько мест в координационной
сфере комплексообразователя. В подобных
случаях благодаря хелатному эффекту
образующиеся комплексы обладают высокой
устойчивостью, которая обуславливает
полное связывание иона металла при
титровании.
Комплексонометрия — титриметрический метод анализа, основанный на использовании реакций ионов металлов-комплексообразователей с комплексонами, сопровождающихся образованием устойчивых малодиссоциированных растворимых в воде внутрикомплексных солей.
Органические соединения, представляющие собой производные аминополикарбоновых кислот, называют комплексонами, а титриметрический метод, основанный на реакциях комплексообразования между определяемым компонентом и комплексонами, называют комплексонометрическим.
